吉西他濱聯合替吉奧序貫替吉奧同步放化療與聯合化療治療局部晚期胰腺癌比較觀察
李士猛
(宿遷市第一人民醫院腫瘤科,江蘇 宿遷 223800)
吉西他濱聯合替吉奧序貫替吉奧同步放化療與聯合化療治療局部晚期胰腺癌比較觀察
李士猛
(宿遷市第一人民醫院腫瘤科,江蘇 宿遷 223800)
[摘要]目的探討吉西他濱聯合替吉奧序貫替吉奧同步放化療與聯合化療在局部晚期胰腺癌治療中的臨床療效和安全性。方法39例診斷明確且無法手術的局部晚期胰腺癌患者在2種綜合治療方式后的生存狀況,分為A、B組,其中A組20例,B組19例,A組采用吉西他濱聯合替吉奧誘導化療后序貫同步放化療,以替吉奧為同步化療藥物;B組采用吉西他濱與替吉奧聯合化療。采用有效率、疾病控制率、臨床受益反應來評價近期療效;遠期隨訪以無進展生存期和總生存期為觀察終點,并對藥物的安全性進行評估。結果A組可評估患者16例,B組15例。在完成周期治療的患者中,A組有效率、疾病控制率均優于B組(分別為31.2% vs 26.7%,81.3% vs 73.3%),差異有統計學意義(P=0.015、0.047)。A組患者總的臨床受益反應率高于B組(80.6% vs 72.4%),差異有統計學意義(P=0.035);A組的疼痛評分降低及疼痛改善持續時間明顯優于B組,差異有統計學意義(P<0.05);2組體質量增加及KPS評分升高差異無統計學意義(P>0.05)。A組的中位無進展生存期和中位總生存期均略高于B組(5.8個月 vs 4.9個月,16.1個月 vs 15.3個月),但差異無統計學意義(P=0.423、0.348)。A組的1 a生存率(70.2%)略高于B組(67.9%),但差異無統計學意義(P=0.315)。在血液學毒性反應方面,A組發生率低于B組,差異有統計學意義(P<0.05);在胃腸道反應及肝、腎功能不全方面,A組與B組差異均無統計學意義(P均>0.05)。結論吉西他濱聯合替吉奧序貫替吉奧同步放化療較聯合化療在腫瘤局部控制及疼痛控制方面上更優,但2種綜合治療在提高患者的生存方面效果相近;2種綜合治療的毒副反應均可耐受,其中吉西他濱聯合替吉奧序貫替吉奧同步放化療較聯合化療的血液學毒性稍低。
[關鍵詞]局部晚期胰腺癌;吉西他濱;替吉奧;化療;放療
胰腺癌是一種高度惡性的消化道腫瘤,中位生存期極短,胰腺癌因其逐年上升的發病率和極高的致死率正在獲得越來越多的關注。局部晚期胰腺癌約占胰腺癌總數的50%~60%,因胰腺周圍解剖復雜,相鄰的重要臟器和大血管較多,結合胰腺癌較低的手術切除率及術后易復發的臨床特點,臨床上對局部晚期胰腺癌多采取非手術治療。局部晚期胰腺癌經過積極合理的綜合治療可以增加臨床獲益,但聯合化療、同步放化療和誘導化療后的同步放化療哪個方案更優越,臨床研究的結果尚不一致。為了探討吉西他濱聯合替吉奧序貫替吉奧同步放化療與聯合化療在局部晚期胰腺癌治療中的臨床療效和安全性,本研究前瞻性分析了我院收治的診斷明確且無法手術的局部晚期胰腺癌患者在2種綜合治療方式后的生存狀況,并對藥物的安全性進行評估。
1資料與方法
1.1一般情況與分組收集我院腫瘤科2012年1月至2014年3月期間診斷明確的且已失去手術機會的局部晚期胰腺癌患者39例,男23例,女16例,年齡43~75歲,中位年齡63歲,KPS評分≥70分。
腫瘤標志物檢測示CA199陽性率為74.3%,CEA陽性率為57.9%,且均經B超、CT、ERCP及病理(活檢或細胞學)等檢查確診,有組織細胞學依據。其中導管腺癌34例(87.2%),腺泡細胞癌4例(10.2%),囊腺癌1例(2.5%)。原發灶位于胰頭部28例(71.8%),胰體部6例(15.3%)、胰尾部5例(12.8%)。按TNM分期法,臨床分期為Ⅱ~Ⅲ期,無遠處轉移,經腫瘤外科及影像科會診無法手術切除。流行病學調查:吸煙(20支/d×10 a)14例(35.8%),飲酒(100 g×10 a)7例(17.9%),糖尿病4例(10.2%),胰腺炎病2例(5.1%),膽管疾病或膽管手術1例(2.5%)。
入組前均未接受抗腫瘤治療,每例患者治療前都有完整的臨床資料,所有入組患者均有不同程度的消瘦乏力、腹部疼痛或不適。納入治療的胰頭癌患者中有1例伴有上消化道不全梗阻癥狀,輔以內鏡下內支架置入術后緩解;1例明顯黃疸,輔以經皮經肝膽囊引流術后緩解。
將患者按隨機數字法隨機分為A組和B組,A組20例,B組19例,2組患者的一般臨床資料差異無統計學意義(P>0.05),具有可比性。A組采用吉西他濱聯合替吉奧誘導化療序貫同步放化療,以替吉奧為同步化療藥,B組采用吉西他濱聯合替吉奧聯合化療。以有效率、疾病控制率評價近期療效,并觀察治療前后體力及體質量改善狀況,以及止痛藥使用情況的變化等,計算臨床受益反應;遠期隨訪包括復查胸腹盆CT、腫瘤指標,并統計無進展生存期和總生存期;對血常規及肝、腎功能進行監測,對藥物的安全性進行評估。
1.2診斷標準采用中華醫學會外科學分會胰腺外科學組在2007年制定的胰腺癌診治指南,經病理學證實,且通過CT等輔助檢查、經腫瘤外科及影像科會診診斷為無法手術切除的局部晚期胰腺癌患者。
1.3病例納入及排除標準納入標準:1)年齡≥18歲;2)經病理學診斷明確的胰腺癌患者;3)經CT、PET-CT或MRI檢查,或術中探查不能手術切除的局部晚期胰腺癌患者均存在影像學可測量病灶;4)KPS評分≥70分;5)預計生存期>6個月,且入組前未接受有效抗腫瘤治療,包括中藥的治療;6)既往無惡性腫瘤病史,經實驗室檢查可耐受本研究所用的治療方案;7)患者和家屬均簽署知情同意書,愿意接受本研究的2種治療方案的其中一種,依從性好。
排除標準:1)年齡<18歲;2)合并嚴重的全身多系統疾病、嚴重的血液系統疾病以及精神病;3)經實驗室檢查不能耐受本研究所用的治療方案;4)既往接受過抗腫瘤治療;5)胰腺淋巴瘤或內分泌瘤;6)依從性不好。
1.4治療方法所有的納入患者均需要住院治療觀察病情,經門診收治住院后,進行常規的對癥處理及護理管理,改善患者的一般情況,糾正貧血,控制感染等。2組患者前2周期的治療方案相同,意在排除治療開始后短期內發生遠處轉移的患者,將接受放療有利的患者分離出來。A組:先采用誘導化療,吉西他濱 1 000 mg·m-2,靜脈滴注,d1,8;替吉奧 40 mg·m-2口服,2次/d,d1~14,每3周為1周期,連續應用2周期后,復查病情穩定未出現遠處轉移的患者,繼續予同步放化療序貫治療。
放療計劃系統由美國CMS公司設計,放療設備為西門子醫用直線加速器。利用體部真空墊固定患者體部,平臥后抽真空,做皮膚標記,上腹部CT平靜呼吸下掃描,層厚5 mm,以得到病灶及其上下各10~15 cm全部影像資料。將掃描信息輸入治療計劃系統中,準確勾畫靶區并標記周圍重要敏感器官,如胃、脊髓和雙側腎臟等重要器官。確定腫瘤體積(GTV),根據GTV和周圍危及器官設計臨床靶區(CTV),一般為GTV外放10 mm。為克服呼吸影響和擺位誤差,設計計劃靶區(PTV)范圍,為CTV外放10 mm。根據靶體積形狀和大小,采用6 MV X線直線加速器進行常規適形調強放療;常規分割,總劑量50 Gy/25次,輔以替吉奧40 mg·m-2口服,2次/d,同步化療。B組:吉西他濱1 000 mg·m-2,靜脈滴注,d1,8;替吉奧40 mg·m-2口服,2次/d,d1~14,每3周為1周期,連續應用2周期后,復查病情穩定未出現遠處轉移的患者,繼續予該方案聯合化療2周期。
1.5觀察指標與隨訪近期療效評價采用WHO的RECIST實體瘤療效反應評價標準,以胰腺原發灶為目標病灶,觀察目標病灶最長徑總和的變化,以腫瘤標志物的升高等為非目標病灶,將近期療效分為CR、PR、SD、PD,以CR+PR計算有效率,以CR+PR+SD計算疾病控制率。
另一項近期療效評價指標是臨床受益反應。對于局部晚期胰腺癌,目前很難從現有的治療手段中獲得完全的緩解和較長的遠期生存時間,影像學也很難精確地分辨和測量該腫瘤的變化,因此,目前仍以姑息性治療為主,而且癥狀緩解和體力狀況改善的價值也優于客觀腫瘤消退,臨床受益反應正是這種針對疼痛、體力狀況等的綜合評價手段,已成為目前最常用的腫瘤療效評價指標之一[1]。研究開始后,每周觀察入組患者體力、體質量改善狀況以及止痛藥使用情況的變化等,計算臨床受益反應,具體評定標準參考1997年Burris等[2]制定的臨床受益反應標準:1)下列指標至少一項好轉并維持不少于4周,并且其他指標無惡化:體力狀況改善≥20分;鎮痛藥用量減少≥50%;疼痛強度減輕≥50%;體質量增加≥7%,但要排除體液潴留;2)鎮痛藥用量、疼痛強度及體力狀況穩定并維持4周以上。符合上述標準均可評為臨床受益病例。
遠期隨訪包括復查胸腹盆CT、腫瘤指標,并統計無進展生存期和總生存期。
毒副反應采用WHO抗腫瘤藥物急性與亞急性毒副反應分度標準進行分度,涵蓋9個器官系統,由28個項目組成[3]。定期進行血常規和肝、腎功能等的檢測以評價藥物的毒副反應。
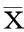
2結果
2.1隨訪和治療情況隨訪至2014年12月,隨訪率為100%。治療中每2周期、治療完成后1個月及每隔3個月復查1次。A組有4例患者在2周期聯合化療后出現短期遠處轉移,共16例患者順利完成序貫同步放化療。B組有3例患者在2周期聯合化療后出現遠處轉移,有1例患者因出現嚴重梗阻性黃疸、肝功能嚴重受損而終止聯合化療,共15例患者順利完成4周期聯合化療。
2.22組近期療效比較A組中完成序貫放化療的16例患者中,CR 0例、PR 5例、SD 8例、PD 3例,有效率31.2%,疾病控制率81.3%。B組中完成4周期聯合化療的15例患者中,CR 0例、PR 4例、SD 7例、PD 4例,有效率26.7%,疾病控制率73.3 %;在完成治療的患者中,A組有效率、疾病控制率均高于B組,差異有統計學意義(P=0.015、0.047)。見表1。
表12組近期療效比較
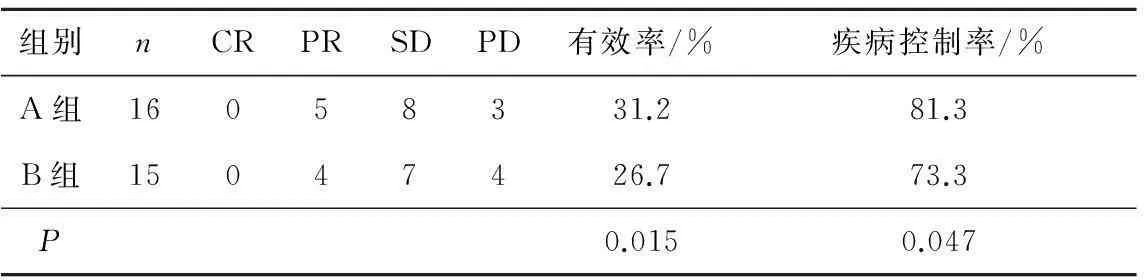
組別nCRPRSDPD有效率/%疾病控制率/%A組16058331.281.3B組15047426.773.3P0.0150.047
2.32組患者治療后的臨床受益反應比較比較A組與B組在KPS評分改善、體質量增加、疼痛控制3項指標方面的差異,A組16例患者中15例食欲好轉;9例體質量增加并持續,3例保持穩定,4例體質量減輕;11例持續4周以上鎮痛劑用量下降了50%,4例疼痛完全消失;KPS評分變化也較小,13例保持穩定,2例增加并持續4周以上,1例KPS評分下降。綜合指標,共有13例在臨床受益反應中受益,臨床受益反應率為80.6%(13/16)。B組中完成4周期聯合化療的15例患者中14例食欲好轉;8例體質量增加并持續,4例保持穩定,3例體質量減輕;3例黃疸治療后1個月全部消退;10例腹痛癥狀明顯改善,持續4周以上鎮痛劑用量下降了50%,3例疼痛完全消失;KPS評分變化較小,12例保持穩定,1例增加并持續,2例KPS評分下降。綜合以上指標,共有11例在臨床受益反應中受益,臨床受益反應率為72.4%(11/15)。A組患者總的臨床受益反應率高于B組,差異有統計學意義(P=0.035)。其中A組的疼痛評分降低及疼痛改善持續時間明顯優于B組,差異有統計學意義(P<0.05);但體質量增加及KPS評分升高2組相似,差異無統計學意義(P>0.05)。見表2。
表22組患者治療后的臨床受益反應比較
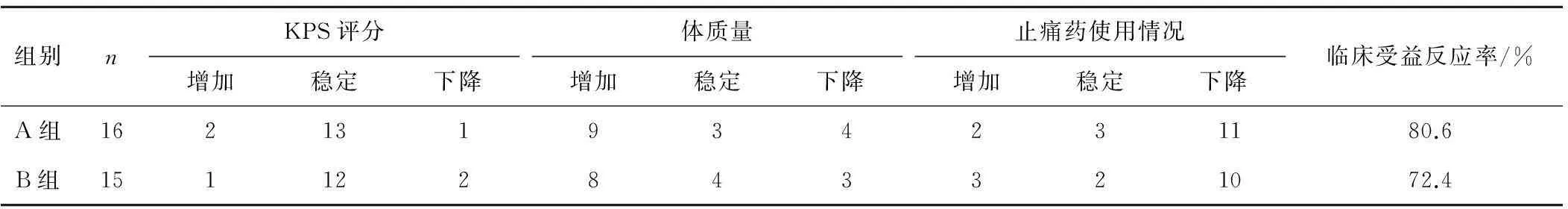
組別nKPS評分增加穩定下降體質量增加穩定下降止痛藥使用情況增加穩定下降臨床受益反應率/%A組162131934231180.6B組151122843321072.4
2.42組患者生存狀況比較納入研究的2組患者中,A組中位無進展生存期為5.8個月,中位總生存期為16.1個月;B組中位無進展生存期為4.9個月,中位總生存期為15.3個月。A組的中位無進展生存期和中位總生存期均略高于B組,但差異無統計學意義(P=0.423、0.348)。A組的1 a生存率(70.2%)略高于B組(67.9%),差異無統計學意義(P=0.315)。見表3。
2.52組毒副反應比較31例患者均出現了不同程度的毒副反應,經對癥支持治療后均有好轉,順利地完成了治療計劃。急性毒副反應主要表現為Ⅰ~Ⅲ度血液學毒性和Ⅰ、Ⅱ度胃腸道反應(僅見1例Ⅳ度血液學毒性),其次表現為輕度(Ⅰ、Ⅱ度)肝、腎功能損害,未見重度肝、腎功能損害。
表32組患者生存狀況比較

組別n中位無進展生存期/月中位總生存期/月1a生存率/%A組165.816.170.2B組154.915.367.9P0.4230.3480.315
在血液學毒性的分析上,A組低于B組,差異有統計學意義(P<0.05);在胃腸道反應方面,包括惡心、嘔吐、腹瀉,2組比較差異均無統計學意義(P均>0.05);在肝、腎功能損害方面,2組差異無統計學意義(P>0.05)。見表4。
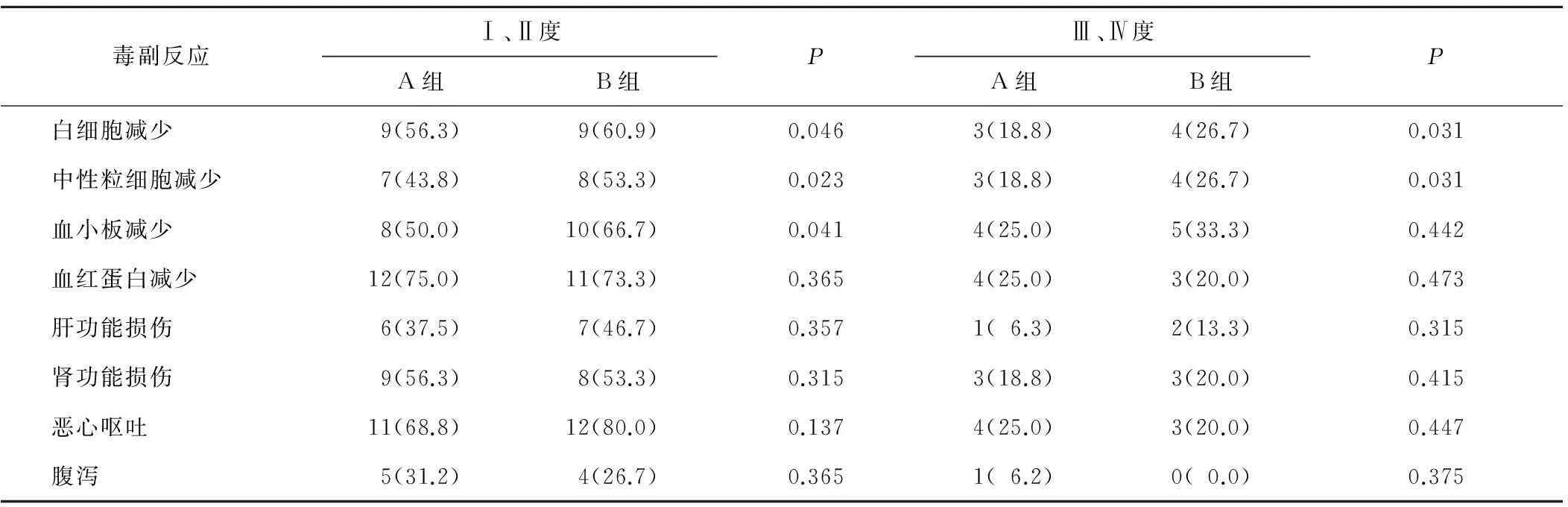
表4 2組毒副反應比較 n(%)
3討論
胰腺癌惡性程度高,早期診斷率低,發展迅速,且臨床可用的藥物及標準化療方案較少,治療遭遇瓶頸。隨著基礎及臨床研究的不斷深入,新的藥物及治療方式不斷出現,胰腺癌的診療水平已有所提高。本研究對比了臨床上常用的綜合治療方案在局部晚期胰腺癌中的療效。本研究結果發現,A組在有效率、疾病控制率方面比B組有所提高,分析原因,可能是因為放療在腫瘤局部控制方面更優。也有研究對該類試驗選用的近期評價指標是否可以精確反映臨床療效提出質疑,本研究采用的是RECIST實體瘤療效評價標準,觀察有效率和疾病控制率。有研究[4]表明在胰腺癌這種高度惡性的腫瘤中采用有效率結果是不可信的,因為現今仍然缺乏精確分辨和客觀測量這些腫瘤大小的影像學手段。近年來關于胰腺癌的臨床研究紛繁復雜,不同藥物及不同治療方式的組合相繼涌現,但結果令人滿意者少,且未達成共識,造成這種局面的原因,部分也與尚缺少精確而公認的影像學評估標準有關。
A組的臨床受益反應率也較B組高,特別是在疼痛控制方面更顯優勢。胰腺癌疼痛的原因主要是癌腫牽張或刺激了血管、腹腔神經叢,浸潤或壓迫了周圍內臟,侵及了內臟包膜或腹膜,阻塞了膽管或胰管等;癌腫本身的破潰,周圍組織的無菌性炎癥、壞死或水腫也會引起患者的疼痛。疼痛會影響患者的飲食和睡眠,加重患者心理負擔,影響生活質量,因此,止痛是胰腺癌治療的重要內容。但傳統止痛藥有不同的毒副反應,而且有的止痛藥有天花板效應,對神經痛的效果也不甚理想。放化療可以通過縮小瘤體、抑制癌細胞的快速增殖來改善臨床癥狀。放療對腫瘤局部控制優于化療,這也許是放療在疼痛控制方面更顯優勢的原因之一。
但本研究結果發現,在無進展生存期、總生存期和1 a生存率方面,A組與B組的差異均無統計學意義。不少研究[5]已經證實現代放療具有明顯的局部治療優勢,腫瘤局部控制率的提高無疑與遠期生存率存在正相關,但本研究卻未觀察到這一現象。分析原因,一方面可能是因為本研究尚未充分發揮現代放療的優勢,另一方面也有觀察終點指標帶來的偏倚。
胰腺癌是一種中等放射敏感的腫瘤,但腫瘤周圍解剖位置復雜,包繞臟器較多,使之成為傳統放療難以實施高劑量治療的主要障礙。目前國內外同步放化療治療局部晚期胰腺癌的放射治療大多仍采用的是常規劑量50 Gy左右,2013年的一項研究[6]針對局部晚期胰腺癌的前瞻性Ⅲ期臨床試驗采用的總劑量就是常規劑量54 Gy,該研究給出了陰性結果,提示化療后序貫同步放化療對比繼續化療沒有優勢。但我國空軍總醫院的學者對該試驗設計的合理性提出了質疑,如該研究中54 Gy的放療總劑量過小,沒有發揮當代放療的優勢,利用目前精確的放療技術,完全可以將總劑量加大,使得腫瘤的局部控制率得以增加。Chang等[7]回顧性分析了采用當今最先進的放療技術托姆刀(螺旋斷層放療系統)用于局部進展期胰腺癌的療效,共分析了39例患者,結果顯示放療生物等效劑量大于70 Gy可延長患者的總生存期,分析得出生物等效劑量是否大于70 Gy是腫瘤局部是否得以控制、遠期生存是否得以提高的獨立預后因素。可見,加大胰腺癌放療劑量,可使腫瘤局部控制率進一步增加,并可延長總生存期。雖然托姆刀并未在國內普及,我院也尚未引進該種先進的放療設備,但在現今已經普及的調強適形放療、圖像引導放療的情況下,放療劑量也是可以適當增加的,但由于缺乏大量臨床試驗的支持,以及觀念的限制,放療劑量一直沒有得到提高,期待未來可以改善。本研究采用的放療總劑量也是常規劑量50 Gy,常規分割,筆者認為該劑量也有增加的空間,尤其是現在照射精度不斷提高、周圍危機器官的防護越來越到位的今天,靶區劑量得以提高的硬件基礎已經具備,但臨床應用上仍有滯后,腫瘤的局部控制率仍有提高的空間。
除了放療總劑量有待提高外,有學者也對該種分割模式是否應該優化提出質疑。分次放療的生物學基礎是使分次照射休息期間亞致死損傷細胞得以修復以及干細胞得以再群體化,從而保護正常組織;同時通過腫瘤細胞的再氧合和再分布,從而對腫瘤有敏化作用。但分次治療使得總治療時間延長,亞致死的腫瘤細胞也可以得到修復和再群體化,抗腫瘤效果也打了折扣。根據放射生物學,人體組織中的早反應組織對分次劑量的變化不太敏感,但對總治療時間的變化很敏感,而腫瘤細胞更新快,類似于早反應組織,應盡量縮短總治療時間以保證腫瘤的控制效果。本研究是按照常規分割的,每次2 Gy,放療療程較長,不利于殺滅腫瘤;治療次數增加也增加了患者的經濟負擔,同時延緩了后期的鞏固性治療,因此高劑量少分割方式逐漸受到放療醫生的青睞,如第2類立體定向放療。第2類立體定向放療結合了三維適形放療、調強放療的優點,不再局限于小體積腫瘤,并可分次放療。關于胰腺癌的立體定向放療報道較多,分割總劑量25~36 Gy,1~5次完成,局部控制情況好,1 a局部控制率可達85%[8]。但立體定向放療分次劑量大,晚反應組織損傷嚴重,如晚期消化道出血、潰瘍、梗阻,但總體可耐受。本研究可借鑒立體定向放療的經驗,將分次劑量提高,如每次3~5 Gy,可提高腫瘤局部控制率,但當分次劑量大于2 Gy時,晚期并發癥明顯增加,減少晚反應組織的毒副反應保護周圍危機器官同樣重要。
另外,如何找到更好的放療增敏劑也很重要,替吉奧是目前較好的同步化療藥,但放療同步單藥化療遠處轉移仍很常見,是否可以同步多種化療藥物或靶向藥物值得探索。但這是否會提高療效、增加嚴重的毒副反應也有待證實。
另一方面,總生存期和無進展生存期等遠期觀察指標對研究結果也可能產生偏倚。總生存期容易觀察,是評價大多數治療方案最可靠的指標,但其定義為從隨機到死亡為止,難以排除后續治療包括支持治療的影響。與總生存期相比,無進展生存期更能反映腫瘤相關疾病的因果聯系,受到后續治療的影響較小,在胰腺癌這種完全應答率很低、總生存期獲益很困難的腫瘤中更合理。但如何定義腫瘤進展標準至今沒有權威的標準,本文采用RECIST標準,但仍需補充一些細節。
本研究結果顯示患者均未出現治療相關性死亡,僅1例Ⅳ度毒副反應,主要毒副反應為血液學毒性,輕度肝、腎功能損害和胃腸道反應。經統計學分析,兩2間血液學毒性發生率差異有統計學意義,表明B組較A組血液學毒性發生率更高,考慮可能與其中吉西他濱有較強的血液學毒性有關;2組間非血液學毒性發生率差異無統計學意義,表明A組和B組在治療局部晚期胰腺癌過程中的肝、腎功能損害程度及胃腸道反應相近。
放化療的毒副反應無疑制約著綜合治療的抗腫瘤療效,但大多數抗腫瘤手段在殺傷腫瘤的同時難免損傷正常組織。毒副反應有時可使治療被迫中止,甚至帶來致死的損傷。但毒副反應一定程度上可以反映抗腫瘤治療的療效。曾有學者[9]在研究乳腺癌時發現化療中出現骨髓抑制的患者有相對較好的預后。還有學者[10]發現在非小細胞肺癌的治療中,中性粒細胞減少程度與中位生存期成正相關。因此若在有效對癥支持治療下,如在升高血細胞的集落刺激因子、止瀉藥易蒙停、保肝護腎藥等的保護下,可以適當放寬對毒副反應的限制。
綜上所述,2種綜合治療均可使局部晚期胰腺癌獲益,尤其是以吉西他濱聯合替吉奧序貫替吉奧同步放化療方案效果更好,其止痛、退黃效果明顯,局部控制率高,毒副反應較繼續化療未增加,是治療局部晚期胰腺癌的一種安全有效的方法;但吉西他濱聯合替吉奧序貫替吉奧同步放化療方案局部控制率的提高卻并未帶來總生存期和無進展生存期的延長。本研究病例數尚少,有關照射劑量、分割次數、觀察指標也有爭議,因此要客觀評判該綜合方案治療胰腺癌的療效及毒副反映尚需進一步研究。另外,胰腺癌診斷與放療是高度依賴影像學的,目前的影響設備還不能完全滿足臨床需求,因此尋找更清晰的影像手段、更有效的放療增敏劑、更好組合化療與放療方案也是未來的研究方向。
參考文獻:
[1]賈林, 袁世珍.胰腺癌化療新指標-臨床受益療效及其應用[J].醫學綜述, 2002, 8(5):304-305.
[2]Burris HA 3rd, Moore MJ, Andersen J, et al.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial[J].J Clin Oncol, 1997,15(6):2403-2413.
[3]Falavigna M, Lima KM, Giacomazzi J, et al.Effects of lifestyle modification after breast cancer treatment: a systematic review protocol[J].Syst Rev,2014,3:72.
[4]Sakamoto J, Morita S, Yumiba T, et al.A phase II clinical trial to evaluate the effect of paclitaxel in patients with ascites caused by advanced or recurrent gastric carcinoma: a new concept of clinical benefit response for non-measurable type of gastric cancer[J].Jpn J Clin Oncol, 2003,33(5):238-240.
[5]Louvet C, Labianca R, Hammel P, et al.Gemcitabine in combination with oxaliplatin compared with gemcitabine alone in locally advanced or metastaticpancreatic cancer: results of a GERCOR and GISCAD phase Ⅲ trial[J].J Clin Oncol, 2005 ,23(15):3509-3516.[6]Gurka MK, Collins SP, Slack R, et al.Stereotactic body radiation therapy with concurrent full-dose gemcitabine for locally advanced pancreatic cancer: a pilot trial demonstrating safety[J].Radiat Oncol, 2013,8:44.
[7]Chang JS, Wang ML, Koom WS, et al.High-dose helical tomotherapy with concurrent full-dose chemotherapy for locally advanced pancreatic cancer[J].Int J Radiat Oncol Biol Phys, 2012,83(5):1448-1454.
[8]Gurka MK, Collins SP, Slack R, et al.Stereotactic body radiation therapy with concurrent full-dose gemcitabine for locally advanced pancreatic cancer: a pilot trial demonstrating safety[J].Radiat Oncol, 2013 ,8:44.
[9]Saarto T, Blomqvist C, Rissanen P, et al.Haematological toxicity: a marker of adjuvant chemotherapy efficacy in stage Ⅱ and Ⅲ breast cancer[J].Br J Cancer, 1997,75(2):301-305.
[10]Di Maio M, Gridelli C, Gallo C, et al.Chemotherapy-induced neutropenia and treatment efficacy in advanced non-small-cell lung cancer: a pooled analysis of three randomised trials[J].Lancet Oncol, 2005 ,6(9):669-677.
Comparison of Two Kinds of Comprehensive Treatment in the Locally Advanced Pancreatic Cancer
Li Shimeng
(DepartmentofOncology,theFirstHospitalofSuqian,Suqian223800,China)
[Abstract]ObjectiveTo compare the clinical efficacy and safety of two comprehensive programs in the treatment of locally advanced pancreatic cancer.MethodsThirty-nine patients with locally advanced pancreatic cancer were divided into the two groups.20 (group A) received gemcitabine and S-1 combined with synchronous radiotherapy and chemotherapy, 19 (group B) received gemcitabine and S-1.ResultsThe response rate and disease control rate of the group A were higher than the group B (31.2% vs 26.7%, 81.3% vs 73.3%), which remained statistically significant (P=0.015, 0.047).The clinical benefit response was 80.6% in the group A, and 72.4% in the group B, there was significantly different in the clinical benefit response (P=0.035).The median progression-free survival and the median overall survival of the group A were higher than the group B (5.8 months vs 4.9 months, 16.1 months vs 15.3 months), but there were no significant difference (P=0.423, 0.348).The toxicities in the blood system of the group A were inferior to the group B(P<0.05).The others toxicities between the two groups were not significantly different (P>0.05).ConclusionCompared with gemcitabine and S-1, gemcitabine and S-1 combined with synchronous radiotherapy and chemotherapy has better disease control and pain control for locally advanced pancreatic cancer, but it can’t improve the survival rate.The toxicities in the blood system of the group A were inferior to the group B, but the others toxicities between the two groups were not significantly different.
[Key words]locally advanced pancreatic cancer; gemcitabine; S-1; chemotherapy; radiotherapy
作者簡介:李士猛(1969-),男,副主任醫師,主要從事腫瘤放化療的綜合治療工作。E-mail:932153260@qq.com
DOI:10.3969/j.issn.1673-5412.2016.03.010
[中圖分類號]R735.9
[文獻標識碼]A
[文章編號]1673-5412(2016)03-0216-06
(收稿日期:2015-12-03)

