小分子熱應激蛋白與肉嫩度的關系研究進展
李 鑫,邢 通,徐幸蓮*(南京農業大學 肉品加工與質量控制教育部重點實驗室,江蘇 南京 210095)
?
小分子熱應激蛋白與肉嫩度的關系研究進展
李 鑫,邢 通,徐幸蓮*
(南京農業大學 肉品加工與質量控制教育部重點實驗室,江蘇 南京 210095)
摘 要:肉嫩度的形成與動物宰后肌肉成熟過程中發生的復雜生理生化變化密切相關。動物宰殺放血后,氧氣和營養物質供應終止,細胞凋亡程序啟動,因此,調控該過程的凋亡因子可能最終影響到肌肉品質。小分子熱應激蛋白(small heat shock proteins,sHSPs)作為肌肉嫩度的潛在生物標記,在許多蛋白組學的研究中得到證實。sHSPs由于其抗細胞凋亡和分子伴侶功能特性,在保護肌原纖維蛋白、干擾凋亡通路信號、延緩內源性蛋白酶對其的降解、延長肉的成熟時間等方面起到重要作用,與肉嫩度密切相關。本文綜述了sHSPs作為肌肉向食用肉轉變過程中的分子伴侶和其抗凋亡作用對肉嫩度的影響及其作用機理。
關鍵詞:小分子熱應激蛋白;嫩度;分子伴侶;細胞凋亡
引文格式:
李鑫, 邢通, 徐幸蓮.小分子熱應激蛋白與肉嫩度的關系研究進展[J].食品科學, 2016, 37(13): 232-236.DOI:10.7506/ spkx1002-6630-201613042. http://www.spkx.net.cn
LI Xin, XING Tong, XU Xinglian.Relationship between small heat shock proteins and meat tenderness[J].Food Science,2016, 37(13): 232-236.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613042. http://www.spkx.net.cn
嫩度是肉的主要食用品質之一,也是評價肉質優劣的常用指標。肉嫩度的影響因素多年來一直是國內外肉類科學家研究的一大熱點。影響肉嫩度的因素主要包括宰前因素和宰后因素,宰前因素包括動物品種、年齡、性別、肌肉部位和營養狀況等;宰后因素包括冷卻方式、胴體吊掛方式、成熟過程等。
研究發現,肉嫩度的形成是活體動物肌細胞的生物特性和宰后成熟期間生物化學變化共同作用的結果。近些年,蛋白組學關于肉類的研究表明小分子熱應激蛋白作為生物標記物在預測嫩度、肉色、保水性和風味方面具有一定的潛力。與此同時,研究表明小分子熱應激蛋白(small heat shock proteins,sHSPs)作為分子伴侶與抗凋亡因子在調控宰后肌肉成熟過程所發生的細胞凋亡、蛋白降解等生理生化過程中起到重要作用。本文將對sHSPs的基本結構及功能和其影響肉嫩度的作用機制進行綜述。
1 小分子熱應激蛋白
1.1 sHSPs簡介
生物體在遭受高溫、缺氧缺血、氧化、重金屬鹽等脅迫刺激后,會快速產生具有高度保守性的一類非特異性細胞蛋白,即熱應激蛋白(heat shock proteins,HSPs),同時,在正常環境下,它們中的大部分也能在細胞中表達。HSPs是一類蛋白質分子家族,Snoeckx等[1]根據氨基酸序列的同源性、分子質量和功能的不同,將HSPs分為6 個主要家族,即HSP100家族、HSP90家族、HSP70家族、HSP60家族、HSP40家族和小HSP家族(12~43 kD)。sHSPs是熱應激蛋白家族中的第六類,主要包括HSP20,HSP27和αB-晶狀體蛋白等[2]。
1.2 sHSPs的結構
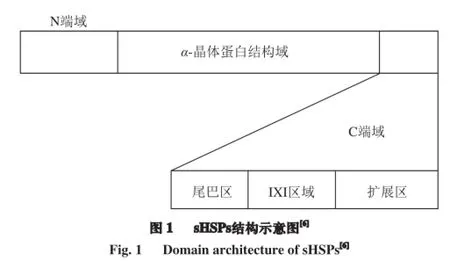
sHSPs的主要結構由N端域、C端域和位于兩者中間的α-晶體蛋白結構域三部分組成(圖1)。α-晶體蛋白結構域是所有sHSPs共有的高度保守的結構域,由約90 個氨基酸特征序列組成,包含9 個β-片層,呈緊密的三明治結構,其上下兩層為分別是由3 條或4 條反平行鏈組成,中間由1 個小的域間環連接[3]。C端域由一個短的可變的氨基酸殘基序列組成,包含一個尾巴區、擴展區和保守的IXI區域,與sHSPs低聚物的疏水區形成有關[4]。N端域的序列和長度都是多變的,能夠調節低聚反應,與低聚體復合物的形成及分子伴侶活性有關[5]。
sHSPs在體內以高度有序的低聚物(200~800 kD)形式存在,sHSPs低聚物可以是由一種或多種sHSPs形成的同源聚物或異源多聚體[7]。sHSPs低聚物的結構、大小是動態變化的,而且2 種低聚物的亞基可以快速交換,不同狀態的低聚體對sHSPs的伴侶功能有重要的影響[8]。如酵母的HSP26在生理溫度下是二十四聚體復合物,在受到熱激后,二十四聚體復合物發生解離,成為具有伴侶活性的二聚體復合物[9]。而小鼠HSP25以二聚體形式存在時沒有伴侶活性,而當聚合成大的低聚體復合物后具有很高的伴侶活性[10]。體內sHSPs低聚物動態解離或聚合能夠暴露其疏水位點,從而與解折疊的蛋白結合為可溶性復合物,實現對蛋白質保護功能[11]。
sHSPs通過磷酸化作用或翻譯后的修飾調節低聚物的狀態,進而調節其生物功能。研究表明,人類HSP27有3 個磷酸化位點Ser15、Ser82和Ser78,通過促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAP)-激酶修飾,可以形成8 種可能的異構體[12]。磷酸化過程通常會導致sHSPs低聚物解聚,形成小的六聚體、四聚體或二聚體[13]。如人類的HSP27在促分裂原活化蛋白活化蛋白激酶2/3(MAPK-activated protein kinase 2/3, MAPKAP-激酶2/3)的作用下形成四聚體,進一步解聚形成二聚體[14]。人體內磷酸化的HSP27通過穩定內皮細胞和(或)平滑肌細胞骨架的肌動球蛋白來防止心血管病,而非磷酸化的HSP27無此功能[15]。
1.3 sHSPs的功能
1.3.1 分子伴侶功能
分子伴侶的定義是結合并穩定蛋白質,有利于蛋白質正確裝配,但最終不參與蛋白質功能結構的組成[6]。當細胞受到應激損傷時,蛋白天然結構被破壞,結構展開,同時sHSPs低聚物發生解離成小復合物,疏水基團暴露,包埋在低聚物內部與底物結合的位點暴露,與變性的蛋白質結合形成穩定、可溶的sHSPs-蛋白質復合物[11]。雖然sHSPs-變性蛋白質復合物是相對穩定的,但sHSPs無法使受損的蛋白質底物復性[16]。HSP60、HSP70具有正確的裝配和重新折疊合成新的蛋白質的作用,它們通過ATP依賴的過程,正確組裝異常折疊和變性蛋白來協助防止蛋白質不可逆聚集,并協助蛋白質轉移到正確的位置。不同于大多數熱激蛋白家族成員,sHSPs功能的實現不依賴于ATP[17]。
1.3.2 調控肌動蛋白聚合
肌動蛋白是肌細胞骨架微絲的重要組成部分,對維持肌肉細胞結構的完整性起到關鍵作用。肌動蛋白聚合時,亞基在微絲正端進行組裝,相反,F-肌動蛋白即解聚變成G-肌動蛋白單位,但延長的速度比負端解聚速率要快10 倍。在穩定條件下,肌動蛋白正端聚合及負末端解聚速率是相當,確保肌動蛋白微絲保持恒定的長度。sHSPs能模仿一種同源肌動蛋白和肌動蛋白-肌動蛋白結合位點相結合,作為一個帽子結構有效地抑制肌動蛋白聚合[18]。
sHSPs非磷酸化單體的存在形式能夠通過調控組織中肌動蛋白聚合,控制微絲動力學,從而調控微絲形成[19]。如小鼠的HSP25和αB-晶體蛋白能夠調控肌動蛋白的組裝[20]。在無脅迫作用的穩態細胞中,sHSPs能夠調節肌動蛋白絲的組裝和維持細胞骨架蛋白結構。
1.3.3 維持骨架蛋白結構,保持細胞完整性
許多研究表明sHSPs在維持細胞骨架結構及完整性、細胞微絲、微管及中間絲過程具有重要作用。大多數磷酸化狀態的HSP27都可以穩定細胞微絲;應激條件下sHSPs與絲蛋白的協同作用可以幫助細胞抵抗熱應激、氧化應激、肌動蛋白反應性藥物等[21-22]。國內學者通過研究大鼠骨骼肌sHSPs在離心運動后的表達變化,發現αB-晶體蛋白(αB-crystallin)增加且移位于Z盤和細胞膜,sHSPs的移位可能有助于限制骨骼肌細胞骨架蛋白崩解,或者幫助修復損傷的結構[23]。
1.3.4 抗細胞凋亡作用
細胞凋亡指為維持內環境穩定,由基因控制的細胞自主的、有序的死亡。細胞凋亡是主動的過程,涉及一系列基因的激活、表達以及調控等,并不是病理條件下損傷的一種現象,而是機體為更好地適應生存環境而主動爭取的一種死亡過程[24]。
介導細胞凋亡過程中的細胞凋亡酶(caspases),是哺乳動物細胞內一組內源性半胱氨酸肽酶。哺乳動物程序性死亡途徑主要是由線粒體介導的內源性凋亡通路。細胞受到脅迫作用時,線粒體膜腫脹、通透性增高、促凋亡蛋白Bax、14-3-3蛋白釋放,因而細胞色素c、凋亡誘導因子(apoptosis inducing factor,AIF)、核酸內切酶(Bcl-2 inhibitor of transcription,Bit1)等釋放到細胞質中,引起的一系列級聯放大反應導致大量細胞基質裂解引起細胞凋亡[25]。
有關sHSPs調控細胞凋亡的理論已有很多報道。Paul等[26]研究表明,小鼠細胞系中HSP27的表達影響線粒體釋放細胞色素c,對定位小鼠細胞內HSP27的表達位置進行定位,結果表明HSP27能干擾線粒體上游的凋亡信號。此外,αB-晶狀體在缺氧和高滲應激的條件下,能夠抑制心肌細胞中Caspase3的活化[27]。而錯譯突變的αB-晶狀體蛋白則失去抗凋亡作用,導致線粒體呈現更大的通透性從而引起大量細胞色素c釋放到細胞質[28]。類似的生物功能在HSP20也得到驗證[29]。
總的來說,sHSPs一方面能夠通過干擾凋亡通路的化學信號,抑制細胞凋亡;另一方面則能通過分子伴侶作用結合損壞或展開的蛋白質,防止細胞內蛋白質不可逆的損傷和蛋白質聚集。
2 sHSPs與肉嫩度的相關研究
預測肉宰后初期食用品質便于肉類工業的生產控制。近些年,蛋白質組學關于肉類的研究表明,sHSPs作為生物標記物在預測肉嫩度、顏色、保水性和風味方面具有一定的潛力[30]。Bernard等[31]發現,牛肉HSP27和αB-晶狀體蛋白濃度與肉的嫩度、多汁性和風味之間成負相關關系。此外,Kim等[32]研究表明牛肉中HSP27的濃度也與其顏色成負相關(L*和a*值)。這些研究結果表明,生物標志物的統計模型可以在宰后早期預測某些肉的品質屬性,但sHSPs參與肉品質的變化機制還有待研究。
sHSPs在調控肉質形成過程中可能發揮的作用最早由Ouali等[33]提出,即sHSPs表達上調,阻止肌細胞凋亡進程,同時作為肌肉蛋白的分子伴侶能維持細胞穩態。因此,本文將從sHSPs延緩肌原纖維蛋白降解和抗細胞凋亡兩方面展開討論。
2.1 分子伴侶功能延緩肌原纖維蛋白的降解
肌肉向食用肉轉化過程中發生的復雜組織結構和生理生化變化是肉嫩化的基礎。目前發現的骨骼肌中可能參與肌肉宰后嫩化的酶類主要包括溶酶體組織蛋白酶類、蛋白酶體、鈣激活酶類和細胞凋亡酶——半胱氨酸蛋白酶家族Caspases[34]。維持肌原纖維完整性的蛋白包括肌間線蛋白(desmin)、肌聯蛋白(titin)、伴肌動蛋白、肌鈣蛋白T(troponin-T)、聯結蛋白(vinculin)等[35]。最終控制嫩化的過程是以上蛋白在該類酶作用下水解,導致細胞結構的完整性喪失發生小片化,從而達到改善肉嫩度的作用。
sHSPs作為分子伴侶保護肌肉結構完整性的一個特征是在肌細胞受到脅迫作用后,從肌漿蛋白轉移到肌原纖維蛋白上。如受到離心應激后,人類肌漿蛋白中HSP27的濃度減少,肌原纖維中HSP27增加[36]。因此,在脅迫條件作用下,sHSPs能夠協助穩定該區域關鍵的、脆弱的蛋白質,延緩肌原纖維降解。
相關研究表明,在肌原纖維蛋白提取物中加入外源性αB-晶狀體蛋白后,肌間線蛋白和肌聯蛋白的降解減少;將純化的αB-晶狀體蛋白和純化的μ-鈣蛋白酶在體外結合,在鈣離子作用下,αB-晶狀體蛋白可以將μ-鈣蛋白酶快速水解,說明αB-晶狀體蛋白可以作為μ-鈣蛋白酶的底物。進一步實驗結果已確認αB-晶狀體蛋白可以競爭性抑制μ-calpain活性[37]。
除此此外,動物宰后極限pH值(ultimate pH,pHu)會影響到肌漿中sHSPs的濃度,從而影響肉嫩度。關于牛背最長肌成熟過程中HSP27、HSP20和αB-晶狀體蛋白的動力學的研究表明,高pHu組肌肉sHSPs的濃度最高,低pHu組濃度最低;且高pHu肉和低pHu肉sHSPs濃度隨時間下降的速率均較中等pHu肉快[38]。這可能與sHSP的等電點有關。還有研究表明,sHSPs的降解與肌原纖維蛋白降解存在顯著相關性。如Lomiwes等[39]研究表明,宰后第1天的牛肉樣本肌間線蛋白與肌鈣蛋白T的降解程度,與HSP20和HSP27降解程度成顯著正相關;Hwang等[40]發現,宰后1~7 d,豬背最長肌的剪切力值與HSP27的濃度成顯著正相關;Morzel等[41]提出,在牛肉嫩化過程中,HSP27與肉的嫩度成正相關。關于sHSP與肉嫩度的關系仍需進一步研究。
總體來說,目前研究表明sHSPs保護肌肉的結構完整性的主要有兩種方式:1)sHSPs與肌原纖維蛋白結合,穩定肌原纖維蛋白,維持肌肉的完整結構,延緩內源性蛋白酶對肌原纖維蛋白的水解;2)與肌原纖維結合的sHSPs成為μ-鈣蛋白酶的底物,減緩肌原纖維蛋白的水解進程。
2.2 抑制宰后動物的細胞凋亡
動物宰后,機體內氧氣和營養供應終止,肌細胞所處的環境逐漸變為無氧狀態,有氧呼吸轉變為糖酵解。乳酸積累,pH值下降,能量水平降低,鈣離子濃度變化,這種有害的生理條件極有可能啟動細胞凋亡程序,引發肌細胞凋亡,導致Caspase系統對細胞骨架結構蛋白的降解,最終作用于肉的嫩度[42]。
研究發現Caspase是內源性蛋白水解酶,主要通過誘導細胞凋亡的作用來影響肉嫩度[43-44]。在研究宰后初期牛背最長肌半胱天冬酶的動力學特點時,Pulford等[45]報道宰后早期的Caspase8和Caspase9活力與pHu沒有顯著差異。但隨著肌肉成熟,中pHu組與低pHu組和高pHu肉相比,Caspase3、Caspase7的活性相對較低。這可能是由于中pHu肉有較高濃度的sHSPs,抑制Caspase3、Caspase7的激活,減緩細胞凋亡過程,導致肉的嫩化延遲。面對細胞凋亡,sHSPs濃度的上調對防止細胞內蛋白質的聚集、變性,維持細胞穩態,阻止不必要的細胞凋亡起到重要作用。
另一方面肌肉pH值動力學特性表明,宰后肉的pH值呈不連續下降趨勢,中間會經歷pH 6.2~6.4的穩定期[46]。細胞凋亡的顯著特點是細胞膜內外磷脂分布的改變,影響肌細胞膜電荷分布,并與pH值下降速率有關[47]。細胞膜磷脂的轉變受抗凋亡蛋白Bcl-2抑制,sHSPs作為抗凋亡蛋白,可能與Bcl-2相結合,抑制pH值下降速率,穩定pH值變化過程,對肉嫩化過程起到重要作用[39]。
3 結 語
綜上所述,小分子熱應激蛋白由于其結構、功能上的特殊性,對肉嫩度的形成具有重要調控作用。但小分子熱應激蛋白對嫩度影響的相關作用機理仍存在一定的爭議。此外,小分子熱應激蛋白在不同宰前因素、動物品種、肌纖維類型等方面對肉嫩度的影響也不盡相同,仍需要進一步研究。
參考文獻:
[1] SNOECKX L H E H, CORNELUSSEN R N, van NIEUWENHOVEN F A, et al.Heat shock proteins and cardiovascular pathophysiology[J].Physiological Reviews, 2001, 81(4): 1461-1497.
[2] BAKTHISARAN R, TANGIRALA R, RAO C M.Small heat shock proteins: role in cellular functions and pathology[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2015, 1854(4): 291-319.DOI:10.1016/j.bbapap.2014.12.019.
[3] SUN Y, MACRAE T H.Small heat shock proteins: molecular structure and chaperone function[J].Cellular and Molecular Life Sciences, 2005, 62(21): 2460-2476.DOI:10.1007/s00018-005-5190-4.
[4] STROMER T, EHRNSPERGER M, GAESTEL M, et al.Analysis of the interaction of small heat shock proteins with unfolding proteins[J].Journal of Biological Chemistry, 2003, 278(20): 18015-18021.DOI:10.1007/s00018-005-5190-4.
[5] KUNDU M, SEN P C, DAS K P.Structure, stability, and chaperone function of αA-crystallin: role of N-terminal region[J].Biopolymers,2007, 86(3): 177-192.DOI:10.1002/bip.20716.
[6] ELLIS R J, van der VIES S M.Molecular chaperones[J].Annual Review of Biochemistry, 1991, 60(1): 321-347.DOI:10.1007/978-94-011-2108-8.
[7] RUEPP A, ROCKEL B, GUTSCHE I, et al.The chaperones of the archaeon Thermoplasma acidophilum[J].Journal of Structural Biology, 2001, 135(2): 126-138.DOI:10.1006/jsbi.2001.4402.
[8] FRIEDRICH K L, GIESE K C, BUAN N R, et al.Interactions between small heat shock protein subunits and substrate in small heat shock protein-substrate complexes[J].Journal of Biological Chemistry, 2004,279(2): 1080-1089.DOI:10.1074/jbc.M311104200.
[9] STROMER T, FISCHER E, RICHTER K, et al.Analysis of the regulation of the molecular chaperone Hsp26 by temperatureinduced dissociation the N-terminal domain is important for oligomer assembly and the binding of unfolding proteins[J].Journal of Biological Chemistry, 2004, 279(12): 11222-11228.DOI:10.1074/jbc.M310149200.
[10] BENNDORF R, HAYESS K, RYAZANTSEV S, et al.Phosphorylation and supramolecular organization of murine small heat shock protein HSP25 abolish its actin polymerization-inhibiting activity[J].Journal of Biological Chemistry, 1994, 269(32): 20780-20784.
[11] HASLBECK M, VIERLING E.A first line of stress defense: small heat shock proteins and their function in protein homeostasis[J].Journal of Molecular Biology, 2015, 427(7): 1537-1548.DOI:10.1016/ j.jmb.2015.02.002.
[12] GAESTEL M.sHsp-phosphorylation: enzymes, signaling pathways and functional implications[M].Berlin: Springer Berlin Heidelberg,2002: 151-169.DOI:10.1007/978-3-642-56348-5_8.
[13] FU Xinmiao, SHI Xiaodong, YAN Linxuan, et al.In vivo substrate diversity and preference of small heat shock protein IbpB as revealed by using a genetically incorporated photo-cross-linker[J].Journal of Biological Chemistry, 2013, 288(44): 31646-31654.DOI:10.1074/jbc.M113.501817.
[14] HAYES D, NAPOLI V, MAZURKIE A, et al.Phosphorylation dependence of hsp27 multimeric size and molecular chaperone function[J].Journal of Biological Chemistry, 2009, 284(28): 18801-18807.DOI:10.1074/jbc.M109.011353.
[15] ROBINSON A A, DUNN M J, MCCORMACK A, et al.Protective effect of phosphorylated Hsp27 in coronary arteries through actin stabilization[J].Journal of Molecular and Cellular Cardiology, 2010,49(3): 370-379.DOI:10.1016/j.yjmcc.2010.06.004.
[16] RAO P V, HORWITZ J, ZIGLER J S.α-Crystallin, a molecular chaperone, forms a stable complex with carbonic anhydrase upon heat denaturation[J].Biochemical and Biophysical Research Communications,1993, 190(3): 786-793.DOI:10.1006/bbrc.1993.1118.
[17] JAKOB U, GAESTEL M, ENGEL K, et al.Small heat shock proteins are molecular chaperones[J].Journal of Biological Chemistry, 1993,268(3): 1517-1520.
[18] MOUNIER N, ARRIGO A P.Actin cytoskeleton and small heat shock proteins: how do they interact?[J].Cell Stress & Chaperones, 2002,7(2): 167-176.
[19] DUBI?SKA-MAGIERA M, JAB?O?SKA J, SACZKO J, et al.Contribution of small heat shock proteins to muscle development and function[J].FEBS Letters, 2014, 588(4): 517-530.DOI:10.1002/1873-3468.12209.
[20] WIESKE M, BENNDORF R, BEHLKE J, et al.Defined sequence segments of the small heat shock proteins HSP25 and αB-crystallin inhibit actin polymerization[J].European Journal of Biochemistry,2001, 268(7): 2083-2090.DOI:10.1046/j.1432-1327.2001.02082.x.
[21] SCH?FER C, CLAPP P, WELSH M J, et al.HSP27 expression regulates CCK-induced changes of the actin cytoskeleton in CHOCCK-A cells[J].American Journal of Physiology, 1999, 277 (6 Pt 1): C1032-C1043.
[22] HUOT J, HOULE F, SPITZ D R, et al.HSP27 phosphorylationmediated resistance against actin fragmentation and cell death induced by oxidative stress[J].Cancer Research, 1996, 56(2): 273-279.
[23] 高前進.骨骼肌小熱休克蛋白在離心運動后的表達[J].中國組織工程研究, 2011, 15(7): 1159-1162.DOI:10.3969/j.issn.1673-8225.2011.07.005.
[24] KROEMER G, DALLAPORTA B, RESCHE-RIGON M.The mitochondrial death/life regulator in apoptosis and necrosis[J].Annual Review of Physiology, 1998, 60(1): 619-642.DOI:10.1146/annurev.physiol.60.1.619.
[25] 趙世飛.肌肉運動與骨骼肌細胞的凋亡[J].中國組織工程研究,2010, 14(11): 2030-2034.DOI:10.3969/j.issn.1673-8225.2010.11.033.
[26] PAUL C, MANERO F, GONIN S, et al.Hsp27 as a negative regulator of cytochrome C release[J].Molecular and Cellular Biology, 2002,22(3): 816-834.DOI:10.1128/MCB.22.3.816-834.2002.
[27] MORRISON L E, HOOVER H E, THUERAUF D J, et al.Mimicking phosphorylation of alphaB-crystallin on serine-59 is necessary and sufficient to provide maximal protection of cardiac myocytes from apoptosis[J].Circulation Research, 2003, 92(2): 203-211.DOI:10.1161/01.RES.0000052989.83995.A5.
[28] MALOYAN A, SANBE A, OSINSKA H, et al.Mitochondrial dysfunction and apoptosis underlie the pathogenic process in α-B-crystallin desmin-related cardiomyopathy[J].Circulation, 2005,112(22): 3451-3461.DOI:10.1161/CIRCULATIONAHA.105.572552.
[29] FAN G C, REN X, QIAN J, et al.Novel cardioprotective role of a small heat-shock protein, hsp20, against ischemia/reperfusion injury[J].Circulation, 2005, 111(14): 1792-1799.DOI:10.1161/01.CIR.0000160851.41872.C6.
[30] LOMIWES D, FAROUK M M, WIKLUND E, et al.Small heat shock proteins and their role in meat tenderness: a review[J].Meat Science,2014, 96(1): 26-40.DOI:10.1016/j.meatsci.2013.06.008.
[31] BERNARD C, CASSAR-MALEK I, le CUNFF M, et al.New indicators of beef sensory quality revealed by expression of specific genes[J].Journal of Agricultural and Food Chemistry, 2007, 55(13): 5229-5237.DOI:10.1021/jf063372l.
[32] KIM N K, CHO S, LEE S H, et al.Proteins in longissimus muscle of Korean native cattle and their relationship to meat quality[J].Meat Science, 2008, 80(4): 1068-1073.DOI:10.1016/j.meatsci.2008.04.027.
[33] OUALI A, HERRERA-MENDEZ C H, COULIS G, et al.Revisiting the conversion of muscle into meat and the underlying mechanisms[J].Meat Science, 2006, 74(1): 44-58.DOI:10.1016/j.meatsci.2006.05.010.
[34] COSTELLI P, REFFO P, PENNA F, et al.Ca2+-dependent proteolysis in muscle wasting[J].The International Journal of Biochemistry & Cell Biology, 2005, 37(10): 2134-2146.DOI:10.1016/j.biocel.2005.03.010.
[35] 劉壽春, 鐘賽意, 葛長榮.肉品嫩化理論及嫩化方法的研究進展[J].肉品衛生, 2005(7): 25-28.DOI:10.3969/j.issn.1008-5467.2005.10.010.
[36] PAULSEN G, VISSING K, KALHOVDE J M, et al.Maximal eccentric exercise induces a rapid accumulation of small heat shock proteins on myofibrils and a delayed HSP70 response in humans[J].American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2007, 293(2): R844-R853.DOI:10.1152/ ajpregu.00677.2006.
[37] LOMIWES D, HURST S M, DOBBIE P, et al.The protection of bovine skeletal myofibrils from proteolytic damage post mortem by small heat shock proteins[J].Meat Science, 2014, 97(4): 548-557.DOI:10.1016/j.meatsci.2014.03.016.
[38] LOMIWES D, FAROUK M M, WU G, et al.The development of meat tenderness is likely to be compartmentalised by ultimate pH[J].Meat Science, 2014, 96(1): 646-651.DOI:10.1016/j.meatsci.2013.08.022.
[39] LOMIWES D, FAROUK M M, FROST D A, et al.Small heat shock proteins and toughness in intermediate pHu beef[J].Meat Science,2013, 95(3): 472-479.DOI:10.1016/j.meatsci.2013.05.022.
[40] HWANG I H, PARK B Y, KIM J H, et al.Assessment of postmortem proteolysis by gel-based proteome analysis and its relationship to meat quality traits in pig longissimus[J].Meat Science, 2005, 69(1): 79-91.DOI:10.1016/j.meatsci.2004.06.019.
[41] MORZEL M, TERLOUW C, CHAMBON C, et al.Muscle proteome and meat eating qualities of longissimus thoracis of “Blonde d'Aquitaine” young bulls: a central role of HSP27 isoforms[J].Meat Science, 2008, 78(3): 297-304.DOI:10.1016/j.meatsci.2007.06.016.
[42] PARSELL D A, LINDQUIST S.The function of heat-shock proteins in stress tolerance: degradation and reactivation of damaged proteins[J].Annual Review of Genetics, 1993, 27(1): 437-496.
[43] HUANG Feng, HUANG Ming, ZHOU Guanghong, et al.In vitro proteolysis of myofibrillar proteins from beef skeletal muscle by caspase-3 and caspase-6[J].Journal of Agricultural and Food Chemistry, 2011, 59(17): 9658-9663.DOI:10.1021/jf202129r.
[44] MOHRHAUSER D A, UNDERWOOD K R, WEAVER A D.In vitro degradation of bovine myofibrils is caused by μ-calpain, not caspase-3[J].Journal of Animal Science, 2011, 89(3): 798-808.DOI:10.2527/ jas.2010-3149.
[45] PULFORD D J, DOBBIE P, VAZQUEZ S F, et al.Variation in bull beef quality due to ultimate muscle pH is correlated to endopeptidase and small heat shock protein levels[J].Meat Science, 2009, 83(1): 1-9.DOI:10.1016/j.meatsci.2008.11.008.
[46] HWANG I H, THOMPSON J M.The interaction between pH and temperature decline early postmortem on the calpain system and objective tenderness in electrically stimulated beef longissimus dorsi muscle[J].Meat Science, 2001, 58(2): 167-174.DOI:10.1016/S0309-1740(00)00147-9.
[47] BECILA S, HERRERA-MENDEZ C H, COULIS G, et al.Postmortem muscle cells die through apoptosis[J].European Food Research and Technology, 2010, 231(3): 485-493.DOI:10.1007/s00217-010-1296-5.
DOI:10.7506/spkx1002-6630-201613042
中圖分類號:TS251.1
文獻標志碼:A
文章編號:1002-6630(2016)13-0232-05
收稿日期:2015-09-24
基金項目:國家現代農業(肉雞)產業技術體系建設專項(CARS-42)
作者簡介:李鑫(1993—),女,碩士研究生,主要從事肉品加工與質量安全控制研究。E-mail:2015108064@njau.edu.cn
*通信作者:徐幸蓮(1962—),女,教授,博士,主要從事肉品加工與質量安全控制研究。E-mail:xlxu@njau.edu.cn
Relationship between Small Heat Shock Proteins and Meat Tenderness
LI Xin, XING Tong, XU Xinglian*
(Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:The development of meat eating quality is closely related to complex biochemical processes during postmortem aging.Oxygen and nutrient withdrawal following exsanguination is known to induce apoptosis, so that muscle cells inevitably engage towards apoptotic cell death.Thus, factors that regulate the process of apoptotic cell death of muscle cells are believed to influence the ultimate meat quality.Small heat shock proteins (sHSPs), as biomarkers for meat quality attributes,have been confirmed by many proteomic studies.Due to the anti-apoptotic and molecular chaperone functions, sHSPs can protect myofibrillar proteins from degradation, interfere with cellular signal transduction pathways, delay myofibrillar protein degradation by endogenous enzymes and extend the process of meat aging.In this review, we discuss the mechanism of their possible chaperone and anti-apoptotic roles involved in meat tenderness during the conversion of muscle to meat.
Key words:small heat shock proteins; tenderness; chaperone; apoptosis

