氣相色譜—質譜法測定動物肝臟中β—受體激動劑殘留
姚德祥+杜作東+黎小鵬
摘要 研究了動物肝臟中3種β-受體激動劑(包括鹽酸克倫特羅、沙丁胺醇、萊克多巴胺)殘留量的氣相色譜-質譜測定方法。樣品經乙酸銨、乙酸乙酯∶異丙醇(6∶4)提取,PCX陽離子交換柱凈化,再經BSTFA衍生,HP-5MS毛細管柱分離,基質匹配內標法定量。結果表明:3種β-受體激動劑在1.0~20.0 μg/L濃度范圍內均有良好的線性關系,相關系數不低于0.998,在17.5 min內獲得良好的分離,3種β-受體激動劑加標回收率為85.4%~106.7%,相對標準偏差在4.9%~10.5%之間(n=6) 。
關鍵詞 氣相色譜-質譜法;動物肝臟;鹽酸克倫特羅;沙丁胺醇;萊克多巴胺
中圖分類號 X839.2;TS207.5 文獻標識碼 A 文章編號 1007-5739(2016)23-0244-02
Abstract A Gas Chromatography-Mass Spectrometry method was developed for rapid determination of 3 β-agonists residue(including clenbuterol,salbutamol,ractopamine) in pig liver.The samples were extracted with ammonium acetate,ethyl acetate∶isopropanol(6∶4) and cleaned up by PXC column.The targer compounds were derivatized with BSTFA and detected by GC-MS.A matrix matched internal standard was used for quantitative analysis.The results showed that three β-agonists well separated within 17.5 min.The calibration curves were in good linearity between the peak area and the concentration of 1.0~20.0 μg/L for 3 β-agonists with correlation coefficients not less than 0.998.The spiked recoveries ranged from 85.4% to 106.7% with RSD′s in the range of 4.9%-10.5% (n=6).
Key words GC-MS;animal liver;clenbuterol;salbutamol;ractopamine
β-受體激動劑又叫瘦肉精,是一類結構功能類似于腎上腺素和去甲腎上腺素的苯乙醇類衍生物[1],是一種擬交感神經作用藥,具有松弛平滑肌、支氣管擴張等作用,常用來治療支氣管哮喘等疾病[2]。其能夠用來改善動物養分的代謝途徑,促進動物肌肉的合成,抑制脂肪合成的積累,即具有營養“再分配效應”[3],被不法商家添加于動物飼料中,用以減少動物脂肪含量,提高畜禽產品瘦肉率。但是食用含有瘦肉精的畜禽會嚴重危害人類健康,我國已經明確將其列入禁用藥品目錄。
目前,有關β-受體激動劑的分析檢測方法有液相色譜[4]、(氣相、液相)色譜-質譜法[5-6]、免疫吸附法[7]等。本文利用固相萃取/氣相色譜-質譜法對動物肝臟中鹽酸克倫特羅、沙丁胺醇、萊克多巴胺3種β-受體激動劑進行測定,該方法前處理簡單,回收率和精密度均較好。
1 材料與方法
1.1 儀器與試劑
IKA T18勻漿機(德國IKA公司),固相萃取裝置,Ohaus先行者百分之一天平(奧豪斯儀器(上海)有限公司),Poxwar漩渦混合器(蘇州珀西瓦爾實驗設備有限公司),海科氮吹儀(青島海科儀器有限公司),固相萃取裝置,Agilent 7890A-5977型氣相色譜質譜聯用儀(美國安捷倫公司)。氯化鈉、分析純異丙醇、乙酸乙酯、高氯酸、氫氧化鈉、氨水、乙酸銨,以上均為分析純,均由廣州化學試劑廠生產;色譜純甲苯由德國Merck公司生產;衍生劑BSTFA由美國Supelco公司生產;60 mg 3 mL PCX固相萃取小柱由美國Waters公司生產。
鹽酸克倫特羅、沙丁胺醇、萊克多巴胺3種β-受體激動劑標準品均購自德國Dr.Ehrenstorfer,用甲醇將其分別配制成1 000 mg/L標準溶液,使用前用甲醇稀釋成所需濃度的混標工作液。
1.2 試驗方法
1.2.1 樣品的提取與凈化。將肝臟(豬肝、牛肝)用絞肉機絞碎后,稱取5.0 g(精確到0.01 g)到50 mL塑料離心管中,加入50 μL內標液,10.0 mL(pH=5.2)的乙酸銨溶液,用高氯酸溶液調節pH值至1.0±0.2,高速渦旋3 min后,離心(8 000 r/min)3 min,收集上清液到50 mL塑料離心管中,往固體沉淀加入5 mL(pH=5.2)的乙酸銨溶液高速渦旋3 min,再次離心,合并2次乙酸銨提取液。用10 mol/L氫氧化鈉調節pH值至10.0±0.2,離心(8 000 r/min)3 min。
將上清液轉移到裝有8 g氯化鈉的100 mL塑料離心管中,加入15 mL乙酸乙酯-異丙醇(6∶4)高速渦旋3 min,離心(8 000 r/min)3 min。提取上層有機層至15 mL玻璃試管中,氮吹。同時再加入10 mL乙酸乙酯-異丙醇(6∶4)進行第2次萃取,離心后合并所有有機提取液,繼續氮吹至近干。加入3 mL(pH=5.2)的乙酸銨溶液,漩渦振蕩后待凈化。
PCX小柱依次用5.0 mL甲醇、2.0 mL水和4.0 mL 30 mmol鹽酸溶液預淋洗活化,然后倒入上述待凈化液,依次用4.0 mL水、4.0 mL甲醇洗脫,吹干柱中殘液,去掉洗脫液,最后加入5.0 mL氨化甲醇洗脫,用10 mL帶旋塞的玻璃試管收集濾出液。將收集濾出液的試管置于氮吹儀,于55 ℃氮吹至全干,不蓋蓋子在80 ℃烘箱中進一步鼓風烘干20 min,待試管恢復至室溫,分別加入100 μL甲苯和100 μL BSTFA蓋上蓋子漩渦混合2 min,于80 ℃烘箱中衍生反應1 h,待試管恢復至室溫,轉移至帶有內插管的進樣瓶中,供氣相色譜-質譜聯用儀測定。
1.2.2 色譜條件。色譜柱:HP-5MS毛細管柱(30.0 m×0.250 mm×0.25 μm);進樣體積:1 μL;進樣方式:不分流進樣;進樣口溫度:220 ℃;載氣及流速:氮氣0.8 mL/min;程序柱溫:70 ℃保持0.6 min,以25 ℃/min升溫至200 ℃,保持4 min,再以15 ℃/min升溫至280 ℃,保持5 min;GC/MS傳輸線溫度:280 ℃。檢測器及溫度:EI離子源220 ℃,四級桿160 ℃;定量方法:內標法。
2 結果與分析
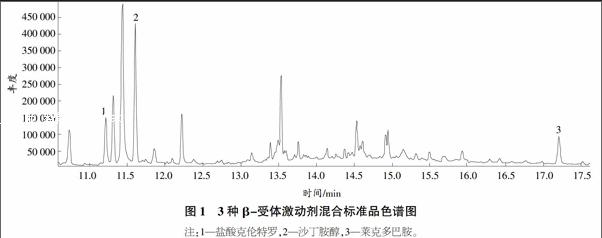
2.1 3種β-受體激動劑的標準色譜圖
試驗選用HP-5MS柱作為分析用色譜柱,通過綜合考慮3種待測β-受體激動劑的理化性質,對氣相色譜-質譜聯用儀的升溫程序進行優化,得到1.2.2中所述色譜條件,用該條件測得3種β-受體激動劑標準色譜圖(圖1),結果表明,3種待測β-受體激動劑在17.5 min內得到良好分離,能滿足動物肝臟中β-受體激動劑殘留分析要求。
2.2 標準曲線、線性范圍及檢出限
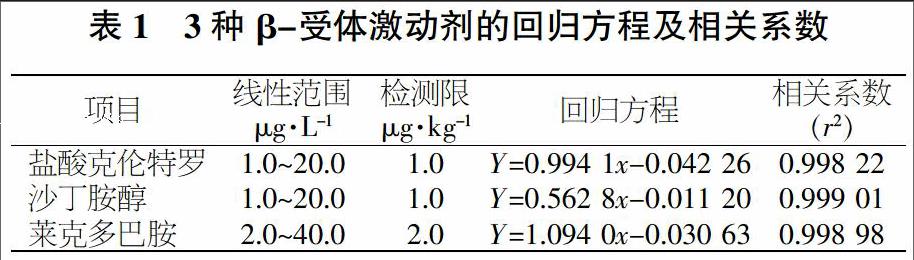
為消除基質效應對測定結果的影響,試驗采用空白樣品添加標準工作液的方法制備標準工作曲線,鹽酸克倫特羅、沙丁胺醇添加濃度分別為1.0、2.0、5.0、10.0、20.0 μg/kg,萊克多巴胺添加濃度分別為2.0、4.0、10.0、20.0、40.0 μg/kg。繪制出標準曲線,回歸方程及相關系數見表1。3種待測β-受體激動劑均呈良好線性關系,r2均大于0.998。
2.3 回收率和精密度
按照1.2的提取凈化方法和色譜條件,采用標準加入法,在空白肝臟(豬肝、牛肝)樣品中添加3.0 μg/kg(萊克多巴胺6.0 μg/kg)和8.0 μg/kg(萊克多巴胺16.0 μg/kg)2種水平的3種β-受體激動劑混合標樣進行加標回收試驗,并進行6個樣品的重復測定,3種β-受體激動劑的平均加標回收率在85.4%~106.7%之間,其相對標準偏差在4.9%~10.5%之間。方法回收率和精密度均能滿足試驗要求。
3 結論與討論
本文建立了氣相色譜-質譜法測定動物肝臟中多種β-受體激動劑殘留量的分析方法。該方法簡單、回收率高,采用PCX小柱可以提高柱層析效率,方法準確度和精密度均能滿足獸藥殘留分析檢測的要求,適合于豬肝、牛肝中多種β-受體激動劑殘留的測定。
4 參考文獻
[1] 梁曉聰,程國霞,朱參勝.GC/MS法同時測定動物組織中4種β-興奮劑殘留量[J].中國衛生檢驗雜志,2008,18(2):199-200.
[2] 聶國榮.β-受體激動劑正副作用及檢測方法[J].中國動物檢疫,2001,18(6):43-44.
[3] 丁煥中,陳杖榴,楊志凌.營養重分配劑萊克多巴胺的藥理作用和應用[J].獸藥與飼料添加劑,2002,7(1):18-20.
[4] 尚紅霞,盧業玉,黃寶華,等.固相萃取-高效液相色譜法同時測定克倫特羅和沙丁胺醇[J].分析科學學報,2003,19(2):145-147.
[5] 孔瑩,邱月明,李鵬,等.固相萃取/氣相色譜-質譜同時測定豬肉中4種β-激動劑類藥物殘留量[J].分析測試學報,2006,25(2):63-66.
[6] 余建新,胡小鐘,余純,等.HPLC/MS測定動物組織及尿樣中的β-興奮劑[J].分析測試技術與儀器,2004,10(4):244-247.
[7] 萬宇平,劉寧,陶光燦,等.組織中β-興奮劑類藥物多殘留酶聯免疫檢測方法的建立[J].河南農業科學,2013,42(2):132-135.

