運動調節骨組織細胞自噬的展望
趙常紅 李世昌 孫朋 陳祥和 徐帥 方幸 季瀏

摘要:自噬是對受損的蛋白質和細胞器的消除主要代謝途徑,是目前公認的一種抗衰老的過程和維持細胞內環境穩定的基礎作用,同時自噬也是適應生物力學刺激的一種響應機制。通過自噬在骨組織細胞和骨代謝疾病中的重要作用,提出運動可調節骨組織細胞的自噬。方法:回顧近年來有關在不同骨細胞類型即成骨細胞、破骨細胞和骨細胞的自噬作用的文獻資料法。結果:通過近年文獻的綜述,發現骨組織細胞自噬與骨代謝、骨相關疾病有著重要的聯系。結論:自噬在骨生理學、骨代謝中存在重要作用,運動作為調節自噬的一種重要方式,可能調節不同骨細胞類型自噬,進而影響骨代謝。
關鍵詞:運動;自噬;骨細胞
中圖分類號:G 804.2 文章編號:1009-783X(2017)02-0171-06 文獻標志碼:A
運動調節骨代謝的作用在國內外已有很多研究,運動對骨代謝的調節是通過多種途徑整合的過程,例如運動調節骨組織細胞信號通路、激素分泌,從而調節骨代謝等。現在發現骨組織細胞自噬作為一種重要的途徑,存在饑餓和應激狀態下,對細胞內組分進行自我消化,獲取養分、維持能量平衡,調節骨代謝。研究發現,骨組織細胞自噬的發生在一定程度上有利于細胞存活。細胞質靶向降解物質包括長壽蛋白,聚集體和受損的細胞器。雙膜囊泡的自噬體與溶酶體融合形成自噬溶酶體后,內容物降解和循環利用。基礎自噬發生在所有細胞中較低的水平,是一種蛋白質和細胞器的質量控制機制,維持正常的細胞內環境的穩定。此外,當遇到各種壓力如饑餓、氧化應激、缺氧或感染時自噬上調,類似一種保護機制。骨是一個復雜的器官,骨的重建貫穿人的一生,有一個嚴密的控制機制,主要由3種細胞類型執行:成骨細胞(Osteoblast,OB)、破骨細胞(Osteoclast,OC)、骨細胞(Osteocyte,OST)。研究發現這3種骨組織細胞均存在自噬,運動作為調節自噬重要的方式是否調控骨細胞自噬進而訶節骨代謝?本文對近年來關于骨組織細胞自噬的文獻進行綜述,旨在為運動調節骨組織細胞自噬進而調節骨代謝進行展望,這將成為運動調節骨代謝的一個新課題。
1.自噬的機制
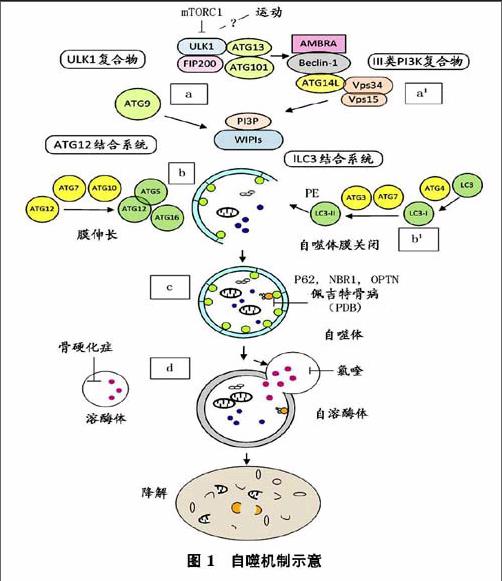
哺乳動物雷帕霉素靶蛋白(mammalian target of rapamytin,roTOR),--fO高度保守的絲氨酸/蘇氨酸激酶,是mTORCl復合物的一部分,包括Raptor和mLST8蛋白,作為營養和能量的傳感器,是調控自噬的主要途徑。
自噬體的形成是一個多步驟的過程(如圖1所示),包括超過15個自噬相關蛋白(ATG)分層招募前自噬體結構(PAS),a在應對不同刺激如mTORCl失活,細胞自噬是通過ULKl復合物和Ⅲ類P13K復合物啟動。由于局部PBP形成,與ATG9提供部分膜相關,形成一個吞噬泡。b該ATGl2共軛體系與LC3的共軛體系一樣,都涉及隔離膜的伸長和關閉。自噬體融合溶酶體形成一個完整自噬溶酶體,通過水解酶降解的內容材料,釋放在細胞質中代謝產物作為能源。a由ULK-1/2,ATG-13,ATG-101和FIP200組成(ULK)復合物介導啟動自噬。在營養充足的條件,mTORCl通過ULK-1/2、ATGl3的磷酸化負向調節ULK復合物。在運動和饑餓刺激下,可能導致mTORCl失活,激活ULK-1,ATGl3和FIP200磷酸化,誘導自噬發生。a'ULKl的磷酸化觸發多蛋白復合物的易位(Ⅲ類P13K復合體I),含Beclin-1(也被稱為ATG6)、AMBRA、ATG14L、Vpsl5和Ⅲ類磷酸激酶(P13K CⅢ,也稱Vps34),從細胞骨架結構到細胞自噬前體到初級自噬體的形成。磷脂酰肌醇-3(P13P),由VPS34活動產生,約束W1PI(WD重復蛋白與磷酸肌醇相互作用)效應器和ATG9一起調節自噬體形成的最初階段,ATG9在不同區域循環,被認為是一個膜延伸脂質載體。
延伸和閉合過程需要2個泛素樣蛋白復合物及相應的共軛機制和幾種SNARE蛋白。b首先包括ATG7和ATGl0酶,來調節泛素樣ATGl2到ATG5的共價結合ATGl2-ATG5。ATGl2-ATG5結合后再結合到ATGl6形成ATGl2-ATGS/ATGl6,是自噬體生物合成必不可少的過程,然后結合到PAS第2類泛素樣系統。bl第2類泛素系統允許磷脂酰乙醇胺(PE)共軛到微管結合的輕鏈3(LC3),與酵母ATG8同源。初期的LC3是ATG4首先產生的,由ATG7活化,轉移到ATG3綴合酶,再結合到PE。LC2-PE(LC3Ⅱ)作為自噬的標記,目前是在自噬體上完整的膜蛋白。
自噬作用一直被認為是一種非選擇性的過程,但幾個選擇性自噬形式已經被確定。自噬受體一般出現一個泛素結合結構域允許破壞性的泛素化結構相互作用,一個特定的氨基酸序列為LC3相互作用區(LIR序)與ATG8蛋白家族成員結合。除了其降解功能,最近在OC觀察到蛋白質分泌自噬,此外,在生物力感應細胞還發現自噬有胞吐作用。
2.骨組織細胞中的自噬調節器
通過對近年來文獻的查閱整理,發現幾個有利于骨骼健康自噬誘導劑,運動可能誘導調節以下誘導劑,調節骨組織細胞的自噬功能從而調節骨代謝,見表1。
3.骨組織細胞自噬
越來越多的文獻表明,骨細胞自噬功能的缺失可能導致骨細胞功能障礙,以下就最近關于間充質干細胞(mesenchyma stem cell,MSCs)、OB、OST和破骨細胞(osteoclast,OC)自噬作用的研究結果進行綜述。
3.1自噬與MSC
MSCs具有干細胞特性,即自我更新和多向分化潛能,使他們能夠分化成多種細胞包括成骨細胞、軟骨細胞和脂肪細胞。Song等表明,自噬誘導MSC氧化應激可導致生存反應。另外,自噬還被證明參與維持間充質干細胞干性。最近,nuschke等觀察到在未分化的間充質干細胞自噬通量停止,產生大量的未降解的自噬小泡積累,在向OB分化早期,這些自噬小體快速產生能源物質供MSX消耗。而研究推斷,運動可能通過AMPK先抑制mTOR調節的自噬和后激活Akt/mTOR信號軸,調控人骨髓問充質干細胞向成骨細胞分化。
3.2自噬與UB和UST
OB來源于間充質細胞,參與骨的形成和礦化。成骨細胞在骨形成過程中,一些成骨細胞被包埋在自己的基質,分化成“骨細胞”,但大多數最終凋亡。采用成骨細胞系、顱骨或BMSC得到的OB表明,OB分化和礦化過程中自噬功能增加,而運動促進OB分化可能與運動過程中自噬功能增加有關。使用透射電子顯微鏡分析小鼠OB,觀察雙層膜自噬囊泡的存在,表明細胞內礦化機制受自噬調節。通過自噬抑制OB分化和礦化,自噬作用在OB進一步證實。對骨髓基質干細胞用3-1VIA和氯喹晚期治療(在分化10 d)會引起堿性磷酸酶陽性細胞數量和大小減少,導致在21 d礦化比對照培養組顯著減少…。這些治療對早期的OB分化無明顯影響,表明OB終末分化需要自噬,而運動可能增加終末端的自噬功能從而促進OB終末端分化與礦化。d同樣,巴弗洛霉素,氯奎因和氯化銨,以及shRNA介導降低自噬必需基因LC3,阻斷人牙髓間充質干細胞,成骨分化hDP-MSC。最后,siATG7和siBECNl都大幅降低了大鼠成骨細胞系的礦化效率,因此,除了間接作用于OB分化,自噬似乎通過細胞外的分泌直接參與礦化過程。骨細胞代表成骨細胞系的終末分化階段,被嵌入在礦化骨基質,因為它們的壽命長,位置固定,這些細胞在適應緊張的環境時,為存活將高度依賴自噬。研究發現,在小鼠和人的皮質骨骨細胞間斷分布的LC3,引起高水平的基底細胞自噬。此外,OST在饑餓和缺氧條件下誘導自噬,糖皮質激素也誘導自噬,從而保持OST活力。OB和OST是敏感細胞,調節應力加載后骨適應性反應,運動力刺激可能翻譯成結構級聯性生化變化,有效刺激骨細胞自噬,從而提高骨強度,抑制隨著年齡增長的骨損失。在體內遇到機械壓力(0.2 kPa)時,強烈誘導OB自噬,且短暫和不依賴mTOR的。自噬在控制骨骼平衡的OB和OST功能上發揮著核心作用,這可能為運動調控骨代謝研究提供了新的方向。
對體內構建成骨細胞自噬缺乏的小鼠模型如下;首先,OSX-Cre小鼠骨髓基質細胞表達Cre重組酶成骨細胞向的骨原細胞與FIP200floxed小鼠雜交發現,突變的小鼠表現出骨小梁體積減少的骨質疏松表型(BV/TV)和顯著的骨皮質厚度減少。組織形態學分析表明突變的動物OB數量和表面積與對照組相比減少,骨形成減少,OC數量和表面不變。Liu等使用骨髓基質細胞研究還發現,這些突變小鼠OB標記物的表達和礦化減少。總之,這些結果表明自噬在OB增殖具有重要作用。
其次,使用COLlA Cre小鼠在OB表達Cre重組酶,和ATG5 floxed小鼠雜交,得到OB特定自噬缺陷小鼠,然后對九月齡雌性和雄性小鼠股骨組織形態學和mlcroCT分析顯示,突變小鼠的骨小梁體積減少,伴隨著骨小梁寬度和數量降低。這種影響在雌性小鼠比雄性更明顯。在兩性的突變小鼠OB著減少,0{3周長增加,雌、雄突變小鼠OB/OC與對照組相比顯著減少。此外,9個月大突變小鼠與對照組相比礦物沉積率下降50%。采用體外分析發現自噬缺陷OB呈現氧化應激增加和NF-vJ3受體活化因子(receptor activator of nuclear factor Bligand,RANKL)的分泌,有利于OC生成。研究得出,運動缺乏可能降低自噬使其礦化能力降低,引發OB和012之間的不平衡導致低骨量表型。
同樣,利用COLlA-Cre小鼠在OB表達Cre重組酶與P62 floxed小鼠雜交生成的OB特殊P62缺陷小鼠表現出OB分化減少和骨量降低,在這些突變小鼠中觀察發現骨小梁數量及骨細胞數顯著減少。此外,OB缺乏P62導致骨髓內環境損失。自噬在0ST作用是使用Dmpl-Cre在OST表達ere和一些成熟的OB ATG7iloxed小鼠雜交,在小鼠6周測量BMD顯示出雄性條件敲除小鼠股骨的骨密度略有下降,但沒有改變脊柱和全身骨密度。檢測到的雌性小鼠在這個年齡在任何位置BIvlD均沒有變化。相比之下,在6個月的年齡條件基因敲除雄性和雌性小鼠在所有骨骼部位骨量與對照組相比下降。在骨形態計量學被證實OB和OC數目和面積減少以及脊柱骨形成率(BFR)降低,礦化沉積率(MAR)沒有變化、股骨骨小梁體積減少,股骨皮質厚度減少。總之,這些數據表明,OST自噬功能障礙,類似骨骼老化骨重建率降低,運動對OST自噬的調節有待進一步驗證。
3.3自噬與OC
OC通過OB產生M-CSF和RANKL觸發融合成巨大、多核細胞,這些細胞負責骨吸收。最近發現自噬參與上調Beclin-1、MCP-1(單核細胞趨化蛋白1)和RANKL的表達促進OC分化。TRAF3是通過自噬降解負調控RANKL誘導OC形成的調控因子。MCP-1是一個CC趨化因子,誘導單核細胞分化成TRAP和CTSK陽性的OC前體細胞。這種效應被證明是在人外周血單核細胞通過鋅指蛋白誘導的,稱為MCPIP。wang等的研究表明通過MCPIP誘導的氧化應激,Beclin-1表達上調和自噬調節MCP-1誘導OC前體細胞分化。這個過程中ATG7下降抑制(X3標記TRAP、組織蛋白酶K(CathepslnK,CTSK)的表達,表明自噬參與OC前體細胞的分化。也有學者用骨髓巨噬細胞(BMM)在RANKL誘導破骨細胞產生過程中發現,Beclin-1不依賴自噬作用,而是通過誘導活性氧及主要基因NFATcl的表達。此外,如缺氧或微重力的誘導下,破骨細胞受自噬調節而增加,例如耐力運動缺氧或失重狀態下可能通過自噬而調節破骨細胞增加,從而導致骨量丟失的。此外,TRAF3抑制RANKL,降低了RANKL對骨髓來源的破骨細胞前體的形成,這可能是運動過度或骨廢用狀態下骨量下降的又一重要原因。
這些數據表明,自噬參與OC的分化。OC的分化,OC皺褶緣生成和骨吸收需要ATG5,ATG7,ATG4B和LC3相關蛋白。ATG5與LC3-Ⅱ靶向皺褶緣,LC3-Ⅱ這個膜蛋白能促進分泌骨吸收需要的溶酶體。另外,小鼠OC里ATG5特異性敲除導致卵巢切除小鼠骨量增加,骨丟失減少,發現運動可能是抑制OC自噬從而抵抗骨質疏松癥。下面列舉骨組織細胞自噬與骨代謝疾病。
4.自噬與骨疾病
4.1佩吉特骨病
佩吉特骨病(PDB)是骨吸收增加和骨形成紊亂的非連續性病變。在細胞水平,PDB是破骨細胞過度活躍表現,例如體積、核數的增加。在SQSTMl/P62基因的泛素相關結構域突變已被證明參與了大部分的PDB,此外,它作為自噬受體的作用,P62參與NF-rB信號通路,調控OC的形成和凋亡。雖然感染等其他環境因素也被認為是這個病理輔因子,但Daroszewska等研究證明,P62UBA域點突變足以引起小鼠poget's病。在這個模型中,與OC對照組相比,在巴弗洛霉素A1突變時LC3-Ⅱ上升,表明自噬體形成增加。最近,全基因組關聯方法確定cOPTN基因變異是PDB的危險遺傳因素。OPTN在各種生理過程包括NF-gB調控中是重要的一員,此外,P62、OPTN作為自噬受體參與蛋白質聚集體的清除;因此,除了在骨生物學的作用,這2個蛋白也是參與細胞自噬的2個關鍵因素。在PDB中清除聚合物缺陷和改變自噬的作用還在進一步研究中。
4.2石骨癥
常染色體隱性遺傳的石骨癥(ARO),也被稱為惡性嬰兒骨硬化病,是一種遺傳和表型異質性OC功能障礙為gc-K的疾病。ARO患者表現出骨量增加,形態正常OC由于皺褶緣形成的缺陷無法再進行骨吸收。觀察出生后不久,如果對這種病不進行治療通常會致命。一個具有純合突變ARO小鼠模型TCIRGl基因小鼠編碼V-ATPase下游的a3亞基被最近證明早期自噬缺陷,在突變0C,LC3Ⅱ表達減少P62表達增加。有趣的是,在ARO兩突變基因,CLC7和OSTMl與神經退行性疾病和LC3一Ⅱ的表達增加相關,可能是由于通量擾動原因所致。
4.3骨質疏松
與年齡相關骨丟失的骨質疏松癥,主要是影響年齡超過50歲以上的人的骨脆性綜合癥。骨衰老潛在的分子機制仍在繼續研究,除了性激素的損失,氧化應激增加被認為是這個過程的一個關鍵因素。自噬被報道發生在一些與年齡相關器官如肝、骨骼肌、腎與胰島細胞,現在還發現自噬也可能是與年齡相關的骨丟失的一個重要因素,隨著年齡的增加骨細胞P62的表達和細胞凋亡也出現上升趨勢,LC3-Ⅱ、BECNl、ULK-1表達下降;因此,氧化應激所致細胞自噬的下降,可能是參與年齡相關骨丟失因素之一,而運動參與自噬調控進而阻止衰老引起的骨量丟失。研究發現細胞自噬功能的下降是加重雌激素缺乏導致骨質流失的一個重要因素。最后還發現,通過對人類全基因組關聯數據挖掘研究發現,自噬基因與人類高度和骨質疏松癥是高度關聯,運動尤其是不同的運動方式如何調節骨細胞自噬基因從而防治骨質疏松,有待我們進一步求證。
5.運動調控骨細胞自噬的研究展望
骨組織細胞自噬對骨骼健康至關重要,而運動與自噬又有著千絲萬縷的聯系。自噬出現在OB和OC分化,OB、OC是參與骨構建與重塑的重要的骨組織細胞,且OB的存活和功能需要自噬過程,如骨基質的礦化,同樣幾個自噬蛋白參與OC的骨吸收,而骨重建的長壽關鍵調節器OST,也高度依賴自噬生存。一些骨疾病,如骨質疏松癥與自噬缺陷息息相關,而科學的運動可以提高骨量,有效預防骨質疏松,自噬作為調控骨組織細胞代謝重要的方式,可能與科學的運動方式存在一定內在聯系。隨著生物醫學和運動科學領域認識的不斷深入,將進一步揭示運動如何調控骨組織細胞自噬從而調節骨代謝a,成為運動科學領域研究運動對骨代謝生物學機制的新方向,希望為運動健骨在運動科學領域找到更多科學的理論解釋。

