“銀樹鍍銅”微科技項(xiàng)目的設(shè)計(jì)與教學(xué)
凌一洲 陳靜 陳鵬文 程鵬

摘要: 江蘇省微科技課程基地開展的創(chuàng)新實(shí)踐項(xiàng)目,具有小切口、低成本、易開發(fā)、有價(jià)值的特點(diǎn),指向化學(xué)核心素養(yǎng)的培育,適合更普遍的中學(xué)生。在“銀樹鍍銅”項(xiàng)目探究中,以“銀樹鍍銅”現(xiàn)象為選題,多次提出假設(shè)并設(shè)計(jì)實(shí)驗(yàn)驗(yàn)證,確定了生成物的成分,解釋了異常現(xiàn)象產(chǎn)生的原因,構(gòu)建了反應(yīng)的原電池模型,化解了認(rèn)知沖突。
關(guān)鍵詞: 核心素養(yǎng); 微科技項(xiàng)目; 原電池; 銀樹鍍銅; 實(shí)驗(yàn)探究
文章編號(hào): 1005-6629(2018)11-0070-03中圖分類號(hào): G633.8文獻(xiàn)標(biāo)識(shí)碼: B
2013年,江蘇省南菁高級(jí)中學(xué)開始微科技課程的探索實(shí)踐;2017年,學(xué)校被省教育廳命名為江蘇省微科技課程基地。依托基地開展的微科技項(xiàng)目,是指在教師指導(dǎo)下,由學(xué)生完成的小切口、低成本、易開發(fā)、有價(jià)值的創(chuàng)新實(shí)踐項(xiàng)目。
化學(xué)微科技項(xiàng)目主要以實(shí)驗(yàn)為選題,指向化學(xué)學(xué)科核心素養(yǎng)的培育。項(xiàng)目不照搬陳舊的選題,而是從現(xiàn)實(shí)中直接發(fā)現(xiàn)和提出;沒(méi)有現(xiàn)成的實(shí)驗(yàn)方案,要根據(jù)探究目的自行設(shè)計(jì)并優(yōu)化;無(wú)法提前預(yù)知結(jié)論,要學(xué)生提出可能的假設(shè),在實(shí)驗(yàn)中收集證據(jù)、解釋證據(jù)。筆者以“銀樹鍍銅”實(shí)驗(yàn)項(xiàng)目為例,原汁原味地展示微科技項(xiàng)目層層深入的探究過(guò)程。
1 項(xiàng)目選題
以下是一個(gè)趣味實(shí)驗(yàn): 在浸有硫酸銅溶液的濾紙上放一片鋅片,可發(fā)生置換反應(yīng),生成向四周擴(kuò)散的樹枝狀的銅單質(zhì)(銅樹)[1]。
筆者用類似的方法制作銀樹: 在浸有0.5mol/L硝酸銀溶液的濾紙上放一片銅片,再在濾紙表面覆蓋一層塑料膜(防止溶液蒸發(fā))并避光保存。反應(yīng)幾分鐘后,濾紙上生成銀白色樹枝狀物質(zhì)(銀樹),且銀樹周圍溶液變藍(lán)。
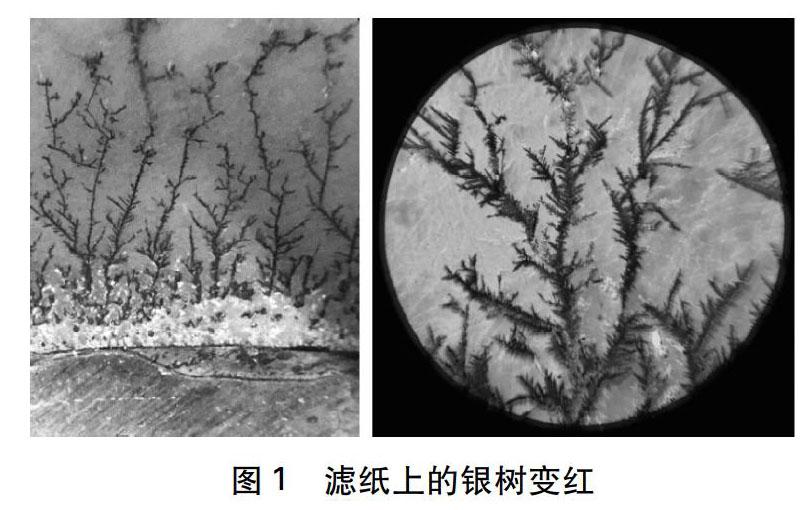
實(shí)驗(yàn)結(jié)束后,筆者將反應(yīng)裝置留下,過(guò)了兩三天再來(lái)處理,卻有了意外發(fā)現(xiàn): 見(jiàn)圖1,銅片上生長(zhǎng)出的銀樹從銀白色變成了紅色(圖1左圖),在顯微鏡放大下更為明顯(圖1右圖)。
這與筆者的預(yù)期不符,是個(gè)異常現(xiàn)象。筆者重做了實(shí)驗(yàn),發(fā)現(xiàn)現(xiàn)象可以重復(fù),而非偶然。雖然檢索了文獻(xiàn),但未發(fā)現(xiàn)相關(guān)報(bào)道。出于好奇,筆者將其作為微科技項(xiàng)目的選題,做了如下探究。
2 項(xiàng)目探究一
2.1 探究目的
探究濾紙上生成的紅色樹枝狀物質(zhì)的成分。
2.2 探究過(guò)程
分析: 由顏色判斷,樹枝狀物質(zhì)表面是銅,但內(nèi)部物質(zhì)無(wú)法確定。
猜測(cè): (1)樹枝狀物質(zhì)可能是實(shí)心銅樹;(2)樹枝狀物質(zhì)可能是銀樹鍍銅。
驗(yàn)證: 樹枝狀物質(zhì)內(nèi)部成分決定了整體形狀,因此筆者分別在濾紙上制作了銅樹和銀樹,然后在顯微鏡下觀察形狀,并與未知樹枝狀物質(zhì)對(duì)比。
結(jié)果: 未知樹枝狀物質(zhì)的形狀與銀樹一致。
2.3 探究結(jié)論
濾紙上生成的紅色樹枝狀物質(zhì)的成分是銀樹鍍銅。
3 項(xiàng)目探究二
3.1 探究目的
探究銀樹上生成銅鍍層的原因。
3.2 探究過(guò)程
分析: 按照常規(guī)的理解,銅與硝酸銀反應(yīng)只生成銀和硝酸銅,生成的銀單質(zhì)表面不會(huì)再生成銅。這個(gè)異常現(xiàn)象可能是受雜質(zhì)干擾造成的。
猜測(cè): 銅片含有鐵等(更活潑的金屬)雜質(zhì),與硝酸銅反應(yīng)生成銅單質(zhì)。
驗(yàn)證: 剪下一小塊銅片和鐵片,用膠帶粘連,放入硝酸銀溶液中,觀察現(xiàn)象。
結(jié)果: 銅片和鐵片上同時(shí)生成銀單質(zhì),且鐵片上生成銀單質(zhì)的速率快。
3.3 探究結(jié)論
即使銅片含有鐵等雜質(zhì),也應(yīng)該是雜質(zhì)先與硝酸銀反應(yīng),不會(huì)形成銀樹鍍銅的現(xiàn)象,故猜測(cè)不成立。探究目的沒(méi)有達(dá)到。
4 項(xiàng)目探究三
4.1 探究目的
改變猜想,重新驗(yàn)證,繼續(xù)探究銀樹上生成銅鍍層的原因。
4.2 探究過(guò)程
分析: 原反應(yīng)體系中存在銅、銀、硝酸銅、硝酸銀等物質(zhì),但不一定都參與了鍍銅的反應(yīng)。如果能排除多余條件的干擾,就更容易探究反應(yīng)的本質(zhì)。
猜測(cè): 只有銅、銀、硝酸銅(銅離子)才與鍍銅反應(yīng)有關(guān)。
驗(yàn)證: 剪下長(zhǎng)條狀的銅片,將其一半浸入硝酸銀溶液中約5分鐘,使銅片一半鍍銀。取出銅片后,先在蒸餾水中洗去硝酸銀殘留,再放入0.5mol/L硝酸銅溶液中,觀察銀鍍層表面現(xiàn)象。
結(jié)果: 銅片鍍銀時(shí),銀鍍層呈灰黑色。浸入硝酸銅(或硫酸銅)溶液后,銀鍍層表面沒(méi)有紅色物質(zhì)生成。
4.3 探究結(jié)論
銀鍍層顏色發(fā)黑說(shuō)明本身就比較粗糙,所以即使生成了銅鍍層,其顏色也可能是黑色的。本次實(shí)驗(yàn)既無(wú)法驗(yàn)證猜測(cè),也無(wú)法推翻猜測(cè),探究的目的沒(méi)有達(dá)到。
5 項(xiàng)目探究四
5.1 探究目的
重新設(shè)計(jì)方案,再次驗(yàn)證“項(xiàng)目探究三”中的猜想,繼續(xù)探究銀樹上生成銅鍍層的原因。
5.2 探究過(guò)程
分析: 將反應(yīng)過(guò)程繼續(xù)抽象,可以把銀鍍層直接換成表面光滑平整的銀片。
驗(yàn)證: 剪下一小塊銅片和銀片,用膠帶粘連,完全浸沒(méi)在0.5mol/L硝酸銅溶液中,觀察現(xiàn)象(由于常溫下反應(yīng)較慢,可以用電磁爐加熱至約80℃)。
結(jié)果: 如果不加熱,1小時(shí)后銀片邊緣會(huì)微微泛紅,銅片表面失去光澤。如果加熱,15min后銀片表面就會(huì)變紅。
5.3 探究結(jié)論
由于銅片、銀片、硝酸銅(銅離子)兩兩之間都無(wú)法反應(yīng),所以鍍銅的反應(yīng)是三者共同作用的結(jié)果。銅片與銀片相互接觸時(shí),可以與硝酸銅溶液反應(yīng),在銀片上生成銅鍍層(與原本的異常現(xiàn)象吻合)。
6 項(xiàng)目探究五
6.1 探究目的
構(gòu)建銅片、銀片、硝酸銅(銅離子)三者共同存在時(shí)發(fā)生反應(yīng)的模型。
6.2 探究過(guò)程
分析: 反應(yīng)經(jīng)過(guò)“項(xiàng)目探究五”的簡(jiǎn)化,已經(jīng)排除了其他多余條件。剩下的反應(yīng)在形式上符合原電池的特征。
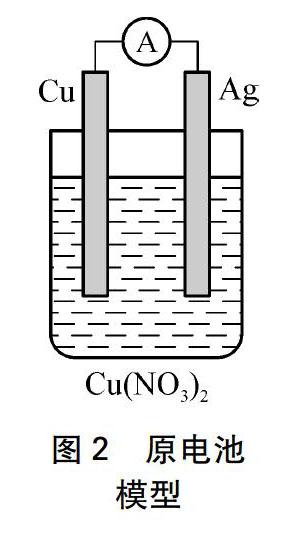
建模: 銀樹與銅片在硝酸銅環(huán)境中構(gòu)成了如圖2所示的原電池(-)Cu(s)|Cu(NO3)2(aq)|Ag(s)(+),銅片相當(dāng)于負(fù)極,銀樹相當(dāng)于正極,硝酸銅溶液相當(dāng)于電解質(zhì)。反應(yīng)時(shí),銅電極上的銅原子變?yōu)殂~離子進(jìn)入溶液,溶液中的銅離子再變?yōu)殂~原子沉積在銀電極表面。
解釋: 負(fù)極上,銅單質(zhì)表面的銅原子失去電子,變成銅離子進(jìn)入溶液,發(fā)生電極反應(yīng):
正極上,溶液中的銅離子得到電子,變成銅原子附著在銀片上,發(fā)生電極反應(yīng):
總反應(yīng)是:
負(fù)極上,銅原子從銅片表面脫離時(shí),發(fā)生了金屬鍵的斷裂;正極上,銅原子附著在銀片表面時(shí),銅原子插入金屬銀的晶格,形成新的金屬鍵。由于舊的金屬鍵鍵能小,新的金屬鍵鍵能大,所以造成了2個(gè)電極的電勢(shì)差,在熱力學(xué)上表現(xiàn)為自發(fā)反應(yīng)。當(dāng)銀片表面鍍了一層銅后,反應(yīng)即停止。
7 認(rèn)知沖突的化解
7.1 化解與常規(guī)習(xí)題的沖突
絕大多數(shù)中學(xué)生一開始都認(rèn)為這個(gè)反應(yīng)不可能發(fā)生,甚至一些習(xí)題也認(rèn)為同類反應(yīng)(例如以銅片、鋅片為電極,硫酸鋅為電解質(zhì))不能構(gòu)成原電池,理由是: 不能發(fā)生氧化還原反應(yīng),沒(méi)有化學(xué)能轉(zhuǎn)化為電能。
但實(shí)際上,這個(gè)實(shí)驗(yàn)發(fā)生了氧化還原反應(yīng),而且反應(yīng)前后有化學(xué)鍵(金屬鍵)能量的差異。造成認(rèn)知沖突的關(guān)鍵在于,中學(xué)生通常把合金看作混合物,把銅原子從銅片轉(zhuǎn)移到銀片表面視為物理變化,沒(méi)有考慮金屬鍵的斷裂與生成[2]。
7.2 化解與傳統(tǒng)實(shí)驗(yàn)的沖突
傳統(tǒng)的銅絲與硝酸銀反應(yīng)的實(shí)驗(yàn)現(xiàn)象只是銅絲表面變白,不會(huì)有銀樹鍍銅的現(xiàn)象,與本實(shí)驗(yàn)的異常現(xiàn)象不符。推測(cè)可能有以下原因: 一是試管中的硝酸銀通常來(lái)不及被反應(yīng)完,而且生成的銀樹容易受到重力和人為擾動(dòng)而被破壞,總之來(lái)不及等到銅鍍層生成。二是因?yàn)樵嚬苤猩傻你y樹表面相對(duì)粗糙,即使生成銅,也可能呈黑色,不便于觀察。
8 結(jié)束語(yǔ)
通過(guò)對(duì)異常現(xiàn)象的不斷探究,筆者最終解釋了該現(xiàn)象。在此過(guò)程中,實(shí)驗(yàn)者加深了對(duì)電勢(shì)差的理解: 產(chǎn)生電勢(shì)差的原因是多樣的,除了常規(guī)化學(xué)反應(yīng)前后的能量差和溫度差、濃度差,甚至銅原子存在于2片電極上的金屬鍵鍵能差也能造成電勢(shì)差。
化學(xué)微科技項(xiàng)目在目標(biāo)定位上注重化學(xué)核心
素養(yǎng)的培育。如表1所示,在完成項(xiàng)目的過(guò)程中,多種核心素養(yǎng)得到了體現(xiàn)。
如今,許多中學(xué)生都參與了課外科研項(xiàng)目,各種高精尖(高級(jí)、精密、尖端)的化學(xué)項(xiàng)目在科技競(jìng)賽上屢見(jiàn)不鮮[4]。但筆者認(rèn)為,高精尖項(xiàng)目只適合極少數(shù)的拔尖人才,各中學(xué)不應(yīng)該盲目追求。對(duì)廣大的中學(xué)生來(lái)說(shuō),小低易(小切口、低成本、易開發(fā))的微科技項(xiàng)目同樣具有研究?jī)r(jià)值和育人價(jià)值,值得推廣應(yīng)用。
參考文獻(xiàn):
[1]許燕紅,楊吉祥,姚茜蕓等.影響銅樹生長(zhǎng)因素的探究[J].化學(xué)教育, 2015, 36(23): 64~67.
[2]Bieron J.F. The “Golden Penny” Demonstration: An Explanation of the Old Experiment and the Rational Design of the New and Simpler Demonstration [J]. Journal of Chemical Education, 1995,72(5): 386~388.
[3]凌一洲,程鵬.有價(jià)值的異常現(xiàn)象“微科技”課題的教學(xué)實(shí)施[J].化學(xué)教學(xué), 2018,(3): 34~37.
[4]中國(guó)科協(xié)青少年科技中心.第三十一屆全國(guó)青少年科技創(chuàng)新大賽獲獎(jiǎng)作品集[M].北京: 科學(xué)普及出版社, 2016.

