雙液原電池在實驗探究中的應用
張青楊 胡曉紅
摘要:使用雙液原電池裝置將氧化反應和還原反應區域分開,可以排除外在因素或體系中的其它微粒給氧化還原反應實驗探究造成干擾的問題,有效發展學生“證據推理”的核心素養。
關鍵詞:雙液原電池;實驗探究;證據推理;核心素養
文章編號:1008-0546(2019)02-0088-02 中圖分類號:G633.8 文獻標識碼:B
《普通高中化學課程標準(2017版)》凝練了“化學學科核心素養”,提出了學業質量要求,引導中學課堂教學從“知識教學”到“能力教學”再到“素養教學”的轉變。近年高考的化學實驗正在由“教材實驗的復現與改進”轉向對“化學原理的探究與創新”的考查,旨在通過實驗探究論證的過程培養學生邏輯思維、批判思維和創新思維。
電化學是重要的化學基礎知識和科學研究的常用手段,在原電池、電解池裝置中連接電流計或電壓表能夠把氧化還原反應的電子轉移可視化、定量化,使得我們能夠將宏觀的實驗現象和微觀的反應歷程進行關聯,從而為化學原理證實和證偽提供證據支持。而雙液原電池是高中化學《選修4》教材中出現的一種研究氧化還原反應原理及能量變化的實驗裝置,該裝置的優點在于將氧化反應和還原反應分開進行,能夠幫助我們更加細致地研究氧化還原反應及其影響機理。
一、探究外界條件對物質氧化性或還原性的影響
物質的氧化性、還原性的強弱會受濃度、溫度、酸堿性等外界因素的影響,但不同條件的改變對氧化性、還原性都產生影響還是只對其中一項產生影響?是對氧化性影響大還是對還原性影響大?為完成這些化學規律、原理的探究,我們可以借助雙液原電池裝置,通過改變所加物質的聚集狀態(固體形狀及顆粒大小)、溫度、濃度、pH等條件之中的單個條件,通過電表示數的變化即可驗證氧化還原反應中具體條件對物質氧化性(或還原性)的影響情況。
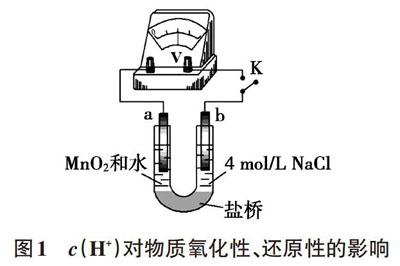
例如,為研究c(H+)對Cl-的還原性、MnO2的氧化性哪個影響程度更大,我們可以組裝雙液原電池裝置(如圖1),待電壓表指針穩定后分別向左側和右側滴加幾滴硫酸,從電壓表示數變化的大小可以證明c(H+)對MnO2的氧化性影響更為顯著。
二、排除氧化劑與氧化產物(或還原劑與還原產物)的相互干擾
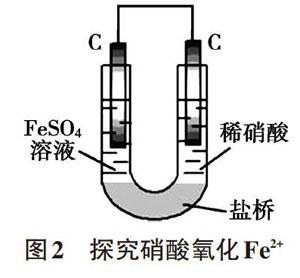
在水溶液中,由于水解、電離及反應過程中的產物等原因造成微粒種類較多,微粒相互間的反應可能比較復雜,常常出現異常現象,對反應原理的研究造成干擾。雙液原電池裝置可以將氧化劑、還原劑及其相關產物隔離開來,是排除干擾因素很好的方法。例如,研究0.1mol/L FeSO4溶液與8mol/L稀硝酸的反應時會觀察到溶液變為棕色,原因是Fe2+與還原產物NO發生反應Fe2++NOFe(NO)2+(棕色),放置一段時間后,待NO逸出后溶液才變為黃色。如果利用雙液原電池(如圖2),可以將還原劑(Fe2+)與還原產物(NO)隔離開來,生成的NO與Fe2+不能接觸,溶液就不會出現棕色,可以直接觀察到U型管左側溶液變黃的理想現象。
三、解決溶液中多種反應競爭問題
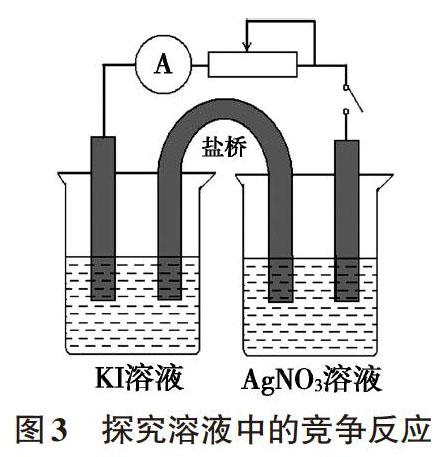
在水溶液中,離子之間可能存在復分解反應、氧化還原反應、絡合反應等多種可能性,實際反應以哪種方式進行與離子濃度、氧化還原性強弱、配位的難易程度等多種因素有關。比如查閱標準電極電勢可知φ(Ag+/Ag)=+0.7996V、φ(I2/I-)=+0.5350V,理論上溶液中濃度為1.0mol/L的Ag+能夠將1.0mol/L的I-氧化。但若將1.0mol/L的AgNO3和KI兩溶液混合,實際上Ag+與I-會發生復分解反應生成AgI沉淀,即使使用淀粉指示劑也難以檢出I2生成。欲驗證Ag+與I-能否發生氧化還原反應,我們可以使用雙液原電池裝置(如圖3)進行驗證,有效避免Ag+與I-生成沉淀而不妨礙驗證氧化還原反應的發生[1]。
四、對氧化還原反應進行定量化探究
鐵、鋁在濃硝酸中的鈍化是中學化學的重要知識,但金屬鈍化所需的硝酸濃度教材中并未做出具體說明。如果想探究這個問題,可以調節雙液原電池裝置(如圖4)中定量加入硝酸和水的體積來調控硝酸的濃度,根據電流計指針“先偏轉再反向偏轉”的現象來判斷反應情況,從而較為精確地測定硝酸使鋁鈍化的最低濃度[2]。
雙液原電池在研究氧化還原反應中具有科學性和可操作性,在排除干擾、控制變量、對比分析、定量顯示等方面都有良好表現。使用雙液原電池裝置進行實驗探究,不僅是很好的教學輔助方法,同時也是激發學生探究興趣、提升學生獲取證據能力、培育學科核心素養的有效策略。
參考文獻
[1]金劍鋒.基于熱力學和電化學原理厘清反應的競爭問題[J].化學教學,2017(12):81-83
[2]諸佳丹,丁偉.原電池法探究金屬銘在濃硝酸中的鈍化行為[J].北學教學,2017(9):59-62

