基于化學核心素養下學考復習的教學研究
吳昊
【摘要】:高中化學學科核心素養是高中學生發展核心素養的重要組成部分,是學生綜合素質的具體體現。以“微粒之間的相互作用力”單元復習教學為例子,探討如何讓化學核心素養與課堂密切結合,為教師在教學中提供些許參考。
【關鍵詞】:作用力;離子鍵 共價鍵 核心素養
一、設計背景
隨著高中課程改革的深化,化學教學越來越重視發展學生化學學科核心素養,如何讓核心素養在課堂上得以體現,成為廣大教師研究的主要工作。蘇教版《必修二》微觀粒子間的作用力,對高一學生來說既抽象又陌生,但這又是學生化學微粒觀念構建的重要組成部分,將學生對物質結構的認識提到一個新的層次。筆者通過高一教學的同課異構過程中,總結了一些教學設計,供大家參考。
二、教學設計
1.學情分析
學生這一單元學過來,主要存在困難的有以下幾點:物質作用力的判斷,物質變化破壞何種作用力,電子式的書寫。因為作用力本身宏觀不可見,比較抽象,因此需要建立模型及推理,并用生活中常見例子讓學生加深印象。
2.教學目標
(1)能判斷常見物質的作用力
(2)能書寫常見物質的電子式
(3)能說出物質變化過程中破壞何種作用力
(4)了解微粒作用力在生產生活中的應用
3.教學過程
【環節1】微粒之間的作用力是否可見--水分子成像
教師:一杯水通過我們眼睛觀察,看到的是水均一透明,若我們的眼睛能像顯微鏡一樣放大物體數以萬倍觀察,能否看到水分子,能否看到水分子之間的作用力呢?
視頻播放:中國科學家首次拍攝到水分子的內部結構
通過水分子拍攝視頻,讓學生直觀了解到作用力是的的確確真實存在的,明白自己學的化學知識并不是只是局限于理論,而是有實際用途的,并且因為是我國科學家首先提出的,增強了學生的民族自豪感。這些都體現了“證據推理與模型認知”,“科學探究與創新意識”。
【環節2】小組學習--元素、物質、作用力的聯系
提問:利用H、C、Cl、O、Na元素組成哪些物質?這些物質有何種作用力?小組合作討論回答。
根據學生的回答,教師適時補充C2H2,CO2,Na2O2,ClO2,Cl2O,NaHSO4等學考出現過的物質。通過該環節的討論,目的是讓學生形成化學的元素觀,同時激發學生發散性思維。
小結物質作用力判斷方法:
①通常情況,活潑金屬陽離子,銨根出現在物質中,認為有離子鍵,形成物質叫離子化合物。
②離子化合物中可以存在共價鍵,但不存在分子間作用力。
③化學鍵只有共價鍵存在的物質叫共價化合物或共價單質。這些物質中絕大多數存在分子間作用力。
④稀有氣體僅有分子間作用力構成。
對作用力進行分類歸納,體現化學思維中的分類觀,核心素養中的證據推理。
【環節3】電子式的書寫
教師:微粒間作用力有分類,則需要有直觀的表示方式,體現作用力的區別,這就有了電子式這一表示方式。
承接前面小組討論的物質,書寫對應的電子式/結構式。教師可選擇學選考出現頻率高的物質。如:CO2,H2O2,Na2O2,ClO2,HClO,NaOH,H3O+,NaH等。
書寫原則:
先辨別化學鍵類型,后根據最外層電子情況,滿足8電子結構書寫。
這一環節體現化學思維中的符號觀,核心素養的模型認知。
【環節4】判斷物質變化過程中作用力的破壞
教師:從剛才電子式書寫中,不難看出最外層電子成鍵情況是形成化學鍵的根本原因。一個原子最外層電子總是傾向于達到穩定結構,一種通過共用電子,一種通過電子得失。那共價鍵和離子鍵一定完全不同嗎,是否存在聯系?
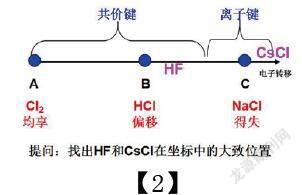
【2】
從坐標上看,隨著電子轉移程度的加大,共價鍵共用電子偏移到臨界點時,就變成了離子鍵。
練習:小組討論破壞何種作用力。
小結作用力破壞判斷原則:
①離子化合物熔化破壞離子鍵
②絕大多數共價化合物熔化破壞分子間作用力,形成原子時破壞共價鍵
這一環節體現化學思維的變化觀,核心素養的變化觀念。
【學習環節6】生產生活中作用力的應用
提問:通過微粒間作用力的分析,可解釋我們日常生產生活的應用原理,請從作用力角度分析海水中提取食鹽和淡水、工業制鈉,電解水的原理。
海水中提取食鹽和淡水過程,淡水分離出來破壞的是分子間作用力,所需要的溫度不高;工業制鈉是電解熔融NaCl,破壞是離子鍵,需要高能量。電解水破壞水分子內的共價鍵,需要高能量。
5.教學設計思路
三、教學思考
修訂后的課程標準提出了以下教學核心策略:(1)教學中應注重運用實驗事實、數據等證據素材,幫助學生轉變偏差認識;(2)注重組織學生開展概括關聯、比較說明、推論預測、設計論證等活動;(3)發揮重要知識的功能價值,幫助學生發展認識化學反應的基本角度,形成基本觀念。本文設計的微粒間的作用力一定程度上讓學生能從更高角度看待問題,追求化學學習的更高層次。
【參考文獻】:
【1】中華人民共和國教研部.普通高中化學課程標準(2017年版)[S].北京:人民教育出版社,2018:18.

