妊娠期糖尿病患者脂肪組織ERα表達水平對胰島素抵抗的影響
徐 寧 張 薇
胰島素抵抗是妊娠期糖尿病的主要發病原因之一。目前認為妊娠期出現胰島素抵抗與胎盤分泌的多種激素有關。其中與雌激素的關系尤為密切,雌激素可通過與受體結合降低脂肪與肌肉組織葡萄糖轉運蛋白4(GLUT4)的表達,降低胰島素敏感度。另外,雌激素受體本身也可調節細胞膜GLUT4的水平,從而參與妊娠引起的胰島素抵抗以及妊娠期糖尿病[1]。脂肪組織是發生胰島素抵抗的主要場所之一[2]。研究顯示,脂肪組織的分布情況會對胰島素抵抗產生影響,妊娠期間由于雌激素水平的改變以及能量的過多攝入,會改變體內脂肪組織的分布,筆者試圖通過對晚期妊娠期糖尿病患者及正常妊娠者脂肪組織雌激素受體表達情況的研究,探究其與胰島素抵抗的相關性以及可能的作用機制。
對象與方法
1.臨床病例研究:病例選擇:選擇2016年1月~2017年3月在杭州市第一人民醫院產檢并行擇期剖宮產的孕婦為研究對象,其中40例妊娠期糖尿病患者為GDM組,患者平均年齡32.05±2.13歲,平均分娩孕周38.88±1.20周,同期41例正常妊娠孕婦作為對照組,平均年齡31.25±3.12歲,平均分娩孕周39.26±1.02周。GDM診斷參照國際妊娠與糖尿病研究組織的標準,所有患者無產科合并癥如妊娠期高血壓、妊娠期肝內膽汁淤積癥等,無內外科合并癥如2型糖尿病、甲狀腺功能減退或亢進、非藥物依賴、無胎兒先天異常、無吸煙史、非借助輔助生殖技術以及非多胎妊娠。記錄患者剖宮產分娩前身高、體重、宮高、腹圍以及孕前體重。于手術前抽取空腹靜脈血,電化學發光免疫法測定血清雌二醇水平,己糖激酶法測定空腹血糖水平、直接化學發光法測定空腹胰島素水平。按胰島素抵抗穩態模型 (HOMA模型) 計算胰島素抵抗指數 (HOMA-IR) =空腹血漿胰島素 (μU/ml)×空腹血漿葡萄糖 (mmol/L)/22.5評估胰島素抵抗水平。于剖宮產手術時收集所有患者皮下、腹膜外及大網膜部位的脂肪組織各兩小塊,保存于-80℃冰箱。所有標本獲取均得到患者的知情同意。
2.RT-PCR法檢測GDM組及正常妊娠組不同部位脂肪組織ERαRNA的表達:將收集的脂肪組織分為用Trizol裂解細胞,提取細胞總RNA。然后測定RNA含量,并進行反轉錄成cDNA。使用primer 3進行引物設計,ERα上游引物為:5′-CTGCCACCCTATCTGTATCTTTTCCTATTCTCC-3′,下游引物:5′-TCTTTCTCTGCCACCCTGGCGTCGATTATCTGA-3′,β-actin上游引物:5′-CATGTACGTTGCTATCCAGGC-3′,下游引物:5′-CTCCTTAATGTCACGCACGAT-3′,然后進行RT-PCR,以actin為標準,將CT值進行比較之后得到的ERα表達。
3.Western blot法檢測ERα蛋白的表達水平:將收集的脂肪組織用含蛋白酶抑制劑的裂解液裂解細胞,提取總蛋白[3]。BCA法測定蛋白含量,配制上樣蛋白。進行蛋白電泳,250mA電流運行2.5h轉膜轉至PVDF膜,質量分數為5%脫脂牛奶封閉1h。洗膜3次后,加入一抗,4℃孵育過夜。洗膜3次后,加入二抗,室溫繼續孵育1h。最后加入化學發光辣根過氧化酶(HRP)底物,于化學發光成像儀進行分析。使用Quantity one (bio-rad)軟件量化相關條帶的發光強度。
4.3T3-L1前脂肪細胞培養和誘導分化[4]:3T3-L1前脂肪細胞購自中國科學院上海生命科學研究院細胞資源中心。取第4~6代的3T3-L1前脂肪細胞進行實驗。將其接種于6孔板,完全培養基[高糖DMEM培養基(美國HyClone公司)中添加質量分數為10%的BSA、10U/L青霉素和10U/L鏈霉素]培養待細胞融合2天后,加含0.5mmol/L的異丁基甲基黃嘌呤(IBMX)、0.25μmol/L地塞米松和1mg/L胰島素的完全培養基(誘導分化培養基Ⅰ)培養2天后,用只含1mg/L胰島素的完全培養基(誘導分化培養基Ⅱ)繼續培養,每隔2天更換1次培養液,約12天到14天后,90%以上細胞分化為成熟脂肪細胞,細胞體積增大,胞體變圓,胞質內脂滴明顯。
5.RT-PCR法測定ERα和GLUT4在成熟脂肪細胞RNA的表達水平,Western blot法檢測其在蛋白水平的表達:將分化成熟的脂肪細胞在含有20ml/L胎牛血清(美國Abcam公司)高糖DMEM中培養6h,在成熟脂肪細胞中加入不同濃度的17β-雌二醇(0、0.1、1、10、100nmol/L),培養12h后收集細胞,分別用RT-PCR法和Western blot法測定ERα(美國Abcam公司)和GLUT4的表達水平。
6.Western blot法檢測MAPK通路JNK、ERK1/2、P38 活性:將10nmol/L濃度17β-雌二醇與成熟脂肪細胞共同孵育12h后,收集細胞,提取蛋白,用博士德BCA蛋白定量試劑盒測定蛋白濃度后各取蛋白50μg變性,SDS聚丙烯酰胺凝膠電泳后電轉移至硝硝酸纖維素膜,含有5%牛奶的TTBS緩沖液封閉1h,PVDF膜與小鼠抗人p-JNK(美國CST公司),兔抗人p-ERK1/2(美國CST公司),p-p38單克隆抗體(美國CST公司,1∶1000)4℃下孵育過夜,TBST 15min漂洗3次,加入羊抗鼠(武漢博士德公司),羊抗兔二抗(武漢博士德公司,1∶1000)室溫下孵育1h,TBST 15min漂洗3次,使用ImmobilonTM Western Chemiluminescent HRP Substrate顯色劑顯色,全自動凝膠成像分析儀器拍照。為校正總蛋白上樣量一致,檢測完上述磷酸化抗體后的膜以洗脫液(100mmol/L β-ME,2%SDS,62.5mmol/L Tris-HCL pH值6.7)于50℃洗脫30min,再用兔抗人JNK,ERK1/2、p38多克隆抗體(1∶1000)檢測總JNK、ERK1/2、p38作為內對照,測定雜交信號的吸光度,每組實驗重復3次,p-JNK、p-ERK1/2、p-p38代表被激活的MAPK[5]。同上方法檢測PI3K/Akt信號通路PI3K、Akt活性。
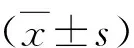
結 果
1.GDM患者組與正常妊娠孕婦組一般資料比較:GDM患者組E2水平、HOME-IR明顯高于正常妊娠組,差異有統計學意義(P=0.000),兩組孕婦年齡、孕周、孕前體重指數(pre-BMI)、宮高比較,差異均無統計學意義(P>0.05),詳見表1。

表1 一般資料
2.GDM患者組及正常妊娠組不同部位脂肪組織雌激素受體α的表達情況:GDM患者皮下、腹膜外及大網膜3處脂肪組織中,雌激素受體α在RNA和蛋白的表達水平均明顯低于正常妊娠者,且差異有統計學意義(P<0.05),詳見圖1、圖2。

圖1 雌激素受體α在RNA水平的表達與正常妊娠組比較,*P<0.05
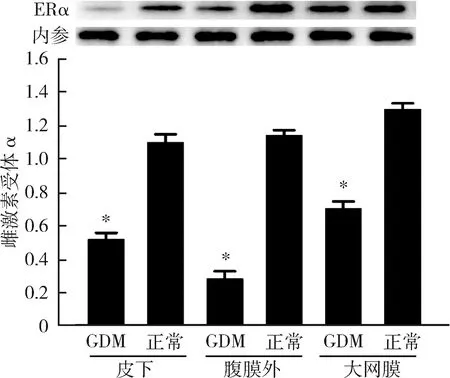
圖2 雌激素受體α在蛋白水平的表達與正常妊娠組比較,*P<0.05
3.不同濃度17β-雌二醇處理后成熟脂肪細胞雌激素受體α及GLUT4的表達情況:隨著17β-雌二醇濃度的升高,雌激素受體α不論在RNA水平還是在蛋白水平,其表達均逐步受到抑制,并且在10nmol/L濃度下,雌激素受體α表達水平達到最低,差異有統計學意義(P<0.05),詳見圖3、圖4。GLUT4的表達情況與ERα相似,也在10nmol/L濃度時表達水平最低,差異有統計學意義(P<0.05),詳見圖5、圖6。
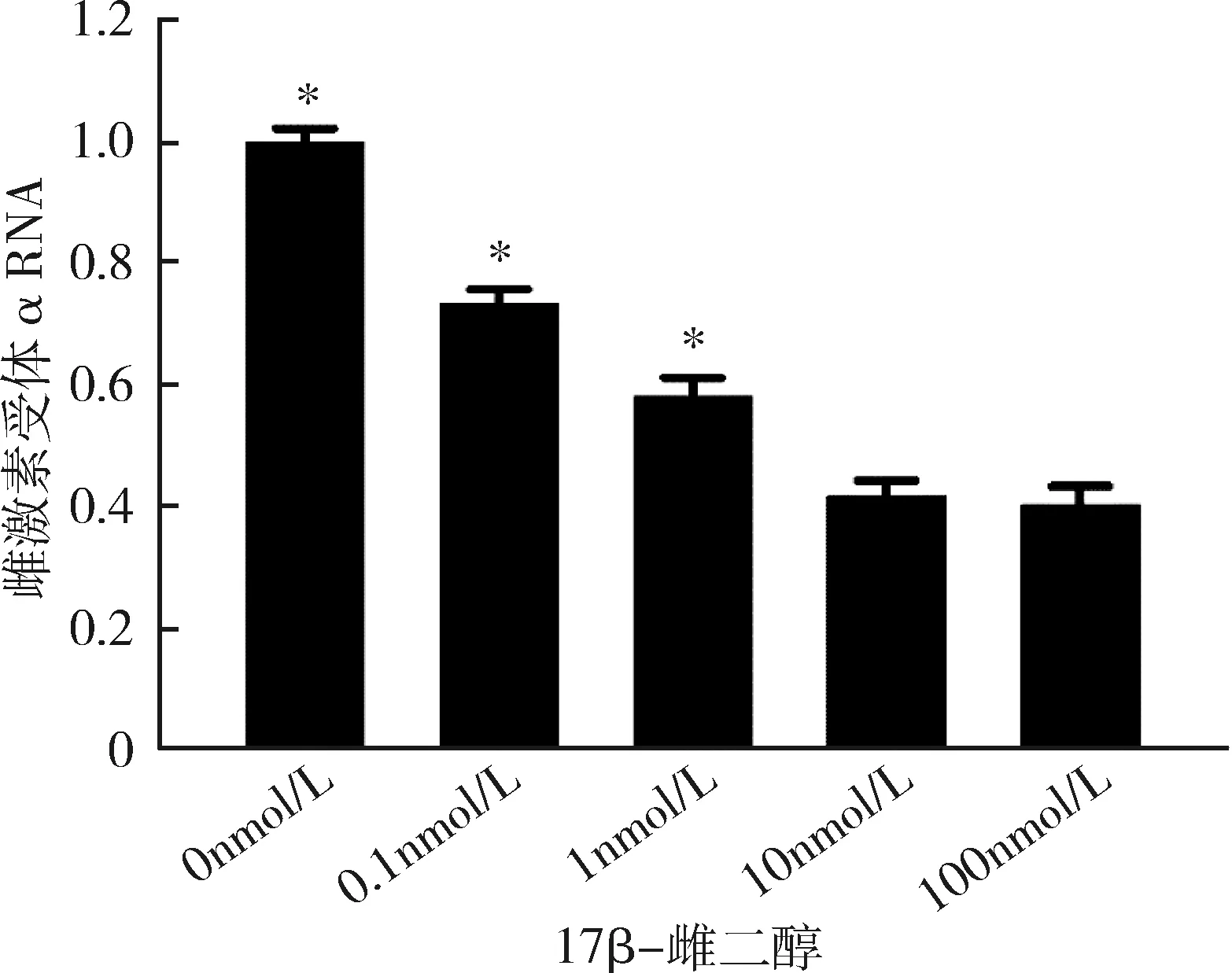
圖3 不同濃度17β-雌二醇刺激下雌激素受體α在RNA水平的表達與10nmol/L比較,*P<0.05

圖4 不同濃度17β-雌二醇刺激下雌激素受體α在蛋白水平的表達與10nmol/L比較,*P<0.05
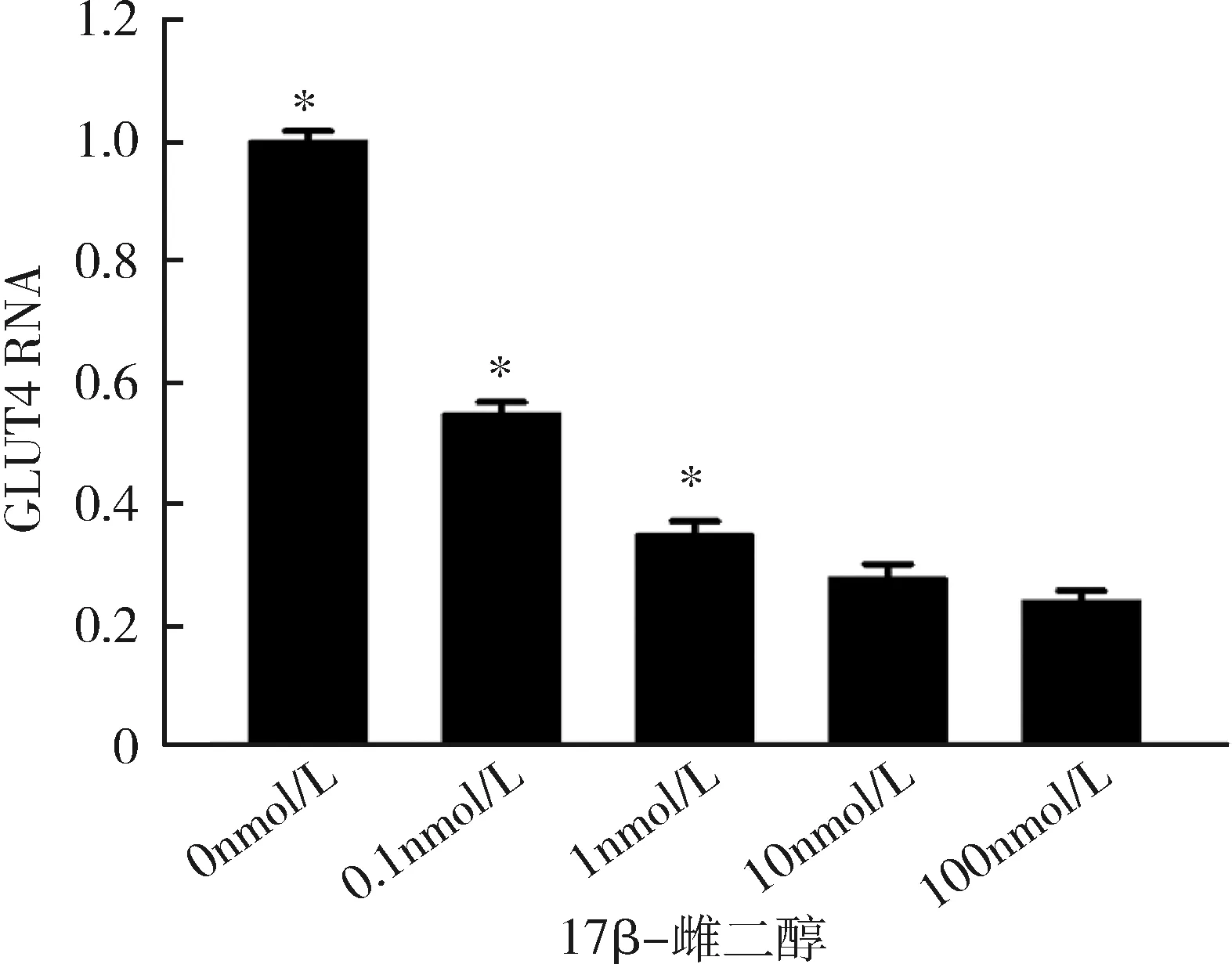
圖5 不同濃度17β-雌二醇刺激下GLUT4在RNA水平的表達與10nmol/L比較,*P<0.05

圖6 不同濃度17β-雌二醇刺激下GLUT4在蛋白水平的表達與10nmol/L比較,*P<0.05
4.高濃度17β-雌二醇刺激下胰島素信號通路(PI3K/Akt和MAPK)的表達情況:在10nmol/L濃度的17β-雌二醇刺激下,脂肪細胞PI3K/Akt信號通路的PI3K和p-Akt的蛋白表達量均下調,MAPK通路的p-Erk、p-MAPK和p-p38的蛋白表達量下調,而p-JNK的蛋白表達量上調(圖7)。
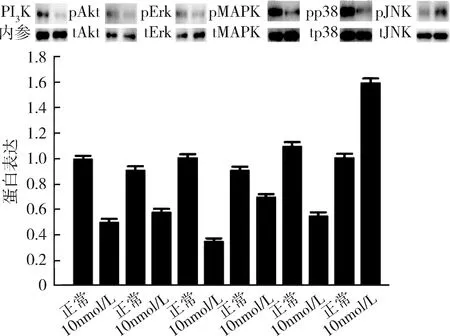
圖7 高濃度17β-雌二醇刺激下PI3K/Akt和MAPK信號通路表達情況
討 論
妊娠期糖尿病(gestational diabetes mellitus GDM)是指妊娠期間發生的糖代謝異常,與孕期胰島素抵抗和分泌相對不足密切相關[6]。其發生率世界各國報道為1%~14%。我國GDM的發生率也呈逐年上升趨勢。妊娠期是女性漫長的人生過程中的特殊時期。妊娠期間為了適應胎兒的生長,激素和代謝環境會發生明顯的改變,胎盤分泌的多種激素在維持妊娠的同時,可增加胰島素抵抗,使胰島素的靶組織對胰島素的敏感度降低,從而使無糖尿病者發生妊娠期糖尿病(GDM),隱性糖尿病呈顯性或原有糖尿病的患者病情加重。除了肝臟和骨骼肌,胰島素信號途徑在脂肪組織葡萄糖代謝中同樣起重要作用,并且有越來越多的研究證實,脂肪組織才是胰島素抵抗產生的始發部位[7]。
雌激素是女性生殖系統中最重要的類固醇激素之一,在調節人體代謝中發揮了重要作用[8]。妊娠期間女性雌激素水平可顯著升高,與受體(estrogen receptor,ER)結合后,可介導經典的信號轉導途徑,產生過度肥胖、胰島素抵抗等多種雌激素效應[9]。本研究也顯示GDM組不但雌激素水平顯著高于正常妊娠組,胰島素抵抗的嚴重程度也顯著高于正常妊娠組,表明GDM患者胎盤會分泌更多的雌激素,也證實高雌激素水平與胰島素抵抗之間密切相關。
雌激素核受體(ER)是核受體超家族的成員之一,ERα和ERβ是其中主要的兩種亞型,兩者由不同基因編碼,從而在生物學特性上體現出許多差異[10]。ERα在調節脂質代謝中發揮重要作用,動物研究實驗證實雌激素對葡萄糖代謝的調節作用主要由ERα介導,并且與妊娠期胰島素敏感度改變和糖耐量異常相關[11]。ERα主要分布于雌二醇作用的經典靶組織,包括脂肪組織。妊娠期間充足的營養攝入,以及胎盤分泌多種激素的調控,使得孕婦體內脂肪組織的數量和分布產生明顯的改變,不論是皮下脂肪還是內臟脂肪,含量均會明顯升高,由此導致的ERα在脂肪組織的表達水平也會發生變化。本研究顯示,GDM患者皮下、腹膜外及大網膜3處脂肪組織中,雌激素受體α在RNA和蛋白的表達水平均明顯低于正常妊娠患者,表明高濃度的雌激素水平會抑制脂肪組織ERα的表達,并與胰島素抵抗的發生密切相關,這與雌激素可導致GLUT4以雌激素受體依賴的方式轉移到質膜上,從而降低組織中雌激素受體與GLUT4的表達有關[12]。
脂肪細胞占脂肪組織的1/3~1/2,筆者將3T3-L1前脂肪細胞株培養分化為成熟脂肪細胞,并給予不同濃度的17β-雌二醇,發現隨著17β-雌二醇濃度的升高,雌激素受體α不論在RNA水平還是在蛋白水平,其表達均逐步受到抑制,并且在10nmol/L濃度下,雌激素受體α表達水平達到最低,而GLUT4的表達情況與ERα相似,進一步證實了高濃度的雌激素水平會抑制雌激素受體α在脂肪細胞的表達。研究表明葡萄糖轉運體(GLUT)在胰島素作用下可以運動到細胞膜上吸收血液中的葡萄糖,GLUT4是脂肪組織對葡萄糖攝取過程中一個重要的調節因子,GLUT4表達受抑制,表明脂肪組織對胰島素的敏感度降低,胰島素抵抗加重[13]。在成熟脂肪細胞中,高能濃度17β-雌二醇刺激下,GLUT4與雌激素受體α表達同步受抑制,也證明了雌激素受體α表達與胰島素抵抗的發生密切相關。
目前已知的胰島素信號通路主要有PI3K/Akt通路和ERK/MAPK通路[14]。二磷酸磷脂酰肌醇在PI3K催化下轉化為三磷酸磷脂酰肌醇,激活的PI3K/Akt能夠促使GLUT4從胞質轉位至胞膜,同時細胞外的葡萄糖經由胞膜上的GLUT4轉運至細胞內,因此這一通路的活化增加了細胞對葡萄糖的攝取,如果上述信號通路轉導過程發生障礙,將導致脂肪組織發生胰島素抵抗[15]。筆者進一步研究了高濃度17β-雌二醇作用下,對成熟脂肪細胞PI3K/Akt信號通路的影響,發現其在抑制ERα表達的同時,抑制PI3K/Akt信號通路,故而推測ERα可能通過抑制PI3K/Akt信號通路,加劇了胰島素抵抗。筆者也觀察到ERα對MAPK通路的影響表現為下游p-Erk、p-MAPK和p-p38的蛋白表達量下調,而p-JNK的蛋白表達量上調,表明ERα可能通過激活JNK通路而對胰島素抵抗產生影響。
綜上所述,脂肪組織ERα的表達水平與胰島素抵抗密切相關,并且可能通過抑制PI3K/Akt信號通路和激活JNK通路從而對胰島素抵抗產生影響。

