核心素養視角下高中化學“學生活動”設計案例分析
周波

[摘要]簡要概括了化學學科核心素養與學生發展核心素養的關系,提出了核心素養指導下的“學生活動”設計思路,總結了落實核心素養的教學方法。
[關鍵詞]化學學科核心素養;學生活動;化學反應速率;影響因素
[中圖分類號]G633.8? [文獻標識碼]A? [文章編號]1674-6058(2020)02-0058-03
學生發展核心素養是指學生應具備的,能夠適應終身發展和社會發展需要的必備品格和關鍵能力。從心理學的角度來講,教學活動應遵循學生的認知規律,研究學生的學習動機和學習方法,而不是一味地強調知識的系統性、權威性和完整性。只有突出學生的主體性才能真正落實學生核心素養的發展。什么樣的活動可以突出學生的主體性?什么樣的設計才能彰顯學科核心素養?什么樣的教學才能落實學生發展核心素養?我們嘗試在“學生活動”設計中尋找答案。
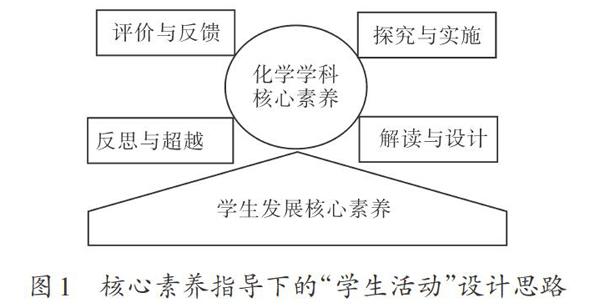
一、核心素養指導下的“學生活動”設計思路
“學生活動”是一種基于情境,通過問題引導學生自主學習,并促進學生合作探究的教學活動模式,它的設計思路如下:
學科核心素養引領整個“學生活動”的設計、實施和評價,它是活動設計的方向,也是目標;教師解讀教材、設計活動從這里出發,學生研讀信息和探究真理以此為核心,最后的評價與反饋也將回歸此處。教師解讀標準設計活動、學生合作探究實施活動、師生共同評價反饋活動,三個環節相互銜接、相輔相成。基于問題的“學生活動”,學生是中心,素養是目的,教師是組織者和激勵者。以學科核心素養為綱領的各項活動最終的目的都指向學生發展核心素養,都是為學生形成終身發展和社會發展需要的關鍵能力和必備品格而服務的。
二、《影響化學反應速率的因素》“學生活動”設計
1.學情分析
在必修課中,學生通過實例和實驗初步了解了化學反應速率及其影響因素,為掌握“化學反應速率”的概念及表示方法,認識濃度、壓強、溫度和催化劑等對化學反應速率的影響打下了知識基礎。在選修教材的緒言中,學生認識了概念模型是學習和研究化學反應原理的基礎,初步了解了“有效碰撞模型”“活化分子與活化能”等概念模型,為解釋外界條件對化學反應速率的影響提供了理論基礎。學生還在本章《化學反應速率和化學平衡》第一節的學習中掌握了一些測定化學反應速率的方法,為本節的實驗探究奠定了實踐基礎。
2.目標解讀
證據推理:舉例描述各種外界條件對化學反應速率的影響,學會收集各種證據的方法,認識化學反應速率可以調控。
微觀探析:能從微觀層面解釋外界條件對化學反應速率的影響,能運用“活化分子”理論模型解釋外界條件的改變對化學反應速率的影響。
變化觀念:認識到影響化學反應速率的根本原因是反應物本身,即“內因”,不同的外界條件能改變化學反應速率,即外因,能從內因和外因的角度分析化學反應速率。
實驗探究:能依據探究目的設計探究方案,進行實驗探究;能根據探究目的選擇恰當的探究方法,如控制變量法。
科學精神:通過體會反應條件在生活、生產和科學研究領域中的重大作用,贊賞化學對社會發展的重大貢獻。
3.“學生活動”與設計意圖
(1)在情境中建立變化觀念
情境一:回顧不同金屬與水反應的情況,并回答相關問題。
結論:物質間能否發生反應是由物質本身的性質決定的,對于能發生的化學反應,影響化學反應速率的根本原因是??? ,我們稱之為“內因”。
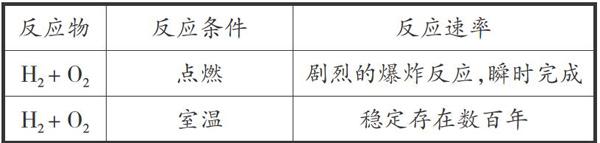
情境二:H2和O2在不同條件下的反應情況對比。
結論:物質之間反應的內因已經具備,但化學反應的反應速率還受反應進行時所處的??? 的影響,我們稱之為“外因”。
設計意圖:通過比較活潑性不同的金屬與水反應的反應條件及難易程度,引導學生思考影響化學反應速率的根本原因。通過對比不同條件下氫氣與氧氣的反應情況,啟發學生琢磨外界條件對化學反應速率的影響。學科素養是在人與情境的互動中形成的,該活動從學生熟悉的情境入手,設置懸念,引導學生多角度研究物質的變化,激勵學生探尋現象背后的規律,探索紛繁的化學反應背后的規律。
(2)在實驗中培養探究能力
實驗目的:其他條件不變時,改變H2C2O4溶液的濃度,探究濃度對KMnO4與H2C2O4反應的反應速率的影響。
實驗原理:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
自變量與因變量:
①研究的變量(自變量):????? ;
②控制的不變量: ???;
③因變量(一般選擇易于測量的物理量):??? 。
實驗過程:
①實驗裝置、藥品與實驗操作(略)。
②記錄、處理實驗數據。
實驗現象、結論及解釋:
①實驗現象:??? ;
②實驗結論:??? ;
③解釋結論:??? 。
設計意圖:影響化學反應速率的因素有很多,為了探究某一因素對化學反應速率的影響及影響程度,學生需要掌握“控制變量法”這一重要的科學探究方法。圍繞“探究濃度對化學反應速率的影響”這一目的展開探究,明確“H2C2O4溶液的濃度”這一自變量,控制好“KM-nO4(H+)溶液的濃度、體積、溫度”“H2C2O4溶液的體積、溫度”等不變量,準確記錄“速率”這一因變量,把握好“三量”,學生也就掌握了控制變量法。同時通過活動培養學生的動手操作能力,提升學生加工實驗信息的能力,加強學生的交流合作能力。實驗探究的目的就是讓學生運用科學的思維方式分析問題并解決問題,拿到一把通向自然科學大門的金鑰匙。
(3)在活動中構建模型認知
環節一:回顧有效碰撞模型
環節二:運用有效碰撞模型解釋
①對于有氣體參加反應的體系,其他條件相同時,增大壓強,相當于? 反應容器的容積,反應物濃度? ,單位體積內活化分子數目? ,活化分子百分數? ,反應速率? 。
②對于有氣體參加反應的體系,其他條件相同時,減小壓強,相當于? 反應容器的容積,反應物濃度? ,單位體積內活化分子數目? ,活化分子百分數? ,反應速率? 。
設計意圖:“概念模型法”是一種科學研究方法,是學習化學反應原理的基礎。環節一是讓學生重溫緒言中的有效碰撞理論,有效提取原有知識;環節二將模型圖形化、形象化、直觀化,讓學生自主分析“單位體積內活化分子數”及“活化分子百分數”的變化情況,并得出相應的結論。指導學生用活化分子概念模型來解釋“壓強影響化學反應速率”這一化學現象,預測可能的變化,幫助學生建立解決復雜化學問題的思維框架。
(4)在探究中培養創新意識
限選試劑和儀器:0.1 mol/L KMnO4溶液、0.1 mol/L H2C2O4溶液、0.1 mol/L H2SO4溶液、MnSO4、蒸餾水;試管、10 mL量筒、100 mL量筒、溫度計、恒溫水浴槽(可控制溫度)、秒表等。
實驗目的:探究溫度、催化劑對化學反應速率的影響。
實驗原理:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MSO4+10CO2↑+8H2O
實驗方案:
①明確自變量是什么,因變量是什么,需要控制的不變量有哪些。
②設計實驗方案,擬定實驗表格,完整體現實驗數據[列出能直接讀取數據的相關物理量及需擬定的數據,數據用字母表示;表中V(溶液)表示所配制溶液的體積]。
③實驗現象和實驗結論(略)。
④用有效碰撞模型解釋實驗結論。
設計意圖:在教學活動中,要盡量避免知識和方法的簡單重復,應設計問題讓學生在新的情境中運用知識。實驗前學生已經了解了控制變量法的基本原理,掌握了控制變量法的一般步驟,為本次自主探究積累了實踐經驗。學生也能夠運用概念模型解釋壓強對化學反應速率的影響,為本次自主探究提供了理論基礎。在探究溫度和催化劑對化學反應速率的影響的活動中,繼續按照前面的方式進行也未嘗不可,只是這樣一來,學生的學習就會是被動的,學生學到的知識就是靜態的,學生的能力也會是僵化的,這種簡單的復制和運用無法培養學生的創新能力,也難以形成核心素養。而該探究實驗只給出探究目的和限選試劑、儀器,讓學生根據探究原理自主設計探究方案,獨立完成實驗操作,同學間互相分享實驗現象、交流實驗結論,不僅讓已學知識和方法有了新的增長點,還提高了學生學習的主動性,促進了學生間的交流與合作。唯有如此,我們的教學才是創造性的勞動,學生的創新意識才會萌芽。
三、教學反思
首先,“學生活動”設計的對象必須是人。學科知識是形成學科素養的載體,學科活動是形成學科素養的渠道。教師教學觀念最大的改變就是把“教知識”轉化成“通過知識來教”。將“教在學前,師在生上”轉變成“學在教前,師在生中”,突出了學習的主體性,但這并不代表教師的作用減弱了,相反對教師的要求更高了。教師不僅要科學地把握學科知識系統,還要從心理學和教育學的高度了解學生的發展需求,并融洽兩者的關系。針對學生的現狀和需求,設計活動運用知識,通過活動提升學生學科素養,是“學生活動”設計的中心思想。
其次,“學生活動”設計的關鍵之處是問題和情境。問題是活動的最佳切入點:問題帶來的懸念能激發學生的學習興趣;問題帶來的啟發能引領學生洞察現象背后的本質;問題帶來的靈感能使學生欣喜若狂;問題帶來的交流能讓學生的思維碰撞出火花。在學生活動設計過程中,教師的設問要站在學生的角度,想學生之所想、問學生之不會問。情境是聯系學科知識與生活的橋梁。把真實情境中的問題與學科知識有機結合設計成“學生活動”,讓學生在原有經驗的基礎上展開探究,增強了學生的學科認同感,促使學生主動學習。學生用學到的學科知識去解決生活中的問題,提高了學科獲得感,素養養成自然水到渠成。
最后,“學生活動”設計的落腳點是教學評價。“學生活動”設計的指導思想、目的以及過程都要指向學生發展核心素養,但我們在實施以“學生活動”為中心的教學模式中,苦于找不到具有可操作性的教學評價。學生發展核心素養從框架到課堂仍有一定的距離,評價如何同教學保持良好的一致性?形成性評價如何形成?這些問題都亟須我們廣大教育工作者去做進一步的思考。

