高尿酸血癥對維持性血液透析患者心血管危險因素聚集及相關并發癥的影響
陳璐 陳偉珍 王莎莎


[摘要] 目的 探討高尿酸血癥(HUA)對維持性血液透析(MHD)患者心血管危險因素(CRFs)聚集及相關并發癥的影響。 方法 以2018年1月~2019年7月本院腎病內科治療的280例MHD患者為目標對象,收集其基本資料、常規生化指標及血清尿酸(UA)檢測結果。統計HUA、CRFs聚集及相關并發癥發生情況,并根據是否發生HUA將患者分為HUA組與nHUA組,統計分析HUA的高危因素及UA與生化指標、CRFs聚集率的關系。 結果 本組患者中,159例發生HUA,占56.79%。與nHUA組比較,HUA組患者中具有≥2個CRFs者占比明顯高,CRFs聚集率顯著高(P<0.05);且HUA組高血壓、心律失常、高脂血癥、血管硬化、主動脈鈣化、左心室肥厚、心力衰竭發生率明顯高(P<0.05)。與nHUA組相比,HUA組體質量指數(BMI)、收縮壓、舒張壓、甘油三酯、總膽固醇、血清超敏C反應蛋白(hs-CRP)、同型半胱氨酸(Hcy)、內皮素(ET)水平明顯高,一氧化氮(NO)水平明顯低(P<0.05),Logistic回歸分析得出上述因素與CRFs聚集率均為MHD患者發生HUA的危險因素(P<0.05)。Pearson相關性分析顯示血清UA濃度與BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、hs-CRP、Hcy、ET、NO及CRFs聚集率均有明顯相關性(P<0.05)。 結論 MHD患者HUA發生風險高,HUA除了與肥胖、高血脂、高血壓、炎癥反應、內皮功能紊亂有關外,還與CRFs聚集密切相關,其可增加心血管并發癥發生風險,故應密切監測患者UA水平變化。
[關鍵詞] 高尿酸血癥;維持性血液透析;心血管危險因素聚集;并發癥
[中圖分類號] R459.5? ? ? ? ? [文獻標識碼] B? ? ? ? ? [文章編號] 1673-9701(2020)03-0105-04
[Abstract] Objective To investigate the effect of hyperuricemia(HUA) on the accumulation of cardiovascular risk factors(CRFs) and related complications in patients with maintenance hemodialysis(MHD). Methods A total of 280 MHD patients treated in the department of nephrology in our hospital from January 2018 to July 2019 were enrolled. The basic data, routine biochemical parameters and serum uric acid(UA) test results were collected. The HUA, CRFs aggregation and the occurrence of related complications were counted. The patients were divided into HUA group and nHUA group according to whether HUA occurred. The relationship between HUA risk factors and UA and biochemical indicators and CRFs aggregation rate was analyzed statistically. Results Of the patients in this group, 159 cases occurred HUA, accounting for 56.79%. Compared with that of the nHUA group, the proportion of patients with ≥2 CRFs in the HUA group was significantly higher, and the CRFs aggregation rate was significantly higher(P<0.05). And the HUA group had higher incidences of hypertension, arrhythmia, hyperlipidemia, hardening of the arteries, and aorta calcification, left ventricular hypertrophy, and heart failure(P<0.05). Compared with those of nHUA group, the levels of body mass index(BMI), systolic blood pressure, diastolic blood pressure, triglyceride, total cholesterol, serum high-sensitivity C-reactive protein(hs-CRP), homocysteine(Hcy) and endothelium(ET) in HUA group were significantly higher, and the level of nitric oxide(NO) was significantly lower(P<0.05). Logistic regression analysis showed that the above factors and the aggregation rate of CRFs were risk factors for HUA in patients with MHD(P<0.05). Pearson correlation analysis showed that serum UA concentration was significantly correlated with BMI, systolic blood pressure, diastolic blood pressure, triglyceride, total cholesterol, hs-CRP, Hcy, ET, NO and CRFs aggregation rate(P<0.05). Conclusion The risk of HUA in patients with MHD is high. In addition to obesity, hyperlipidemia, hypertension, inflammatory reaction and endothelial dysfunction, HUA is also closely related to the accumulation of CRFs, which may increase the risk of cardiovascular complications. Therefore, the UA level changes in patients should be closely monitored.
[Key words] Hyperuricemia; Maintenance hemodialysis; Cardiovascular risk factors accumulation; Complications
人體的尿酸(uric acid,UA)80%來源于內源性嘌呤代謝,另外20%通常源自富含嘌呤或核酸蛋白的食物,正常情況下,血清UA濃度波動范圍較窄。據報道[1],普通人群、住院人群中無癥狀性高尿酸血癥(Hyperuricemia,HUA)患病率約為21%和25%。人體UA排泄主要發生在腎臟,事實上,倘若UA過多,排泄不及時或不完全,可促使90%的個體發生HUA,腎小球濾過的急性或慢性減少均可誘發HUA[2]。慢性腎臟疾病(Chronic kidney disease,CKD)患者常伴有腎小管損傷及血清UA濃度增加,既往研究[3]證實,維持性血液透析(maintenance hemodialysis,MHD)是提高CKD患者生存質量及挽救生命的重要治療途徑,但此類患者HUA發生率較高(超過50%);另有研究[4]表明,高UA濃度是CKD患者腎衰竭早期階段的獨立危險因素,其與各種原因死亡率呈“J”型曲線關系。此外,心血管疾病(Cardiovascular diseases,CVD)已明確為引發終末期腎病死亡的重要原因[5]。基于此背景,本研究旨在明確HUA對MHD患者心血管危險因素(Cardiovascular Risk Factors,CRFs)聚集及相關并發癥的影響。
1 資料與方法
1.1 一般資料
抽取2018年1月~2019年7月本院腎病內科治療的280例MHD患者作為目標對象,其中男157例、女123例,年齡45~80歲,平均(54.96±15.22)歲,透析時間6~62個月,平均(29.25±6.84)個月,原發病為慢性腎小球腎炎79例、糖尿病腎病62例、高血壓腎損害49例、間質性腎炎42例、成人型多囊腎27例、狼瘡性腎炎11例、慢性腎盂腎炎10例。所有患者血管通路均為動靜脈內瘺,應用瑞典金寶公司生產的AK96血液透析機、聚砜膜透析器F14,透析血流量、透析液流量為(250~300)mL/min、500 mL/min。本次研究通過醫院倫理委員會審核,且所有患者均在充分獲知研究意義和目的前提下自愿簽署知情同意書。
入選標準:(1)男女不限,年齡45~80周歲;(2)CKD分期[6]已達5期,腎小球濾過率<15 mL/min;(3)持續血液透析至少已有6個月,每周血液凈化治療3次(4 h/次),且透析時血流通暢,超濾可達到或接近干體重;(4)積極配合資料收集、相關指標檢測,臨床各項資料詳實。
排除標準:(1)血液透析不規律,或對透析器、灌流器的膜有過敏反應或無法耐受;(2)當前存在急性炎癥疾病,或合并重要臟器如肺、腦、心、肝等功能障礙;(3)存在活動性惡性腫瘤;(4)近3個月內發生嚴重感染、心力衰竭;(5)存在近半個月內服用利尿劑或降尿酸藥物等其他影響血尿酸水平的情況。
1.2 分組與HUA、CRFs診斷標準
根據是否發生HUA將患者分為HUA組與nHUA組。HUA診斷標準以《中國腎臟疾病高尿酸血癥診治的實踐指南(2017版)》[7]為依據,需滿足血清UA濃度>420(男性)或360(女性)μmol/L。本組280例MHD患者平均血清UA濃度為(375.21±85.44)μmol/L,其中HUA 159例,占56.79%。
CRFs共分為四大類[8]:(1)體重異常,體質量指數(body mass index,BMI)≥28 kg/m2;(2)血壓異常,收縮壓≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒張壓≥90 mmHg;(3)血糖及其控制異常,空腹血糖≥7.0 mmol/L和(或)糖化血紅蛋白≥6.5%;(4)血脂異常,甘油三酯≥1.70 mmol/L和(或)總膽固醇≥5.18 mmol/L。
1.3 方法
收集所有患者的臨床基本資料、常規生化指標檢測結果及血清UA檢測結果,其中基本資料包括年齡、性別、體格檢查情況、MHD時間、吸煙飲酒情況、原發病種類等;生化檢查指標包括血糖、血鈣、血磷、血肌酐、尿素氮、總膽固醇、甘油三酯、高敏C反應蛋白(high-sensitivity C-reactive protein,hs-CRP)、血紅蛋白(hemoglobin,Hb)、白蛋白(albumin,Alb)、同型半胱氨酸(Homocysteine,Hcy)、內皮素(endothelin,ET)、一氧化氮(nitric oxide,NO)等,所有患者均于透析前抽取空腹靜脈血,離心處理后取血清標本完成測定,所用儀器為Beckmen Coulter LX20全自動生物化學儀。
1.4 統計學方法
本次研究數據選用SPSS 20.0統計學軟件分析和處理,其中計數資料采用率(%)表示,擬合正態分布的計量資料采用(x±s)表示,組間相關資料分析及CRFs聚集的單因素分析分別進行χ2檢驗與獨立樣本t檢驗;進一步以多因素Logistic回歸分析臨床數據與CRFs聚集的關系,采用Pearson相關系數分析血清UA濃度與各指標的關系。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組CRFs聚集及相關并發癥發生情況
與nHUA組比較,HUA組患者中具有≥2個CRFs者占比明顯高,且CRFs聚集率顯著高(P<0.05);同時,HUA組高血壓、心律失常、高脂血癥、血管硬化、主動脈鈣化、左心室肥厚、心力衰竭發生率明顯高(P<0.05)。見表1~2。
2.2 MHD患者發生HUA的單因素分析
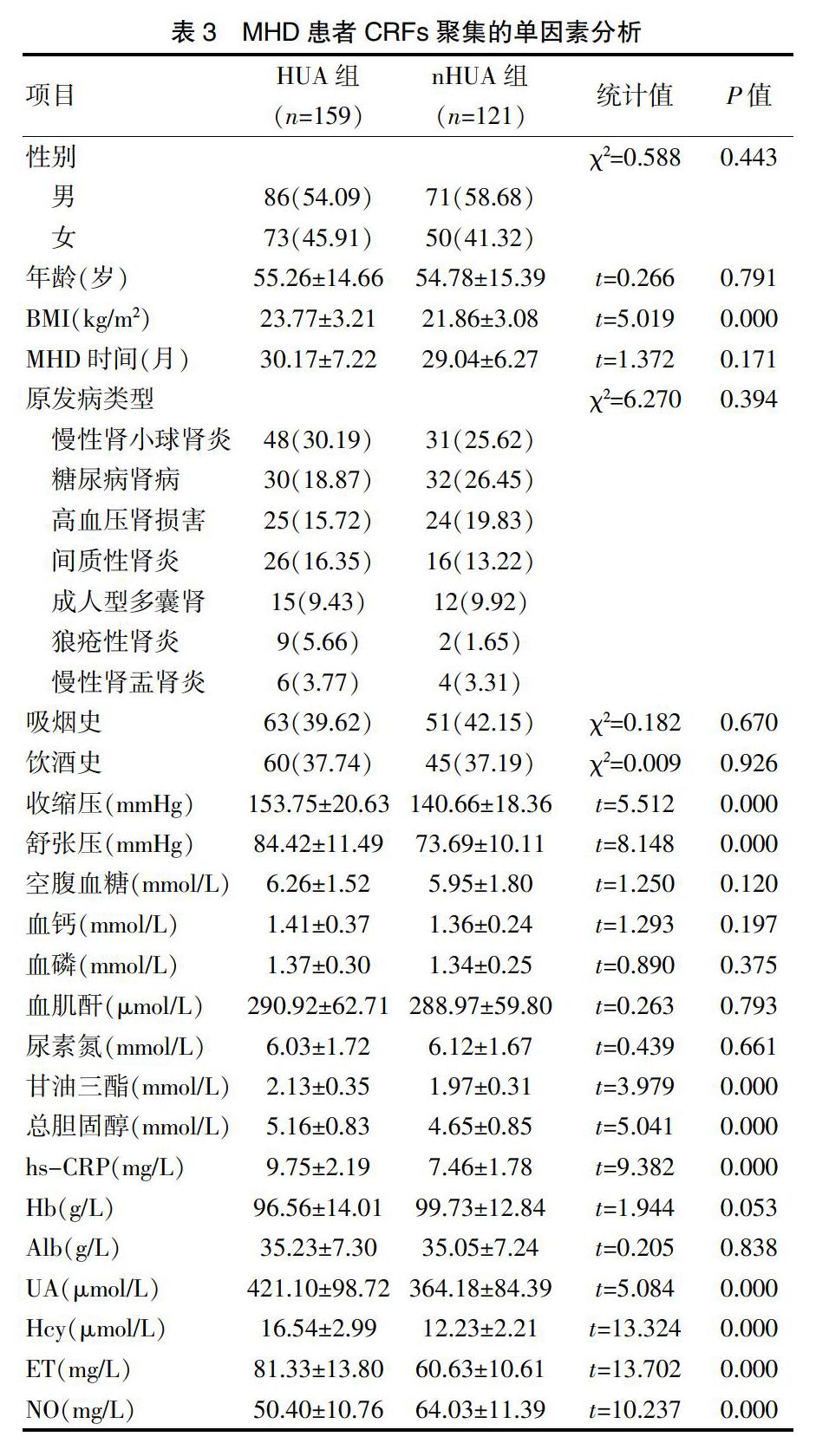
與nHUA組相比,HUA組BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、血清hs-CRP、Hcy、ET水平明顯高,血清NO水平明顯低,均有統計學差異(P<0.05),其余性別、年齡、MHD時間、原發病等資料及空腹血糖、血鈣、血磷等生化指標水平對比無統計學差異(P>0.05)。見表3。
2.3 MHD患者發生HUA的多因素Logistic回歸分析
將上述影響HUA的10個因素(BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、hs-CRP、Hcy、ET、NO、CRFs聚集率)作為自變量,其中僅CRFs聚集率進行賦值(有CRFs聚集=1,無CRFs聚集=0),其余變量不賦值,按實際值分析,以是否發生HUA作為因變量進行條件Logistic回歸分析,得出BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、hs-CRP、Hcy、ET、NO、CRFs聚集率均為MHD患者HUA發生的危險因素(P<0.05)。見表4。
2.4 UA與其他指標的相關性分析
Pearson相關性分析顯示血清UA濃度與BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、hs-CRP、Hcy、ET及CRFs聚集率均呈明顯正相關(r=0.325、0.361、0.307、 0.367、0.307、0.549、0.404、0.415、0.385,P<0.05),與NO明顯呈負相關(r=-0.352,P<0.05)。
3 討論
本研究抽取的280例MHD患者中,159例發生HUA,占56.79%。楊軍等[9]最新報道顯示MHD患者HUA發生率為58.12%,與本研究相近;國外Tsuruta[10]和Petreski等[11]調查研究均顯示MHD患者HUA發生率可超過50%;由此可見,MHD患者具有高HUA發生風險。MHD是終末期腎臟疾病的重要替代療法,對減少患者體內毒性物質堆積,改善預后和提高生存質量有著其他治療手段無法替代的作用。然而近年來,不斷有數據[12]顯示,MHD患者的5年生存率僅為60%左右,死亡的最主要因素為CVD。事實上,MHD與眾多CVD的發生有密切聯系,因此推測,對于MHD患者而言,HUA可增加其CVD及相關并發癥發生率,繼而影響生存率。
現階段已明確,CRFs包括肥胖、血脂異常、高血壓、糖尿病、吸煙等,且此類CRFs的聚類于同一個體,與單一風險因素相比,其未來CVD發生率及死亡率明顯高[13]。本研究顯示,與nHUA組比較,HUA組患者中具有≥2個CRFs者占比明顯高,CRFs聚集率顯著高,且HUA組高血壓、心律失常、高脂血癥、血管硬化、主動脈鈣化、左心室肥厚、心力衰竭發生率明顯高,表明HUA患者CRFs聚集率高,無疑可增加MHD患者CVD及相關并發癥發生率。國內陳佩玲等[14]報道證實HUA為MHD患者心血管鈣化進展的獨立危險因素;任廣偉等[15]研究顯示伴HUA的MHD患者由于內皮功能障礙、氧化應激與腎內炎癥更嚴重,其高血壓、動脈硬化、主動脈鈣化等并發癥發生幾率更高。分析原因在于細胞內UA濃度過高可誘導氧化應激,由此激活促炎因子與促進血管收縮物質合成、分泌,且UA濃度的增加能誘導細胞增殖、衰老、脂肪堆積與抑制胰島素分泌,而這些因素均可直接或間接誘發CVD[16]。
本研究進一步分析MHD患者發生HUA的危險因素,結果發現BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、血清hs-CRP、Hcy、ET、NO及CRFs聚集率均為發生HUA的危險因素,其中hs-CRP為最常見的炎癥指標,其大量釋放可提示炎癥、感染及細胞損傷過程;Hcy參與集體代謝過程,其水平上升可導致氧化應激反應增強,亦可間接反映炎癥反應程度,還可誘發動脈粥樣硬化、血栓形成;具有收縮血管功能的ET主要功能之一為維持正常的血管張力,NO為機體內重要的信息分子與效應分子,可反映人體局部血管張力、全身循環穩定情況,并對ET起拮抗作用,二者失衡可提示內皮功能障礙[17]。由此認為,超重或肥胖、高血壓、高血脂、炎癥反應、內皮功能紊亂及CRFs聚集率均可導致MHD患者HUA風險增高。夏釗[18]的報道也證實超重或肥胖、高血壓、高血脂及高hs-CRP、UA水平可導致CRFs聚集,但該研究對象為中青年HUA患者。值得關注的是,本研究Pearson相關性分析顯示血清UA濃度與BMI、收縮壓、舒張壓、甘油三酯、總膽固醇、hs-CRP、Hcy、ET、NO及CRFs聚集率均有明顯相關性,也進一步證實了MHD患者HUA與CRFs聚集密切相關。何振艷等[19]證實血清UA水平可影響老年患者機體糖脂代謝及炎癥反應程度;張桂玲等[20]證實HUA與糖尿病患者炎癥狀態(血清hs-CRP表達)有關;妥婭等[21]發現血清UA水平與高血壓關聯有統計學意義;以上文獻均從不同角度支撐了本文觀點。由此認為HUA除了與高血壓、炎癥反應、內皮功能紊亂有關外,還與CRFs聚集密切相關,HUA可導致MHD患者心血管并發癥發生風險增加,因此有必要對MHD患者血清UA水平進行密切監測,并定期評估,以便及時防治心血管并發癥。
[參考文獻]
[1] Barkas F,Elisaf M,Liberopoulos E,et al. Uric acid and incident chronic kidney disease in dyslipidemic individuals[J]. Curr Med Res Opin,2017,34(7):1193-1199.
[2] 高尿酸血癥相關疾病診療多學科共識專家組. 中國高尿酸血癥相關疾病診療多學科專家共識[J]. 中華內科雜志,2017,56(3):22.
[3] 田芳,李浩,劉雪梅,等. 維持性血液透析患者血尿酸與冠脈鈣化的相關性研究[J]. 中國中西醫結合腎病雜志,2018,19(4):45-47.
[4] Srivastava A,Kaze AD,Mcmullan CJ,et al. Uric Acid and the Risks of Kidney Failure and Death in Individuals With CKD[J]. Am J Kidney Dis,2017,71(3):362-370.
[5] Santos J,Fonseca I,Malheiro J,et al. End-stage renal disease versus death in a Portuguese cohort of elderly patients:an approach using competing event analysis[J]. J Investig Med,2017,65(7):1041-1048.
[6] 王曉菁,陳海平. 慢性腎臟病定義及分期系統修訂的進展-2012-KDIGO慢性腎臟病臨床管理實踐指南解讀[J]. 中華老年多器官疾病雜志,2014,13(5):396-400.
[7] 中國醫師協會腎臟內科醫師分會. 中國腎臟疾病高尿酸血癥診治的實踐指南(2017版)[J]. 中華醫學雜志,2017,97(25):1927-1936.
[8] 宋健,陳雪,張杰,等. 甘油三酯葡萄糖乘積指數與心血管疾病危險因素聚集關系的研究[J]. 中華疾病控制雜志,2017,21(4):46-58.
[9] 楊軍,繆洪蕓. 維持性血液透析患者血尿酸與動脈鈣化的相關性研究[J]. 國際檢驗醫學雜志,2019,40(3):68-74.
[10] Tsuruta Y,Kikuchi K,Tsuruta Y,et al. Febuxostat improves endothelial function in hemodialysis patients with hyperuricemia:A randomized controlled study[J]. Hemodial Int, 2015,19(4):514-520.
[11] Petreski T,Ekart R,Hojs R,et al. Asymptomatic hyperuricemia and cardiovascular mortality in patients with chronic kidney disease who progress to hemodialysis[J]. Int Urol Nephrol,2019,51(6):1013-1018.
[12] 黎曉磊,孔耀中,肖觀清,等. 中長期血液透析聯合血液灌流對維持性血液透析患者血管內皮功能的影響[J].實用醫學雜志,2017,33(20):3437-3440.
[13] George MG,Tong X,Bowman BA. Prevalence of Cardiovascular Risk Factors and Strokes in Younger Adults[J]. Jama Neurol,2017,74(6):695-703.
[14] 陳佩玲,龔德華,徐斌,等. 維持性血液透析患者心血管鈣化進展的相關影響因素分析[J]. 腎臟病與透析腎移植雜志,2017,26(5):403-417.
[15] 任廣偉,李明明,楊洪娟,等. 非布司他對維持性血液透析伴高尿酸血癥患者血管內皮功能、氧化應激反應的影響及安全性評價[J]. 河北醫藥,2018,40(15):2251-2255.
[16] 馮哲,陳香美. 重視并規范腎臟疾病高尿酸血癥的診治[J]. 中華醫學雜志,2017,97(25):1921-1922.
[17] 姚桂愛,潛麗俊. 舒洛地特軟膠囊對早期糖尿病腎病患者血管內皮功能及微炎癥反應狀態的影響[J]. 中國現代醫生,2018,56(29):36-39.
[18] 夏釗. 中青年人高尿酸血癥與心血管危險因素聚集的相關性研究[D]. 天津醫科大學,2018.
[19] 何振艷,管鳳香. 老年人血尿酸水平與代謝相關因素的關系[J]. 中國老年學雜志,2017,37(14):3478-3479.
[20] 張桂玲,王寧,欒芳,等. 高尿酸血癥與初診2型糖尿病患者hs-CRP和心率變異性的關系及干預研究[J]. 中國急救復蘇與災害醫學雜志,2017,12(6):537-540.
[21] 妥婭,任曉嵐,李國菊,等. 甘肅四縣市部分漢族人群中高尿酸血癥與高血壓的關聯性[J]. 公共衛生與預防醫學,2018,29(1):8-11.
(收稿日期:2019-08-22)

