化工流程題的特點與解題策略
2020-06-08 09:54:37楊志紅
教育周報·教研版
2020年16期
楊志紅
化學工藝流程題是近幾年高考的熱點,它以題材多樣,結構新穎,設問靈活等優點,在高考試卷中頻頻出現,成為近幾年高考試題中的重要組成部分。在復習備考中如何幫助學生突破化學工藝流程題,是我們大家共同研究的課題。
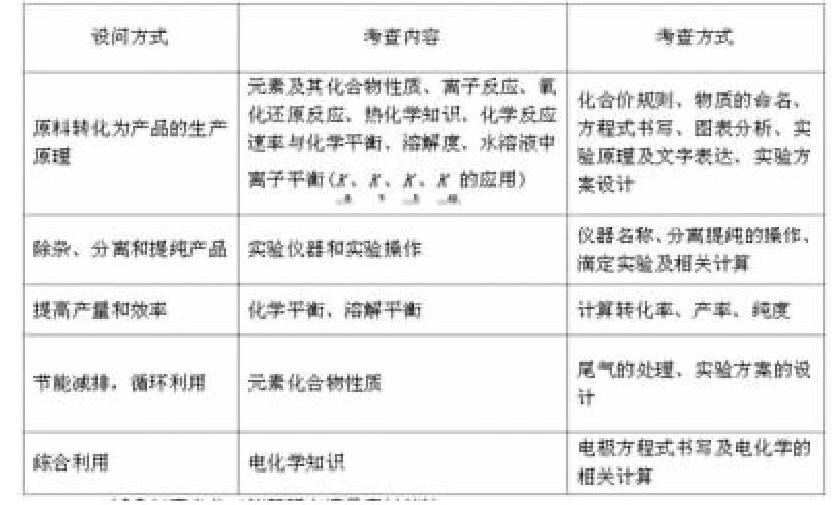
一、近幾年高考化工流程題中考點分析
二、近幾年高考化工流程題中情景素材統計
(1)自然資源開發利用類:鈦鐵礦、鉻鐵礦、軟錳礦、菱鎂礦、鐵硼礦、鋁土礦、磷礦石、白云石、瑩石?、閃鋅礦、硼鎂礦、重晶石
(2)廢棄資源回收利用類:廢鐵屑、廢鋁片、廢釩催化劑、廢玻璃、廢舊鋰離子電池、廢舊鋅錳電池、粉煤灰、銀銅合金廢料
(3)物質的制備和凈化類:水泥、NaClO2、NH3、H2C2O4、Zn 、K2Cr2O7、Na2S2O5
三、近幾年高考化工流程題中高頻化合物統計
(1)原料所含雜質類:SiO2;Al2O3;FexOy;MgO;MnO2;CaO
(2)輔助試劑類:H2O2;KMnO4;K2Cr2O7;H2C2O4、NaBH4;ZnS、FeS、MnS
四、化工流程題的解題策略
(1)明確化工流程題常圍繞以下幾個知識點進行設問:①化學反應速率與平衡理論的運用,反應物顆粒大小:反應速率、原料的利用率等。溫度、反應速率、物質的穩定性、物質的結晶等。?②化學式的判斷。③氧化還原反應化學方程式或離子方程式的書寫。④通過調節溶液的pH達到分離除雜的目的。⑤化學反應的能量變化。⑥化學實驗室的常用儀器的用途和使用方法。⑦化學實驗基本操作:除雜、分離、檢驗、洗滌、干燥等。⑧元素守恒、得失電子守恒等化學觀念。⑨根據物質之間的反應關系進行的簡單計算。⑩“流程”中的物質成分的判斷,物質的轉化和循環,資源的回收和利用。
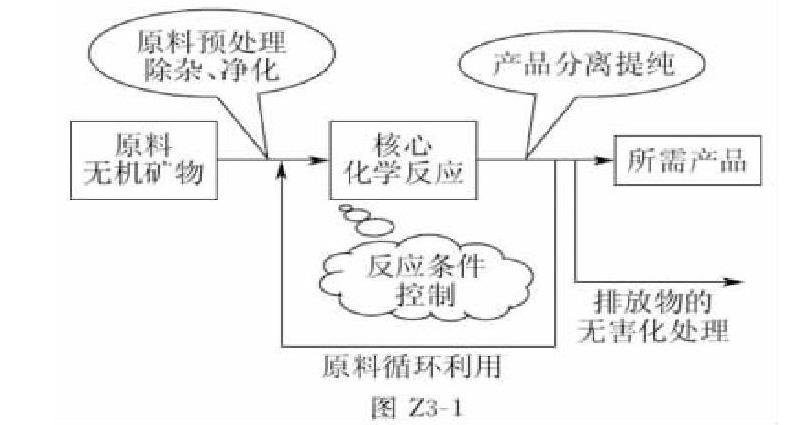
(2)熟悉工業生產流程圖
登錄APP查看全文
猜你喜歡
中學生數理化·自主招生(2024年6期)2024-06-24 11:15:29
中學生數理化(高中版.高考理化)(2022年4期)2022-05-25 13:05:50
求學·理科版(2016年1期)2016-02-29 15:34:46
中國工程咨詢(2014年12期)2014-02-16 06:18:34
船海工程(2013年6期)2013-03-11 18:57:26
棋藝(2001年19期)2001-11-25 19:55:34

