BiVO4/TiO2廣譜光催化劑的合成及光催化性能
王美,李文軍
(1.淮北師范大學,安徽淮北235000;2.北京科技大學,北京100083)
0 引言
半導體光催化氧化技術是一種始于上世紀70年代的深度氧化技術,它能有效地氧化降解許多難降解的有機污染物,達到除毒、去臭、脫色、直至降解為小分子的效果,被廣泛應用于污水處理和環境凈化等領域[1-2]。在眾多半導體材料中,TiO2因具有光催化活性高、化學穩定性強、價廉、無毒等特征,被廣泛使用[3-4]。然而,TiO2的禁帶寬度大(3.2eV),只有波長小于387 nm的紫外光才能激發它產生電子-空穴對,從而引發光催化反應,而這部分光只占太陽光譜的5%左右;另外光生電子-空穴對的復合率高使得光催化效率低[5]。研究表明,復合TiO2與可見光響應型的催化劑,被認為是擴展TiO2光譜范圍和增強電子-空穴對分離的最有效方法之一[6]。Zou等[7]用水熱法合成Ag3VO4/TiO2納米光催化劑,一方面,Ag3VO4粒子附著在TiO2納米棒的表面,比表面積的增大使得復合催化劑表面的活性位數量增加;另一方面,復合材料的光譜發生紅移,可見光區域吸收強度明顯增加,使得更多的光子參與光化學反應;再者兩者之間形成的異質結,促進電子與空穴的有效分離,最終使得光催化活性提高。
在許多可見光催化劑中,單斜相BiVO4被認為是潛在的適合污染物分解和氧化的可見光催化劑[8]。然而,單斜相BiVO4的光催化活性受限于難以遷移的電子-空穴對和低吸附能力[9]。次立杰等[10]制備了BiVO4/SiO2復合材料,通過表征,在BiVO4顆粒表層形成了一層顏色較淡的連續的緊密的海綿狀的SiO2包覆層,復合后的樣品對紫外光及可見光的吸收顯著增強。究其原因:BiVO4作為光敏劑吸收可見光,而BiVO4/SiO2作為阻礙光電子-空穴對快速重組的活動中心,提高電荷的轉移也就提高了光催化效率。無論在可見光下還是在紫外光下,樣品均表現出很好的光催化性能。因此,無論是TiO2還是BiVO4,復合兩種不同禁帶寬度的半導體均可增強光譜范圍,同時有利于光生電子空穴對的分離,提高光催化活性。
基于以上結論,本文采用簡便的低溫溶膠-凝膠法復合TiO2和BiVO4,通過控制BiVO4的加入量,合成出BiVO4質量分數不同的BiVO4/TiO2復合物;模擬太陽光降解亞甲基藍,研究復合材料的光催化活性;利用X射線衍射、比表面積、紫外-可見漫反射光譜和熒光發射光譜對樣品進行表征。
1 實驗部分
1.1 主要試劑與儀器
硝酸鉍、偏釩酸銨、無水乙醇、鈦酸丁酯、氫氧化鈉、硝酸、氨水,均為分析純;文中用水均為去離子水。
Rigaku-Dmax RB型旋轉陽極X射線衍射儀進行樣品的物相分析;LEICA-S440i型掃描電鏡進行樣品的形貌分析;TU-1901型紫外可見光譜儀計量樣品的漫反射光譜;HITACHI F-4500熒光光譜儀測量樣品的發射光譜。
1.2 光催化劑制備
1.2.1 BiVO4的制備
采用改進的水熱工藝制備BiVO4[11]:將0.292g的NH4VO3溶解在由5mL的NaOH(2mol/L)和10mL的NH3·H2O(2mol/L)組成的溶液中,攪拌得A;同時將1.213g的Bi(NO3)3·5H2O溶解在5mL的HNO3(4mol/L)溶液中,攪拌均勻得B,攪拌的情況下將A緩慢滴加到B中,用NaOH溶液調節pH值為6。將混合物轉移到容量為50mL具有聚四氟乙烯內襯的不銹鋼水熱釜中,用乙醇控制液體體積為容器體積的80%。密封,于160°C下反應10h。等反應釜自然冷卻后,除去上層液體、抽濾,再用去離子水和無水乙醇洗滌幾次,在干燥箱內80°C干燥10h后得鮮黃色BiVO4。
1.2.2 BiVO4/TiO2系列復合材料制備
低溫溶膠凝膠法制備BiVO4/TiO2系列復合物:首先,在冰水浴上,用硝酸和去離子水配置pH<2的溶液100mL,攪拌30min待用。量取4.0mL鈦酸正丁酯緩慢滴入8.0mL乙醇溶液中,劇烈攪拌30min,得溶液A;量取上述配置的硝酸溶液48mL加入不同質量的BiVO4,攪拌均勻得B;攪拌下,將A緩慢滴入B中,攪拌超聲各30min后,放入30°C恒溫箱內靜置陳化2天,再攪拌超聲30min,于80°C的鼓風干燥箱中烘干、研磨。于500°C的馬弗爐中煅燒3h,制備出摻雜BiVO4量為10%、30%和40%的復合物,分別記為10BT、30BT和40BT。
1.3 光催化活性測試
常溫下,通過對亞甲基藍(MB)的降解來考察制備樣品的光催化性能。由于白熾燈的發光光譜比較接近太陽光譜,因此以100W的白熾燈為光源。將30mL濃度為10mg·L-1的MB溶液置于100mL的小燒杯中,加入0.06g制備好的樣品,暗光攪拌1h使樣品達到吸附脫附平衡。將小燒杯放在距離光源10cm的地方將樣品置于光照下,每1h取上清液3mL置于高速磁力離心機(4800rpm)上離心15min,除去上層催化劑顆粒,以722型分光光度計λ=664nm處檢測MB的吸光度。樣品的可見光催化效率可以用溶液中剩余MB的百分率來考察。在低濃度范圍內,吸光度與濃度有良好的線性對應關系,且遵守朗伯-比爾定律,因此由吸光度的變化可監測溶液中MB的濃度。MB濃度(C)與初始濃度(C0)的比值可以用吸光度(A)與初始MB的吸光度(A0)的比值來表示,因此MB的降解率D可表示為:

2 結果和討論
2.1 X射線衍射分析
圖1 為 制備 的BiVO4、TiO2和BT系列 的XRD圖。由圖可見,無論是純BiVO4還是BT復合物中的BiVO4,與BiVO4的標準卡(JCPDS No.14-0688)相吻合,均屬于單斜白鎢礦型。純TiO2在2θ=25.60°和2θ=27.44°均出現衍射峰,說明TiO2是銳鈦礦型和金紅石型兩種晶型的結合。對于BT復合物,TiO2為銳鈦礦型(JCPDS No.21-1272)。當BiVO4的摻雜量小于10%時,BT系列中沒有BiVO4衍射峰的存在,由于BiVO4的量少,結晶差,所以XRD沒有峰;當BiVO4質量分數為30%時,峰型更尖銳,說明30BT有更高的結晶度,可以提供更多的活性點來抑制電子-空穴對的結合,呈現更好的光催化活性[7]。

圖1 TiO2、BiVO4和BT系列樣品XRD譜圖
2.2 形貌分析
以掃描電子顯微鏡對TiO2、BiVO4、10BT和30BT的形貌進行表征,如圖2所示。TiO2是無規則的塊狀顆粒,BiVO4是團聚比較明顯的薄片。當BiVO4的摻雜量為10%時,TiO2的形貌發生了很大的變化,但是BiVO4與TiO2并沒有很好地結合,團聚現象明顯,由此可知其催化活性一般。當BiVO4的摻雜量為30%時,團聚現象有所改善,粒徑在400-600nm左右,形貌也越來越規整。這說明BiVO4的加入使得TiO2在形貌上得到很大的改善。

圖2 (a)TiO2、(b)BiVO4、(c)10BT和(d)30BT的掃描照片
2.3 紫外可見漫反射光譜分析
圖3 是BiVO4、TiO2和BT系列的紫外可見漫反射圖譜。經分析可知,TiO2吸收邊落在413nm,主要位于紫外光區,BiVO4吸收邊落在517nm,位于可見光 區;而10BT、30BT和40BT分 別 位 于611nm、620nm和617nm,均位于可見光區;在480nm之前是兩種復合物吸收的疊加,而在可見光480-800nm范圍內卻有更強的光譜吸收,并且隨著BiVO4量的增加,BT吸收強度增強,當BiVO4的質量分數為30%時,光譜吸收范圍最廣。可見光波長范圍的吸收,可能由于BiVO4與TiO2界面間的相互誘導作用。有關半導體與TiO2之間耦合的相似現象也有報道[12]。
對于半導體光催化劑,禁帶寬度用Eg=1240/λg來計算:其中λg表示漫反射邊延長線與橫軸交點處的波長(單位:nm)。經計算,TiO2、BiVO4、10BT、30BT和40BT禁 帶 寬 度 分 別 為3.00eV、2.40eV、2.03eV、2.00eV和2.01eV。由此表明,30BT禁帶寬度最小,在同樣的光照下對太陽光的吸收光譜范圍最廣,提高了樣品的光利用率,這有利于激發產生更多的活性物種,為光催化分解污染物提供了先決條件,這也與樣品的光催化活性一致[13]。
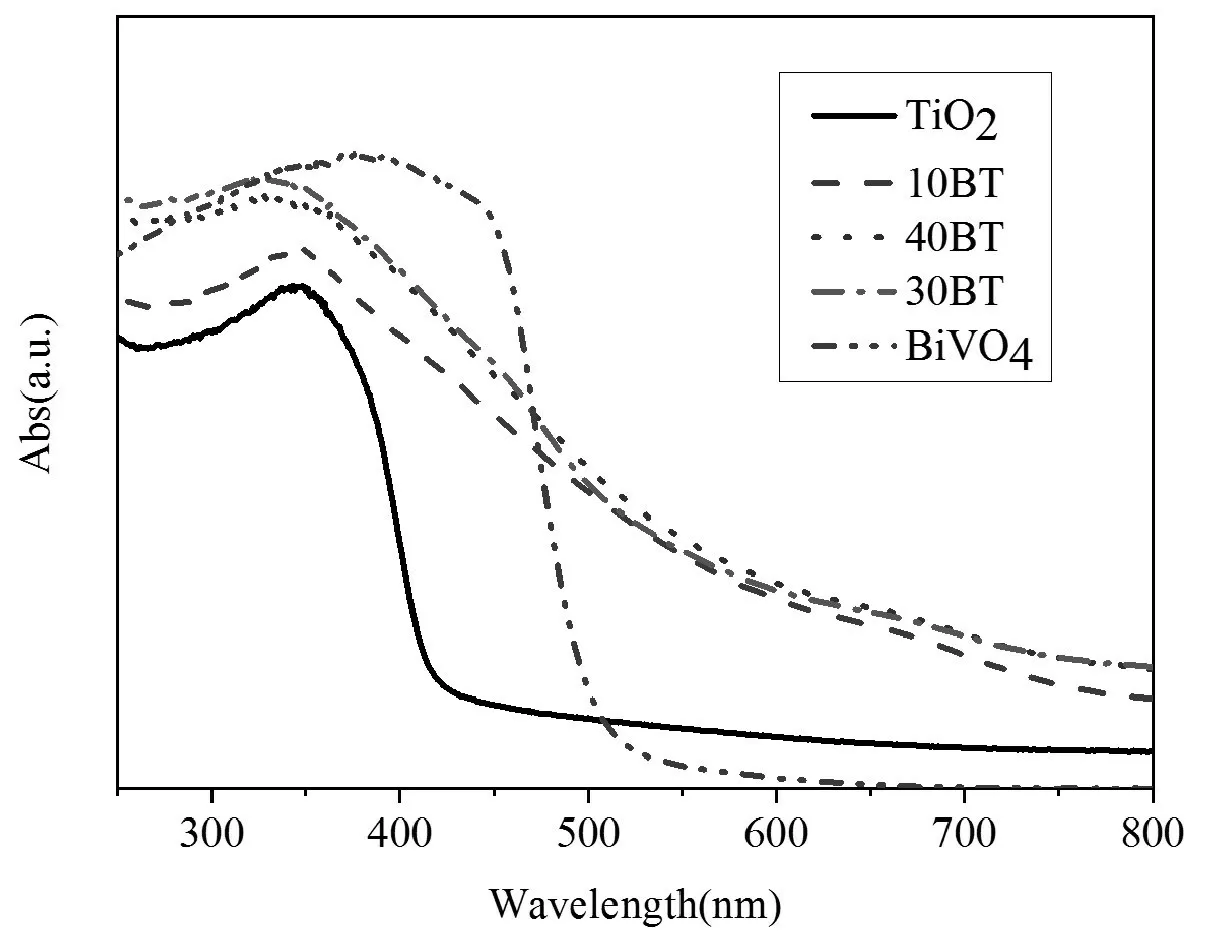
圖3 BiVO4、TiO2和BT系列催化劑的紫外可見光漫反射光譜
2.4 比表面積
比表面積大可以提供更多的活性點,吸附更多的降解物從而更快地降解污染物。測得TiO2、BiVO4和BT系列的比表面積如表1所示。由表1可知,TiO2比表面積大,從而有利于更好地吸附,當摻雜BiVO4后,隨著BiVO4的增加,BT系列的比表面積越來越小,當達到30%時,比表面積不再下降,說明此時兩者達到最好的結合;對于40BT,由于BiVO4的量比較大,多余的BiVO4在TiO2周圍分散開來,得不到充分結合,反而使得40BT的比表面積比30BT要大。但是30BT的吸附性能并沒有因為比表面積的減小而降低,這說明TiO2和BiVO4的復合有利于降解物的選擇性吸附。

表1 BiVO4、TiO2和BT系列的比表面積(BET)
2.5 熒光發射光譜分析
熒光光致發光光譜經常被用來揭示半導體中電荷的捕獲、遷移和轉移的效率,以及理解e-/h+對的命運[6,14]。圖4展示了BiVO4、TiO2和BT系列的光致發光光譜。對于BT系列,隨著BiVO4量的增加,光致發光光譜的強度明顯降低,這是由于BiVO4與TiO2形成異質結相互作用的結果。40BT的光譜強度和30BT基本相同,只是稍有上升,這與前面禁帶寬度的計算相吻合,這說明過多的BiVO4反而成為電子-空穴分離的障礙。由此推斷30BT的e-/h+對的結合率最低,光催化活性最好。

圖4 BiVO4、TiO2和BT系列的光致發光光譜
2.6 光催化活性檢測
圖5 為空白樣、TiO2、BiVO4和BT系類在4h內對濃度為10mg/L的MB的光催化降解曲線。暗反應之后,MB和催化劑之間達到吸附平衡,此時的吸光度測定表明BiVO4、TiO2、10BT、30BT和40BT溶液中的MB百分含量分別為88.0%、81.5%、71.8%、65.9%和73.2%。即吸附MB的量從大到小排序為30BT>10BT>40BT>TiO2>BiVO4。由此可以看出,30BT雖然比表面積小,但是吸附性能卻很好。4h之后MB直接光降解大約8%,說明MB的自降解很慢[15]。BiVO4、TiO2、10BT、30BT和40BT的 光 催 化 降 解 分 別 為60.2%、59.5%、72.4%、94%和73%,說明30BT光催化活性最好,可能因為此時TiO2與BiVO4之間的結合最好,形成的p-n結最多,增強了電子空穴的分離效率;同時30BT禁帶寬度最小,光譜范圍的擴展提高太陽能利用率,因此,光催化活性最好。
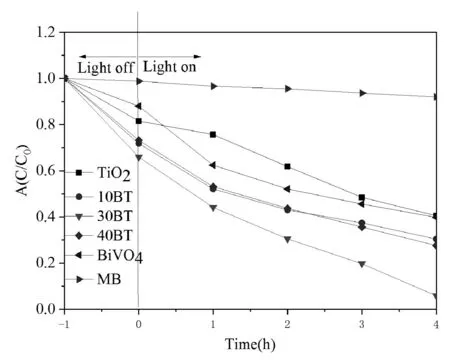
圖5 空白樣、TiO2、BiVO4和BT系類在4h內對MB的光催化降解曲線
2.7 機理推斷
耦合兩種帶有不同氧化還原能的半導體,光激發電子躍遷和遷移導致電子和空穴在不同半導體上累積,實現電子與空穴的分離,是目前改變電子-空穴對復合的最有效方法之一[16]。從實驗結果推斷30BT光降解MB的可能的機理,如圖6。在光的照射下,由于BiVO4和TiO2的能帶呈交錯式排列,電子從BiVO4的導帶遷移到TiO2的導帶上,被復合物表面吸附的O2捕獲形成·O2-;而空穴從TiO2的價帶遷移到BiVO4的價帶上,與OH-或者H2O反應形成表面·OH,最終實現了光生電子-空穴對在空間上的分離。在TiO2的表面,電子被O2快速捕獲,避免了電子在其表面聚集,也增強了·O2-(Eq.(1))的形成[17];另一方面,由BiVO4和TiO2產成的空穴與OH-或者H2O反應形成表面·OH(Eqs.(2)和(3)),此·OH就是降解MB最重要的物質(Eq.(4))。除此之外,MB的自降解亦不可忽略。

基于上面的數據分析,由于界面相互作用,激發的電子很容易轉移到TiO2的表面,這些電子被表面的O2快速捕獲形成O2-,避免了電子在TiO2的表面積累;而空穴則轉移到BiVO4的價帶上,與OH-或者H2O反應形成表面·OH,從而實現光生電子-空穴的分離。因此,30BT光催化活性的增強是由于光譜吸收的擴展、光生電子-空穴對復合的下降、MB的自降解三者共同作用的結果。

圖6 30BT降解MB的光催化機理
2.8 循環測試
一種好的光催化劑,除了具有光催化活性、穩定性高、易分離等特性外,可循環利用也是一個要點。圖7展示了在不變的條件下降解MB的5個循環過程。前三次測試中,由于生成了一些中間產物吸附在催化劑的表面,催化活性略有下降。經過分離、干燥,再兩次測試表明:光催化降解與第一次相似。循環測試表明復合物催化劑在光催化反應過程中是穩定的。另外,我們發現,在每次光催化反應完成后,這些催化劑都可以很好地分離。由此推斷,這個新的復合催化劑將會在污水的凈化過程中得到很好的應用。

圖7 30BT對MB的循環光催化降解曲線
3 結論
采用低溫溶膠凝膠法,合成了BiVO4/TiO2系列復合物。X射線衍射表明,30BT比40BT展示了更高的峰值強度,表明30BT將提供更多的活性位點;紫外可見漫反射光譜顯示,BT系列在480nm之前是兩種復合物光譜的疊加,而在480-800nm有很強的吸收強度,當BiVO4質量分數為30%時,禁帶寬度最小,光譜利用率最高;隨著BiVO4量的增加,BT系列的光致發光光譜的吸收強度降低,而30BT的光譜強度最低,表明30BT中e-/h+對的結合率最低。光催化降解亞甲基藍的結果顯示,30BT顯示最好的光催化活性,由于此時兩者結合最緊密,形成的異質結最多,加速了電子空穴對的分離;同時30BT禁帶寬度最小,太陽能光譜的利用率最高,光催化活性最好。

