蔬菜半固態發酵的探究
燕平梅,魏愛麗
(1.太原師范學院 生物系,太原 030619;2.土壤消毒活化綠色產業技術創新戰略聯盟,太原 030619)
蔬菜發酵是利用微生物的活動貯存和加工蔬菜的一種方法。蔬菜發酵的主要發酵產品有泡菜、酸菜、醬菜和腌菜等,以白菜、蘿卜、黃瓜、甘藍、甜椒等新鮮蔬菜為原料,添加一定濃度食鹽、水和輔料,利用蔬菜自身附著的微生物于厭氧條件下進行乳酸發酵。蔬菜發酵有利于對蔬菜營養成分和色、香、味的保持。在發酵過程中乳酸菌是整個發酵過程的優勢微生物。由于乳酸菌不具備分解纖維素的酶和水解蛋白質的酶系統。因此,乳酸菌發酵不破壞植物細胞組織,也不分解蛋白質和氨基酸,并且能產生大量乳酸,起到防止蔬菜腐爛的作用,又可以改善發酵蔬菜產品的風味。泡菜的美味爽口和豐富的營養享譽全球,其中不僅含有VA、VB1、VB2、Vc、Ca、P、Fe、胡蘿卜素、辣椒素、纖維素和蛋白質等多種豐富的營養成分,還具有解膩開胃、促消化、增進食欲的功效[1]。除此之外,泡菜中還含有乳酸、膽堿、乙酰膽堿及人體生理代謝必不可少的各種酶等,在人體保健及預防疾病等方面發揮著重要的作用,研究證實經常食用可以起到抗菌、凈腸、減肥、抗衰老[2]、預防動脈硬化[3]、降低膽固醇和調節人體生理功能等作用[4]。
泡菜因其良好的口感和保健功能頗受人們的喜歡,然而美中不足的是蔬菜的硝酸鹽含量較高,亞硝酸鹽是一種毒性很強的致癌物,與人體中蛋白質中的胺結合生成亞硝胺,對人體有致癌作用。
因此,對發酵蔬菜加工工藝的研究越來越重要。目前國內外學者多以發酵蔬菜中的微生物種類和數量、生產方式的改良以及發酵蔬菜的各項生理生化指標等研究為主。Pederson首先提出腸膜明串珠菌啟動蔬菜乳酸發酵的過程,指出異型發酵的產品質量要優于同型發酵[5]。Petaja證實應采用乳桿菌或混合菌種接種[6]。趙學惠對泡菜發酵過程中化學變少和微生物學性狀進行了比較深入的研究[7]。張蓄比較自然發酵、人工發酵、自然發酵與人工發酵相結合3種方法對泡菜品質的影響,發現自然發酵與人工發酵相結合的方法最好[8]。周文斌在測定亞硝酸鹽的國標方法的基礎上,通過試驗尋找出測定泡菜中亞硝酸鹽含量的較佳方法[9]。前人研究了自然發酵和人工接種發酵對甘藍類泡菜品質及亞硝酸鹽含量的影響[10]。 但到目前為止人們對半固態發酵蔬菜輔料的探究報道很少。本試驗旨在以兩種輔料處理蔬菜,置于相同條件下發酵,測定兩者的各項生理生化指標,比較兩種輔料對發酵蔬菜各指標的影響,以探究適用于半固態發酵蔬菜的輔料,對尋求半固態蔬菜發酵輔料有重要意義。
1 材料與方法
1.1 試驗材料
甘藍。
1.2 主要儀器設備
HRHS24型電熱恒溫水浴鍋、HJ-1型磁力加熱攪拌器、LR-30型立式電熱壓力蒸汽滅菌鍋、SW-CJ-2F型雙人雙面凈化工作臺、HRHH-150SC型恒溫培養箱、ES-C200H型電子天平、WFJ-2100型紫外分光光度計、HI 211型pH指示計。
1.3 試驗方法
1.3.1 制備發酵蔬菜
準確稱取8份干凈的白菜各100 g,將其中4份直接均勻涂上發酵輔料1:10%(W/W)的番茄醬、10%(W/W)的葡萄糖、20%(W/W)的蝦醬、6%(W/W)的食鹽,置于一次性的密封干凈塑料袋中發酵,并標記為輔1。
取另4份白菜直接均勻涂上發酵輔料2:10%(W/W)的番茄醬、10%(W/W)的葡萄糖、20%(W/W)的蝦醬、6%(W/W)的食鹽、30%(W/W)的淀粉糊,同樣條件下置于一次性的密封干凈塑料袋中發酵,并標記為輔2。在發酵第1~4周測定輔1和輔2的亞硝酸鹽含量、食鹽濃度指標、pH值、乳酸菌數量、腸桿菌數量并分別對其進行感官評價。
1.3.2 理化指標的測定
1.3.2.1 泡菜中亞硝酸鹽的測定
亞硝酸鹽含量根據國家標準GB 5009.33-2016方法進行測定。
1.3.2.2 pH和食鹽濃度的測定
從發酵蔬菜中取其發酵液,用pH計測其pH。以鉻酸鉀為指示液(5%),采用硝酸銀標準液(0.10 mol/L)滴定方法求得食鹽濃度。
1.3.2.3 乳酸菌的計數
乳酸菌的計數用MRS培養基。以適宜的稀釋度涂布泡菜鹵于MRS和加入1.5%的瓊脂平板上,在37 ℃培養箱中培養48 h。
1.3.2.4 腸桿菌的計數
腸桿菌的計數用于37 ℃厭氧培養24 h的結晶紫中性紅膽鹽瓊脂(VRBDA)平板。
1.3.2.5 感官評價
對發酵蔬菜樣品進行評審,由10人組成評審小組從口感、風味、色澤等方面進行綜合打分,計算各項的平均值。感官評分標準見表 1。

表1 感官評分標準
1.3.3 統計分析方法
采用Excel對試驗數據進行處理,應 用SPSS 10.0統計軟件分析不同輔料對泡菜各個生理生化指標影響之間的差異。差異顯著水平用P<0.05表示。
2 結果與分析
2.1 泡菜中亞硝酸鹽含量的變化
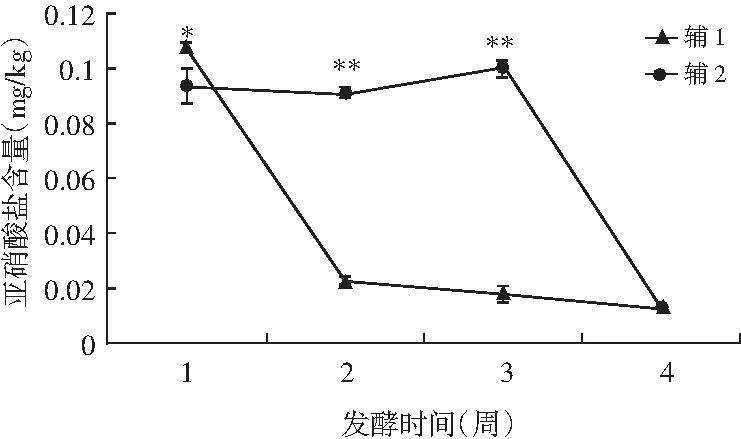
圖1 在發酵過程中添加輔1和輔2發酵甘藍亞硝酸鹽含量變化
由圖1可知,用輔1發酵甘藍的亞硝酸鹽第1周最多,為0.108 mg/kg,之后亞硝酸鹽的含量逐漸減小,其中第1~2周下降幅度明顯。輔2在發酵過程中,在發酵第2周亞硝酸鹽含量減少,但隨后第3周亞硝酸鹽含量上升,達到最大值0.100 mg/kg,之后亞硝酸鹽含量明顯下降。比較同一發酵時間輔1和輔2的亞硝酸鹽含量,發現發酵初期輔1所含的亞硝酸鹽大于輔2,而在發酵中期和后期輔1所含的亞硝酸鹽含量小于輔2。對兩者進行方差分析,輔1和輔2之間在發酵的第1周差異顯著(p<0.05),第2~3周差異極顯著(p<0.01),第4周差異不顯著(p>0.05)。輔1和輔2亞硝酸鹽含量均符合我國食品衛生標準提出的醬腌菜亞硝酸鹽含量小于20 mg/kg的標準。
2.2 泡菜中食鹽濃度的變化
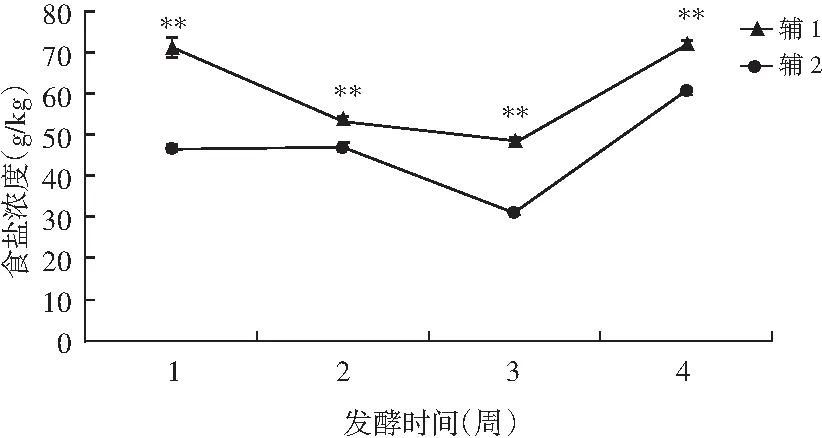
圖2 在發酵過程中添加輔1和輔2發酵甘藍食鹽濃度的變化
由圖2可知,輔1在發酵前期和中期食鹽濃度下降,且前期下降速度大于中期,在發酵后期食鹽濃度顯著上升。輔2在發酵前期食鹽濃度無明顯變化,中期食鹽濃度開始下降,第3周食鹽濃度最低,約為30.93 g/kg,發酵后期食鹽濃度明顯增大。比較同一發酵時間輔1和輔2的食鹽濃度,發現在發酵的整個過程中輔2所含的食鹽濃度一直小于輔1,且對兩者進行方差分析發現兩者差異極顯著(p<0.01)。發酵蔬菜常采用低鹽發酵,在發酵前期和中期食鹽濃度處于下降狀態,有利于蔬菜發酵的進行。發酵后期鹽濃度升高,不利于蔬菜發酵的進行,且為其他菌的繁殖提供了適宜條件。
2.3 泡菜pH值的變化

圖3 在發酵過程中添加輔1和輔2發酵甘藍pH的變化
由圖3可知,輔1和輔2在發酵過程中pH逐漸減小,其中輔1的pH在發酵1周后開始下降,發酵第3周有小幅度上升,隨后繼續下降。輔2的pH在發酵1周后也開始下降,但下降幅度小于輔1,且輔2從第2周開始pH一直小于輔1。對同一發酵時間輔1和輔2的pH進行方差分析,發現輔1和輔2在發酵過程中第1周差異極顯著(p<0.01),第3周pH差異顯著(p<0.05),發酵第2周和第4周差異不顯著(p>0.05)。
2.4 泡菜中乳酸菌數的變化

圖4 發酵過程中添加輔1和輔2發酵甘藍乳酸菌數的變化
由圖4可知,發酵第1周輔1中的乳酸菌數小于輔2,在發酵1~3周輔1中的乳酸菌數緩慢上升,第3周乳酸菌的對數達到最大值約6.76 log CFU/g,第3~4周輔1的乳酸菌數開始下降;發酵1周后輔2中的乳酸菌數開始大幅度上升,在第3周乳酸菌數最多,其對數達到7.57 log CFU/g,且發酵前3周輔2的乳酸菌數一直大于輔1。第3周乳酸菌數開始下降且下降幅度大于輔1,第4周的乳酸菌數少于輔1。對同一發酵時間輔1和輔2的乳酸菌數進行方差分析,結果顯示輔1和輔2除在發酵第1周差異不顯著(p>0.05)外,在發酵第2,3,4周差異顯著(p<0.05)。
2.5 泡菜中腸桿菌數的變化

圖5 發酵過程中添加輔1和輔2發酵甘藍腸桿菌數的變化
由圖5可知,輔1在發酵前期腸桿菌數的對數由0 log CFU/mL增至2.68 log CFU/mL,達到第一個高峰,發酵中期腸桿菌數量下降,在發酵第3周降至1.9 log CFU/mL左右,發酵后期腸桿菌數量顯著增加,增至2.8 log CFU/mL;在發酵初期,輔2的腸桿菌數對數由1.93 log CFU/mL緩慢增至2.12 log CFU/mL左右,在發酵中期和后期腸桿菌數無較大變化。對同一發酵時間輔1和輔2的腸桿菌數進行方差分析,發現除發酵第3周兩者的腸桿菌數量差異不顯著(p>0.05)外,在發酵第1,2,4周均差異極顯著(p<0.01)。
2.6 泡菜的感官評價

表2 感官評分表
在發酵第1周,輔1和輔2均風味一般、酸度適中、較脆,輔1味道不如輔2,但兩者在第1周差異不顯著(p>0.05);第2周輔1風味一般、酸味較濃、較脆而輔2風味比輔1好,酸度適中、很脆,且兩者在第2周差異顯著(p<0.05);第3周輔1風味一般、酸味偏高、較脆,與第2周相比味道較好,輔2在第3周風味較好、酸味較濃、很脆,略好于第2周,在第3周輔2的味道依舊優于輔1,對兩者進行方差分析,輔1和輔2在第3周差異顯著(p<0.05);第4周輔1的風味一般、在酸度偏高、較脆,和第3周差不多,在第4周兩者差異顯著(p<0.05),輔2的味道不如輔1好。這可能是由于在發酵后期乳酸菌產生的酸過多積累,導致輔2過酸,使得輔2在第4周味道不好。輔2在發酵第2,3周味道較好,適宜食用。
3 討論
輔料的使用是蔬菜半固態發酵的關鍵因素,本試驗通過對輔1和輔2進行亞硝酸鹽含量、食鹽濃度指標、pH值、乳酸菌數量、腸桿菌數量及其感官評價的比較分析發現,在發酵過程中,輔1的亞硝酸鹽含量低于輔2,但是輔1和輔2均符合食品衛生標準提出的醬腌菜亞硝酸鹽含量小于20 mg/kg的標準。在發酵過程中,輔1和輔2都在第3周乳酸菌數的對數達到最大。在發酵的第2~4周輔2的乳酸菌數顯著大于輔1,可知輔2的發酵作用更強。輔2的pH在發酵的第1,3周顯著低于輔1。輔2的腸桿菌數變化幅度較大,在發酵第2,4周顯著大于輔1。在發酵過程中,乳酸菌大量產酸,使得發酵體系的pH值減小,對其他一些菌如腸桿菌等產生了抑制作用[11-13],在發酵前期和中期乳酸菌成為優勢菌種,使得乳酸菌數量劇增[14]。在發酵后期乳酸菌數量減少,并由以上的分析得知發酵后期食鹽濃度上升,這可能是其他一些菌增殖,改變了發酵體系的環境,對乳酸菌形成了抑制作用所致。
發酵前期因適宜的pH、良好的營養條件和乳酸菌對腸桿菌無抑制作用,使腸桿菌數量增加,發酵中期乳酸菌大量產酸,pH值下降,發酵體系環境的變化不再適應腸桿菌的生存,使得腸桿菌數迅速下降,而輔1在發酵后期數量又劇增,從上面的乳酸菌數量也減少可推測可能是由于一些菌的增殖所致,這些菌抑制了乳酸菌生長,使乳酸菌數量減少,造成發酵體系中積累的酸減少,從而除了對腸桿菌的抑制作用外,使得腸桿菌數量增加。

