原電池工作原理的探究性教學實踐*
管凌云 張婷

摘要: 介紹以原電池工作原理為問題情景進行探究性教學的過程。教學中模擬歷史上記載的一些曾經發生的電池案例問題,引導學生利用假設、推理、實驗驗證等問題解決方式進行探究學習,而后呈現化學史知識,讓學生體驗科學發展的過程和規律,在探索中提升學生的創造性思維,促進化學學科核心素養的發展。
關鍵詞: 原電池原理; 探究性學習; 實驗探究; 化學史
文章編號: 1005-6629(2021)02-0038-05
中圖分類號: G633.8
文獻標識碼: B
1? 教學背景
“原電池的工作原理”是蘇教版選修4《化學反應原理》專題一“化學能與電能的轉化”第一節的內容。學生在必修模塊的學習中已經認識了銅鋅原電池的工作原理和形成條件,本節課在必修的基礎上重點介紹雙液原電池模型,進一步了解化學電源的工作原理,幫助學生認識電池的重要意義。
《普通高中化學課程標準(2017年版)》提出,教學中應創設真實情境,組織學生開展基于能量利用需求選擇反應、設計裝置等活動,提升科學探究與創新意識等化學學科核心素養。真實、具體的問題情境是學生化學核心素養形成和發展的重要平臺,為學生化學學科核心素養提供了真實的表現機會。因此,教師在教學中應重視創設真實且富有價值的問題情境,促進學生化學學科核心素養的形成和發展[1]。
探究性學習是指學生通過自主地參與獲得知識的過程,加深對知識的體驗,掌握研究自然所必須的探究能力,同時,形成認識自然的基礎——科學概念,進而培養探索未知世界的積極態度。教師可在教學過程中創設類似科學研究的真實問題情境,引導學生主動參
與、積極思考與探索,最終解決問題。在歷史的回顧中發現,在偶然性中蘊含著必然的規律,學生的認知發展規律與科學發展脈絡有很多相似性。因此,在探究性學習過程中,將化學史融入化學教學中,讓學生體會科學家們的探究歷程,一步步獲得新知識,幫助學生從已有認知水平發展到更高級的認知水平。高二學生對電壓、電容、電流強度、電阻、供電效率等內容已有初步了解,為探究電池性能提供了必需的知識儲備。
本文以“原電池的工作原理”的教學過程為例,談談如何利用真實的問題情境進行探究性學習。
2? 教學流程
2.1? 真實的電池應用問題,引起學生對探究的好奇和興趣
[教師]汽車是我們生活中重要的出行工具,但是隨著環境的污染和石油資源的緊張,傳統燃油車的弊端已逐步顯現。面對環境和資源的壓力,全球許多國家已經給出了禁售燃油車的時間表。種種跡象表明,燃油車將退出歷史舞臺,取而代之的將是電動汽車等新能源交通工具。因此,化學工作者們在提高電池性能、增大能量轉化效率方面,必將大有作為。電池的基本原理在同學們高一的時候已經學習過了,今天這堂課我們還將進一步深入學習。
設計意圖: 本環節能讓學生意識到電池在現實生產生活中的重要性,引起學生對本節課學習內容的好奇和興趣,激發學生的探究欲望。
2.2? 真實的電池效率問題,在探究中推動學生的創造性思維
[問題提出]我們已經知道,可以將一個自發進行的氧化還原反應通過原電池裝置,把化學能轉化為電能,現在請大家把Zn+H2SO4ZnSO4+H2↑設計成原電池,并分析其工作原理。
[學生]上講臺畫裝置圖并說明工作原理。
[教師]這樣的電池是否實用呢?你認為電池可以成為實用電池,電池性能方面需要滿足哪些要求?
[學生]穩定的電流、滿足用電器電壓要求、電容要大(用的時間要長)、能量轉化效率要高(如電池不用的時候不能漏電)。
[教師]我們通過實驗檢測一下這種原電池的電流是否穩定?通過一些實驗現象,判斷這個原電池的供電效率怎么樣?
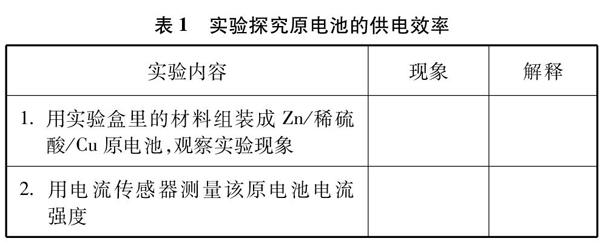
[學生實驗1]見表1。
1. 用實驗盒里的材料組裝成Zn/稀硫酸/Cu原電池,觀察實驗現象
2. 用電流傳感器測量該原電池電流強度
學生4人一小組進行實驗,討論后進行匯報,教師補充。
[小結](1)觀察到鋅片的表面產生大量氣泡,這是負極鋅與硫酸直接發生反應,而且鋅也會含有雜質,和硫酸形成微小原電池,自放電很嚴重,導致供電效率低。
(2)組裝成的原電池中電流不穩,數值逐漸下降(見圖1)。由于在銅極上聚集了許多氣泡,把銅電極跟稀硫酸逐漸隔開,這樣就增加了電池的內阻,使電流不能暢通。(其他導致電阻增大的原因暫不討論)
[教師]如何解決銅鋅原電池存在電流不穩定、供電效率低的問題呢?請同學們先獨立思考2分鐘,再進行小組討論3分鐘,改進原電池裝置并畫出裝置圖。
[學生1]首先,避免氧化劑和還原劑直接接觸,另外可以改用硫酸銅溶液,以減少氫氣的產生。我們把原電池發生的兩個半反應分別在兩池中進行,一個池中放有銅電極、硫酸銅溶液,實現半反應: Cu2++2e-Cu;另一個池中放有鋅電極、電解質溶液(不與鋅反應),實現半反應: Zn-2e-Zn2+。
[教師]如何構成一個完整的回路?
[學生2]用導線連接或者電解質溶液連接(電解質溶液由于具有流動性,可以想辦法固定,例如用濾紙浸泡電解質溶液)兩種方法。
[教師]是否可行呢?要用實驗來檢驗。
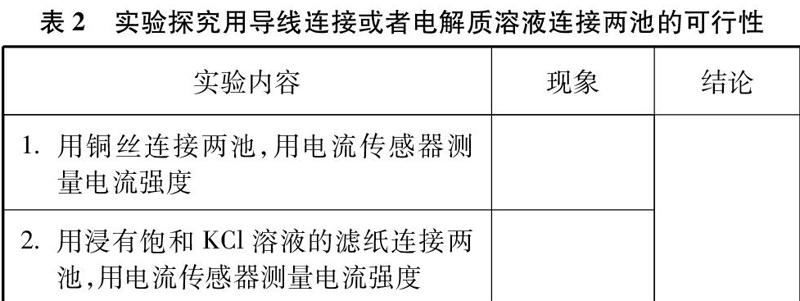
[學生實驗2]實驗用品: 飽和KCl溶液、銅電極、鋅電極、硫酸銅溶液、硫酸鋅溶液、濾紙、銅絲,用電流傳感器測量兩種連接兩池的方法是否有電流,見表2。
實驗內容現象結論
1. 用銅絲連接兩池,用電流傳感器測量電流強度
2. 用浸有飽和KCl溶液的濾紙連接兩池,用電流傳感器測量電流強度
學生4人一小組進行實驗,討論可行性后進行匯報。
[小結]銅絲連接的辦法能形成通路,但銅絲會成為電極,“電極/溶液”界面上有電子得到或失去的反應,整套裝置四個電極都有反應,工作原理改變,不屬于裝置改進研究范疇。浸有飽和氯化鉀溶液的濾紙可以形成通路,但濾紙不夠牢固,易破損。
[教師展示]鹽橋實物。
[教師]用瓊脂(一種凝固劑)可以把飽和氯化鉀溶液凝固在“U”型管中,離子可以在其中遷移,這種裝置被人們形象地稱為鹽橋。導電效果怎么樣呢?要用實驗來檢驗。
[教師演示實驗1]組裝電池裝置(見圖2),用電流傳感器測量該原電池電流(見圖3)。
[小結]實驗結果表明,使用鹽橋后,既能克服自放電的問題,又使得電流穩定。
[學生任務]分析使用鹽橋裝置的原電池的工作原理:
(1) 寫出電極方程式。
(2) 鹽橋中的離子會怎樣運動,會不會進入兩池溶液?
(3) 鹽橋能像金屬導線那樣長期使用嗎?
(4) 鹽橋中的電解質可不可以換成別的?如果可以換,電解質要滿足什么要求?
[學生匯報]
(1) 使用鹽橋裝置的原電池的電極反應與單液原電池相同。
(2) 負極隨著Zn-2e-Zn2+,溶液中陽離子過剩,氯離子進入,才可電荷平衡;正極隨著Cu2++2e-Cu,溶液中陽離子減少,陰離子過剩,鉀離子進入,才可電荷平衡。所以氯離子應向負極遷移,鉀離子應向正極遷移,鹽橋中的離子會進入兩池。
(3) 使用一段時間會失效,需重新放入濃溶液中浸泡。
(4) 能,電解質要滿足的要求是不與電池中的溶液發生反應。(教師可讓學生補充了解其他要求,如高濃度、陰陽離子遷移速率接近、不與電池中的溶液發生反應等。常用飽和氯化鉀、硝酸鉀、硝酸銨溶液。瓊脂固化后,既能實現離子遷移,又不會倒流)
[投影]教師小結(見圖4)。
設計意圖: 該環節設計思路模擬歷史上從伏打電池發展到丹尼爾鹽橋電池的過程。創設真實的問題情景,激發學生的探究興趣,推動學生的創造性思維的形成和發展,基本思路為: 發現問題—分析原因—分析解決關鍵點—設想方案(創造性思維啟動)—實驗確認。本環節也承載了本堂課重點知識與技能的學習,教學方法為: 設計問題串,由學生總結與感悟,完全避免了枯燥的知識傳授,知識的獲得與能力的提升齊頭并進。
2.3? 真實的供電新問題,在探究中發展學生的創造性思維
[教師]沒用鹽橋時電流強度起始值為1047μA,180秒時為945μA(見圖5),使用鹽橋時電流強度約為666μA(見圖6),為什么使用鹽橋后電流強度會變小呢?猜測可能的原因。
[學生]電流強度小,是因為電阻大。鹽橋的裝置拉大了正負極之間的距離,導致電阻增大,電流強度變小。
[教師]猜測是否正確呢?要用實驗來檢驗。
[教師演示實驗2]用一根長的鹽橋和一根短的鹽橋進行對比實驗,分別用電流傳感器檢測電流強度(實驗結果見表3)。
[教師演示實驗3]向含有一根鹽橋的裝置中添加鹽橋,變成兩根、三根,進行對比實驗,分別用電流傳感器測量電流強度(實驗結果見表4)。
[學生小結]鹽橋越短,電阻越小,電流越大;鹽橋越多,接觸面積越大,電流越大。
[教師]讓電流增大,可以怎么做?
[學生]鹽橋盡量短,接觸面積盡量大。
[教師提示]極限的短,極限的長,會是什么樣?
[學生]一層膜!
[教師]這個膜應該具有什么樣的功能?
[學生]隔開氧化劑和還原劑,避免接觸;某些離子能通過,保持兩側電荷平衡。
[投影]隨著高分子材料的發展,1950年W.朱達首先合成了離子交換膜。離子交換膜是一種含離子基團的、對溶液里的離子具有選擇透過能力的高分子膜,也稱為離子選擇性透過膜。主要分為陽離子交換膜、陰離子交換膜和特殊離子交換膜。陽離子交換膜只允許陽離子通過,陰離子交換膜只允許陰離子通過。
[教師]在銅鋅原電池中放陽離子交換膜還是陰離子交換膜?
[學生]陰離子交換膜。
[投影]堿性電池、新型電池內部構造。
[教師]電池內部是膜的結構。用這樣膜的結構還可以克服鹽橋裝置需定期更換鹽橋的缺點。
設計意圖: 這個過程仿佛讓學生參與了真實的電池改進過程,教師設計問題激發學生去探究,用對比實驗讓學生的思維產生靈感,從而使學生的創造性思維得到發展,并體驗到成功的快樂。
2.4? 真實的電池歷史演變,激勵學生繼續探究與創新
[教師]今天這堂課,根據我們面臨的一個又一個的問題,不斷設計方案改進實驗裝置,這個探究過程就是歷史上電池的發明和發展的過程。
[投影]見表5。
[教師]如今,電池還在進行著一次又一次的創新與突破,從金屬電池發展到氣體燃料電池再到太陽能電池,從一次性電池發展到可充電電池。電池的容量也在發生著巨大的變化,特斯拉純電動汽車的續航能力已達500~800公里,這使得傳統的油箱和電池基本上沒有任何競爭力。每一次的變革,都來自科學家們對問題的解決。可以說,電池的發展之路,就是一條問題解決之路。技術的進步和科學的發展都需要我們不斷地通過探究解決問題。希望大家能保持這種積極探索科學問題的熱情,同時具有解決生產生活中化學問題的擔當和能力。課后,希望同學們還能繼續去探究,例如: 探究課題1: 如何提高電池的容量?探究課題2: 探究電池的電壓跟什么有關?
設計意圖: 用這樣的課堂小結,既理清了整堂課以電池改進為主線的思維脈絡,又讓學生體會到以問題解決為暗線的科技創新之路。
3? 教學總結
許多教師對原電池的教學進行探索: 黃元東,周青基于CoRe模型對高中化學教師在“原電池”主題的PCK進行表征研究,發現優秀教師重視原電池與生活的聯系,靈活創造教學情境,選擇圖像、舉例、實驗等多種方式開展教學,注重培養學生的推理、識圖和思維能力,幫助學生深刻理解某些抽象和重難點的知識[2]。李振明認為原電池的形成經歷了多位科學家多年的科學研究,適合采用HPS(化學史、科學哲學和科學社會)教學模式進行原電池的教學,科學史的展示盡量以時間的先后順序展現歷史材料[3]。顧建辛對蘇教版原電池教學的現狀進行分析,認為教師受“考點”“熱點”的綁架,課堂教學表現出只觸及表面性的事實和結論,缺乏對情境假設與猜想的引導[4]。
教材呈現的銅-鋅雙液原電池,通過電流計指針的偏轉來說明化學能轉化為電能,大多數情況下師生只會關注指針有沒有偏轉,而不會定量讀出電流數據并進行比較。本節課使用了電流傳感器,學生可以從實驗圖像中直觀感受到單液原電池中的電流強度數值的緩慢下降,從而發現電流不穩定、供電效率低的問題;在比較不同(長短、數量)鹽橋的原電池時,電流傳感器實時測定的準確電流強度數值可以讓學生快速發現規律。本節課教學中模擬歷史上曾經真實存在的一個個電池問題,引導學生一步步解決它們;在學生完成問題解決后,最后呈現科學家們探究電池的一個個歷程,讓學生再次感悟科學發展的歷程。相比于直接呈現歷史,這種“不謀而合”的方式更能夠讓學生體驗到科學探究的魅力與成就感以及科學發展的必然規律。本節課在課堂中引入真實的問題情境,營造有利于創造的學習環境,發揮學生的想象力,同時對學生的猜想進行引導,利用實驗手段培養學生的探究精神和實踐能力,實現思維的提升和突破。這種創造性思維的形成,能夠幫助學生今后走出課堂面對實際問題時迸發出靈感來解決問題,進行發明和創新活動。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版)[S]. 北京: 人民教育出版社, 2018: 29, 73.
[2]黃元東, 周青. 優秀化學教師“原電池”主題的PCK表征研究[J]. 化學教學, 2019, (8): 20~24.
[3]李振明. 基于核心素養的HPS教學模式構建——以“原電池”為例[J]. 中學化學教學參考, 2019, (9): 29~31.
[4]顧建辛. 關于化學核心素養培育的微觀思考——原電池教學中的“證據推理與模型認知”[J]. 化學教學, 2017, (11): 34~38.

