基于網絡藥理學及分子對接探討交泰丸治療心律失常的作用機制
常燕 林建國 李成 張曉彤 湯文麗 姚魁武


摘要 目的:運用網絡藥理學及分子對接分析交泰丸治療心律失常的作用機制。方法:通過中藥系統藥理學數據庫與分析平臺(TCMSP)與BATMAN數據庫檢索黃連、肉桂的活性成分和靶基因,利用GeneCards數據庫檢索得到與心律失常相關的靶基因,采用Cytoscape軟件繪制交泰丸的“活性成分-作用靶點”網絡圖,采用STRING數據庫構建交泰丸治療心律失常的蛋白質-蛋白質相互作用(Protein Protein Interaction,PPI)網絡圖,將PPI網絡圖導入Cytoscape,采用DAVID數據庫對藥物-疾病交集靶點進行基因本體(Gene Ontology,GO)富集分析和京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG) 通路富集分析,使用Autodock Vina和Pymol進行分子對接。結果:共收集到交泰丸31個有效成分及其556個成分靶點;心律失常相關靶點2 205個;藥物成分和疾病的共有靶點174個;使用Cytoscape拓撲分析得到小檗浸堿、表小檗堿、黃藤素、黃柏酮、小檗堿等20個核心成分,PPI網絡得到ALB、AKT1、MAPK3、VEGFA、SRC等15個關鍵核心靶點。生物信息學富集分析中共獲取821個GO條目,109條KEGG通路,主要涉及PI3K-AKT信號通路、Rap1信號通路、cAMP信號通路、甲狀腺激素信號通路、HIF-1信號通路等。分子對接結果表明,度值排名前5的主要活性成分與核心靶點(ALB、AKT1、MAPK3、VEGFA、SRC)有較強的親和力。結論:該研究揭示了交泰丸可能通過調控細胞代謝、降低氧化刺激、改善血管重塑等方面治療心律失常,為后續研究交泰丸治療心律失常提供一定的中藥藥理依據。
關鍵詞 交泰丸;心律失常;網絡藥理學;分子對接;中藥藥理;作用機制
Abstract Objective:To analyze the action mechanism of Jiaotai Pills in the treatment of arrhythmia by network pharmacology and molecular docking.Methods:The active components and their target genes of Rhizoma Coptidisn(黃連) and Cortex Cinnamomi(肉桂) were obtained through TCMSP platform and BATMAN database,GeneCards database retrieval were used to get the target genes associated with arrhythmia.Cytoscape software was used to draw “active ingredient-action target ” network graph.The STRING database was used to construct protein-protein interaction(PPI) network diagram of Jiaotai Pills in the treatment of arrhythmia.PPI network diagram was imported into Cytoscape.The DAVID database was used to perform GO(Gene Ontology) function and KEGG(Kyoto Encyclopedia of Genes and Genomes) pathway enrichment analysis on drug-disease intersection targets,and Autodock Vina and Pymol were used for molecular docking.Results:A total of 31 active components and 556 component targets of Jiaotai Pills were collected.There were 2 205 targets related to arrhythmia; 174 drug and disease intersection targets were obtained; The Cytoscape topological analysis was used to obtain 20 core components such as berlambin,epiberberine,palmatine,obacunone,berberine and etc.and PPI network was used to obtain 15 core targets such as ALB,AKT1,MAPK3,VEGFA,SRC.A total of 821 GO terms and 109 KEGG pathways were obtained through bioinformatics enrichment analysis,mainly involving PI3K-AKT signaling pathway,Rap1 signaling pathway,cAMP signaling pathway,thyroid hormone signaling pathway,HIF-1 signaling pathway,etc.The results of molecular docking showed that the main active components had strong affinity with the core target(ALB,AKT1,MAPK3,VEGFA,SRC).Conclusion:This study revealed the mechanism of Jiaotai Pills in the treatment of arrhythmia by regulating cellular metabolism,reducing oxidative stress,improving vascular remodeling,providing some pharmacological basis for the follow-up study on the treatment of arrhythmia by Jiaotai Pills.
Keywords Jiaotai Pills; Arrhythmia; Network pharmacology; Molecular docking; Pharmacology of Chinese medicine; Mechanism of action
中圖分類號:R285.6,R541.7文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.13.006
心律失常是指心臟節律的紊亂,主要有不規則心率、異常快速心率(心動過速)和異常慢速心率(心動過緩)3種表現[1],臨床上本病既可單獨發病,又可同時伴發其他心血管疾病,具有發病率高及病情復雜等特點[2],甚至危及生命。據中國心源性猝死流行病學調查顯示,我國每年因心源性猝死患者可達54.4萬例,其中80%以上是由惡性心律失常引起的[3]。目前在治療方面,臨床上多采用西藥治療,作用機制雖明確,但有“再致心律失常”的風險。在臨床實踐中,中藥可通過多途徑、多靶點等方向治療疾病,療效較為顯著。
交泰丸是臨床中治療心悸的常用經典方劑,此方源自明·韓懋《韓氏醫通》,主要用于治療“心腎不交,怔忡不寐”,方由黃連、肉桂兩味藥物組成,黃連苦寒入心經,擅降心火不使其炎上,肉桂辛熱入腎經,擅暖水臟不使其潤下,二者寒溫并用,水火既濟,亦有瀉南補北、交通心腎之妙[4]。因其組方獨特,療效顯著,被后世臨床治療心悸廣泛配合應用[5]。有研究報道使用交泰丸加味治療室性早搏68例,早搏癥狀消失共計50例,癥狀明顯好轉有14例,總有效率達94%[6]。許鳳云等[7]觀察交泰丸對心血管系統的影響,結果顯示交泰丸在增加耐缺氧能力、降壓、增加冠脈流量及改善急性心肌缺血所引起的心電圖的變化等方面效果較佳。
網絡藥理學是基于系統生物學的理論,融合多向藥理學、生物信息學、計算機科學等多學科內容和技術,通過多種數據庫進行網絡分析,建立可視化網絡關系圖,從分子層面和整體角度對藥物活性成分、作用靶點以及疾病的靶點蛋白進行分析,預測其作用機制[8-9]。目前臨床對于交泰丸治療心律失常的作用機制研究較少,本研究擬通過網絡藥理學技術,構建交泰丸成分-靶點-疾病網絡進行分析,以探究其物質基礎及治療心律失常的作用機制,為后續研究提供有效的藥理學依據。
1 資料與方法
1.1 交泰丸靶點收集
通過中藥系統藥理學數據庫與分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://tcmspw.com/tcmsp.php)與BATMAN數據庫(http://bionet.ncpsb.org/batman-tcm/),分別檢索黃連、肉桂的活性成分。TCMSP平臺篩選條件為口服生物利用度(Oral Bioavailability,OB)≥30%,類藥性(Drug Likeness,DL)≥0.18,BATMAN數據庫設定為Score≥20進行篩選。通過PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)獲取活性成分化學結構,保存Smile號,隨后將Smile號上傳至Swiss Target Prediction數據庫,以“人類”為研究物種,進行相關活性成分的靶點預測,最后得到交泰丸活性成分及其作用的靶點。
1.2 心律失常靶點收集
通過GeneCards數據庫(https://www.genecards.org/)篩選治療心律失常的相關靶點,以“arrhythmia”為關鍵詞進行檢索,篩選收集心律失常相關基因靶點。
1.3 活性成分-作用靶點網絡圖的繪制
選取活性成分作用靶點和疾病靶點的交集靶點,利用Cytoscape軟件繪制活性成分-作用靶點網絡圖,使用Network Analyzer分析功能對網絡圖進行計算,根據結果篩選出核心活性成分。
1.4 核心蛋白的收集
通過STRING平臺(https://string-db.org)對交集靶點進行蛋白質-蛋白質相互作用(Protein Protein Interaction,PPI)網絡的繪制,將PPI信息導入Cytoscape中,對蛋白網絡進行模塊化聚類處理,通過Network Analyzer計算得出核心蛋白。
1.5 GO和KEGG富集分析
利用DAVID數據庫(https://david.ncifcrf.gov)對交集靶點進行基因本體(Gene Ontology,GO)和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,設定閾值P≤0.5,選擇生物過程(Biological Process,BP)、細胞成分(Cell Component,CC)和分子功能(Molecular Function,MF)3個模塊進行GO富集分析,通路分析選擇KEGG,并將得到的數據進行可視化,構建其排名前15個條目的氣泡圖。
1.6 分子對接
將“活性成分-作用靶點”網絡圖中節點度值最高的5個活性成分與PPI網絡中節點度值最高的5個核心蛋白進行分子對接,驗證其相互作用強度,活性成分結構通過PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov)獲取,蛋白質結構通過PDB數據庫(http://www.rcsb.org)獲取。隨后使用AutoDock Vina軟件進行分子對接,借助Pymol軟件對對接結果進行優化制圖。
2 結果
2.1 交泰丸活性成分及其靶點獲取
通過TCMSP平臺以OB≥30%,DL≥0.18為篩選條件,BATMAN數據庫設定為Score≥20進行篩選,收集到活性成分31個,其中黃連14個、肉桂17個。見表1。通過Swiss Target Prediction數據庫對活性成分進行靶點預測,共得到556靶點基因。
2.2 心律失常靶點獲取
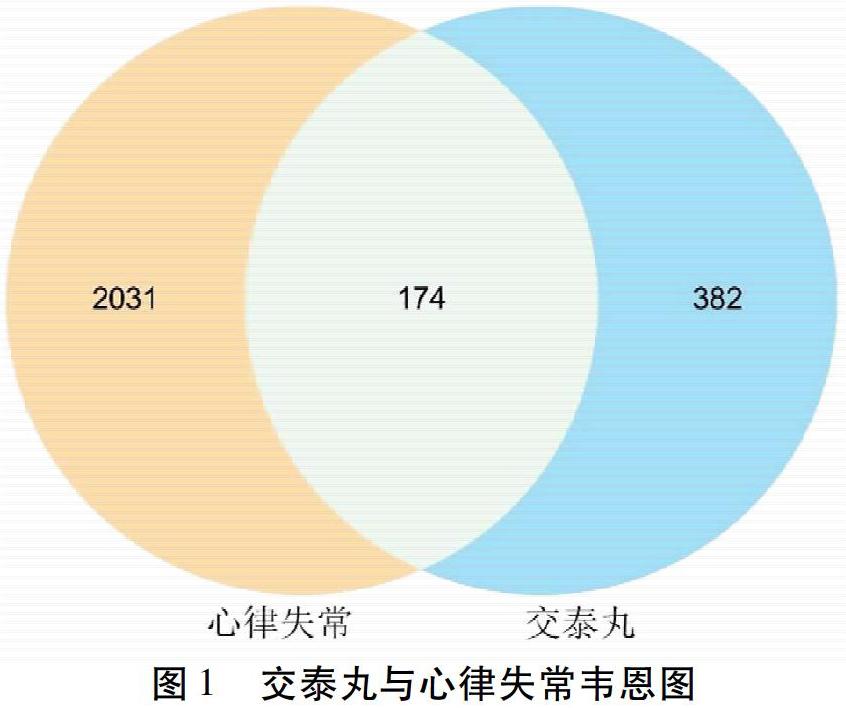
以“Arrhythmia”為檢索詞進行檢索,收集心律失常相關靶點,其中GeneCards數據庫2 205個(Relevance Score≥2),對疾病靶點與藥物靶點取交集,得到二者交集靶點174個。見圖1。
2.3 活性成分-作用靶點網絡圖分析
使用Cytoscape對174個交集靶點進行“活性成分-作用靶點”網絡圖的繪制。Network Analyzer計算分析得到209個節點,704條邊,平均度值為6.7,根據度值篩選前20名的活性成分。其中度值排名前5的化合物分別為小檗浸堿(Berlambine)、表小檗堿(Epiberberine)、黃藤素(Palmatine)、黃柏酮(Obacunone)、小檗堿(Berberine),由此推測上述化合物可能是交泰丸治療心律失常的重要活性成分。見圖2,表2。
2.4 核心蛋白PPI網絡圖分析
將174個交集基因,導入STRING數據庫,獲取PPI網絡圖及對應的網絡數據,使用Cytoscape對數據進行網絡拓撲分析,得到173個節點,2 199條邊,平均度值25.4。根據篩選度值前15的蛋白質,其中度值排名較高的ALB、AKT、MAPK3、VEGFA、SRC等核心靶點,在PPI網絡中與其他蛋白相互作用較強。見圖3,表3。
2.5 GO富集與KEGG富集分析
利用DAVID數據庫對174個交集基因進行基因富集分析共得到生物過程(Biological Process,BP)621個、分子功能(Molecular Function,MF)121個,細胞成分(Cellular Component,CC)79個。根據校正后P值進行排序,選擇GO富集和KEGG富集排名前15的條目繪制氣泡圖。BP主要與藥物反應、蛋白磷酸化、細胞增殖的負調控、凋亡過程的負調控、細胞外調節蛋白激酶的負調控等過程相關;MF主要涉及凋亡過程、蛋白質結合、腺苷三磷酸、酶結合、相同蛋白質結合等功能;CC主要涉及細胞質膜、細胞膜、細胞外隙、細胞表面、內質網膜等。此外,KEGG富集分析篩選得到109條(P<0.05)信號通路,推測交泰丸治療心律失常關鍵靶標所參與的通路主要涉及PI3K-AKT信號通路、Rap1信號通路、cAMP信號通路、甲狀腺激素信號通路、HIF-1信號通路等,推測交泰丸可能通過以上主要通路發揮治療心律失常的作用。見圖4。
2.6 分子對接
利用Autodock軟件將活性成分-作用靶點網絡圖中得到的節點度值最高的5個活性成分:小檗浸堿、表小檗堿、黃藤素、黃柏酮、小檗堿,分別與PPI網絡圖中排名前5位的核心蛋白ALB、AKT1、MAPK3、VEGFA、SRC進行分子對接。配體和受體二者結合越穩定,二者結合能越低,由分子對接結果可知,各活性成分與目標受體蛋白對接的結合能均小于-6 kcal/mol,說明活性成分能夠與配體自發結合并借助氫鍵等分子間作用力形成較為穩定的構象。其中表小檗堿與AKT1(-10.1 kcal/mol)結合性最好,從圖中可看出表小檗堿與AKT1相互作用,結合后呈現穩定狀態。結合情況見圖5,分子對接構象見圖6。
3 討論
從中醫學角度分析,心律失常多歸屬于“心悸”“怔忡”等范疇。中醫認為心悸病機以臟腑功能失常為本,心神失養為標。早在先秦時期,《黃帝內經》一書就從心腎二臟論述該病,如“心病,治不得,索之水,水者腎也”,說明了病位在心而不止于心;《素問·大奇論》“腎肝并小弦欲驚”,指出驚悸的發生與腎亦有關系[10]。交泰丸是治療心腎不交證的代表方,對心腎不交型心悸療效顯著。現代研究發現交泰丸及各組分含藥血清對鈉離子、鈣離子電流均有不同程度的抑制,可通過改變膜反應性,消除折返激動,延長細胞動作電位從而發揮抗心律失常的作用[11-12]。
從有效藥物成分分析,本研究通過網絡藥理得出交泰丸治療心律失常的有效成分主要有小檗浸堿、表小檗堿、黃藤素、黃柏酮、小檗堿等。現有研究表明,表小檗堿是一種多靶標小分子,可通過AKT和ERK途徑發揮其活性作用從而抑制膽固醇合成產生的抗血脂異常[13],明顯降低心血管疾病的危險因素,保護心肌免受缺血再灌注損傷[14]。黃藤素具有較強的抗心律失常、提高免疫功能、抗炎及抗菌等藥理特性[15-16],對氯仿-腎上腺素、哇巴因誘發的心律失常及大鼠復灌性和心肌缺血性心律失常等多種實驗性大鼠模型心律失常均具有抑制作用[17]。黃柏酮屬于檸檬苦素類似物,具有抗氧化性、抑制細胞增殖和促進細胞凋亡的作用,通過調節血管內皮細胞NO的合成,減少超氧化物產生,從而降低由氧化損傷引起的對血管系統結構和功能造成的有害影響,同時下調AKT磷酸化水平來抑制血管平滑肌細胞的增殖,減少內膜增生,有助于治療由于內皮功能障礙所引起的心血管疾病[18-19]。小檗堿主要通過阻斷抑制激活鉀離子通道,延長心肌細胞動作電位時程而發揮抗心律失常作用,能有效防治多種因素引起的室性心律失常[20]。在大鼠心臟缺血再灌注誘導的心律失常模型中,口服小檗堿可降低心肌組織ANP、BNP和cTn-I的水平,并可顯著改善心肌結構性的損傷[21],通過上調缺血心肌的蛋白激酶水平來實現保護心肌的作用[22]。
從關鍵核心靶點分析,在PPI網絡中得到前5位靶點分別為ALB、AKT1、MAPK3、VEGFA、SRC。大量數據表明ALB的治療機制不僅通過對血漿容量擴充的影響而介導,而且還通過對炎癥和氧化應激的調節發揮作用[23]。低ALB水平可以預測穩定的冠狀動脈疾病患者的主要不良心血管事件[24]。AKT具有調節細胞分化、凋亡、代謝等功能,并可影響各種促血管生成因子和抗血管生成因子的表達和活性,并指出AKT1作為AKT亞型之一,是血管生成相關異常的治療靶標[25]。VEGF對內皮細胞具有促有絲分裂、細胞遷移和抗凋亡作用,增加血管的通透性,參與調節正常和病理性血管生成過程[26],同時VEGF被認為是心律失常和冠狀動脈疾病的病理生理因素,是潛在治療靶標之一,對預后具有重要意義[27]。VEGFA作為VEGF家族中的重要一員,研究證實其在心律失常致死的大鼠心肌組織中呈彌漫性表達,可為致死性心律失常和冠狀動脈供血不足引起的急性心肌缺血的鑒別診斷提供依據[28]。SRC是一種酪氨酸蛋白激酶,可調節細胞的代謝、成活和增殖,并在巨噬細胞介導下的炎癥反應中起到關鍵作用[29]。C-SRC作為SRC的一種表現形式,其抑制可以改善心肌梗死后心律失常的縫隙連接蛋白43(Cx43)水平和傳導速度,并降低心律失常的可誘導性[30]。
從信號通路分析,KEGG富集分析顯示,交泰丸治療心律失常主要涉及PI3K-AKT信號通路、Rap1信號通路、cAMP信號通路、甲狀腺激素信號通路、HIF-1信號通路等。PI3K-AKT途徑主要通過磷脂酰肌醇-3,4,5-三磷酸(PIP3)激活下游信號轉導因子AKT來調節細胞的生長、增殖和成活,從而對心肌細胞起到保護作用,若PIP3信號轉導的活性降低可導致心律失常[31]。研究證實白藜蘆醇可通過PI3K-AKT信號通路增加心肌Cx43的水平和活性,從而防止再灌注性心律失常的發生[32]。Rap1作為心臟線粒體活性氧(ROS)生成的負調控因子,Epac2-Rap1信號會減弱線粒體ROS的產生并降低心律失常的易感性,若Epac2-Rap1信號通路受損會由于ROS依賴晚鈉電流的激活而導致心律失常[33]。甲狀腺激素(Thyroid hormones,TH)在心血管系統,特別是在心臟中具有中樞調節作用,血漿或組織中TH水平的變化與心血管功能的顯著改變有關[34]。單純TH可引起持續性竇性心動過速和交界性心動過速[35],其甲狀腺激素信號在包括心臟在內的所有器官或組織的分化、生長、代謝和生理功能中均起著至關重要的作用[36]。心肌受損和應激可促進心臟組織的重塑,這與心肌細胞死亡和纖維化發展相關,cAMP信號轉導是受損心肌纖維化反應中的主要調節劑,調節涉及心肌纖維化的多種基本細胞過程,其中就包括調控成肌纖維細胞分化、增殖,膠原蛋白分泌和侵襲,避免其過度活化而導致心律失常、心功能障礙等疾病的發生[37]。缺氧誘導因子1(HIF-1)是一種轉錄因子,具有調節血管生成、血管重塑、葡萄糖代謝、細胞凋亡等功能,并參與多條細胞信號通路。當心臟因缺血而引起心肌超微結構、心功能和電生理一系列損傷性變化時,激活HIF-1可以上調與血管系統相關蛋白的基因表達,增加血流,降低缺血損傷,通過參與重建細胞代謝途徑來實現對心臟組織的保護[38]。
最后,通過分子對接技術,計算得出交泰丸主要活性成分與核心蛋白的結合能均小于-6 kcal/mol,且對接較為穩定的組合為表小檗堿與AKT1(-10.1 kcal/mol)、小檗浸堿與SRC(-10.0 kcal/mol)2組。該結果表明交泰丸的活性成分與受體蛋白穩定結合,從而能夠發揮治療心律失常的作用,在分子層面為接下來的基礎研究起到了奠基作用。
綜上所述,本研究運用網絡藥理學方法和分子對接技術初步闡釋了交泰丸通過多種靶點、多種生物過程和通路治療心律失常的作用機制可能與調控細胞代謝、降低氧化刺激、改善血管重塑等方面有關,然而本研究的數據主要從數據庫收錄獲取,具有一定局限性,故仍有部分結果需進一步完善和深入的實驗研究。
參考文獻
[1]Hussain L,Aziz W,Saeed S,et al.Arrhythmia detection by extracting hybrid features based on refined Fuzzy entropy(FuzEn) approach and employing machine learning techniques[J].Waves in Random and Complex Media,2020,30(4):656-686.
[2]師帥,耿彥婷,胡元會,等.穩心顆粒聯合比索洛爾治療心力衰竭合并心律失常的系統評價[J].中國實驗方劑學雜志,2016,22(15):216-219.
[3]陳璇,王雨鋒,張筑欣,等.中國心律失常現狀及治療進展[J].中國研究型醫院,2020,7(1):75-78,198-201.
[4]曹雯,張會峰,范堯夫,等.交泰丸的現代研究進展[J].長春中醫藥大學學報,2019,35(3):610-612.
[5]朱明軍,李同平,王永霞.淺析交泰丸治療心悸的臨床應用與藥理研究[J].遼寧中醫雜志,2006,33(9):1168-1169.
[6]張文華.交泰丸加味治療室性早搏68例[J].廣西中醫藥,1994,17(4):7-8.
[7]許鳳云,孫曙光,苗明三,等.交泰丸對心血管系統的影響[J].河南中醫,1992,12(6):266-267.
[8]邢心睿,呂狄亞,柴逸峰,等.網絡藥理學在中藥作用機制中的研究進展[J].藥學實踐雜志,2018,36(2):97-102.
[9]董培良,李慧,韓華.中藥網絡藥理學的應用與思考[J].中國實驗方劑學雜志,2020,26(17):204-211.
[10]鐘立達.從心腎相關論治心律失常[J].中西醫結合心腦血管病雜志,2014,12(8):1016-1017.
[11]邢作英,王永霞,朱明軍,等.交泰丸及其組分含藥血清對豚鼠心室肌細胞鈉通道的影響[J].中國中西醫結合雜志,2019,39(8):983-987.
[12]邢作英,王永霞,朱明軍,等.交泰丸含藥血清對豚鼠心室肌細胞ICa-L的影響[J].天津中醫藥,2019,36(1):71-74.
[13]Liu L,Li J,He Y.Multifunctional epiberberine mediates multi-therapeutic effects[J].Fitoterapia,2020,147:104771.
[14]Tan HL,Chan KG,Pusparajah P,et al.Rhizoma Coptidis:A Potential Cardiovascular Protective Agent[J].Front Pharmacol,2016,7:362.
[15]Mai CT,Wu MM,Wang CL,et al.Palmatine attenuated dextran sulfate sodium(DSS)-induced colitis via promoting mitophagy-mediated NLRP3 inflammasome inactivation[J].Mol Immunol,2019,105:76-85.
[16]楊念云,張啟春,朱華旭,等.黃連生物堿類資源性化學成分研究進展與利用策略[J].中草藥,2019,50(20):5080-5087.
[17]劉丹,曹廣尚,司席席,等.黃連中生物堿類成分抗心律失常研究概述[J].山東中醫雜志,2017,36(2):164-166,171.
[18]Yoon J,Park M,Jh L,et al.Endothelial nitric oxide synthase activation through obacunone-dependent arginase inhibition restored impaired endothelial function in ApoE-null mice[J].Vascul Pharmacol,2014,60(3):102-109.
[19]李東耀,陳文杰,商駿,等.黃柏酮對大鼠自體移植靜脈橋術后內膜增生的抑制作用及其機制[J].廣西醫學,2018,40(7):808-811.
[20]趙西子,李文芳,邢彥超,等.小檗堿體內藥代動力學及藥理活性研究進展[J].遼寧中醫藥大學學報,2020,22(10):86-90.
[21]陳凱,向莉莉,裴芳,等.黃連素對大鼠心肌缺血再灌注所致心肌損傷的保護作用[J].中南藥學,2017,15(1):32-35.
[22]胡誠毅,莫志賢.黃連素的藥理作用及機制研究進展[J].中國實驗方劑學雜志,2017,23(20):213-219.
[23]Artigas A,Wernerman J,Arroyo V,et al.Role of albumin in diseases associated with severe systemic inflammation:Pathophysiologic and clinical evidence in sepsis and in decompensated cirrhosis[J].J Crit Care,2016,33:62-70.
[24]Suzuki S,Hashizume N,Kanzaki Y,et al.Prognostic significance of serum albumin in patients with stable coronary artery disease treated by percutaneous coronary intervention[J].PLoS One,2019,14(7):e0219044.
[25]Somanath PR,Razorenova OV,Chen J,et al.Akt1 in endothelial cell and angiogenesis[J].Cell Cycle,2006,5(5):512-518.
[26]Melincovici CS,Boca AB,uman S,et al.Vascular endothelial growth factor(VEGF)-key factor in normal and pathological angiogenesis[J].Rom J Morphol Embryol,2018,59(2):455-467.
[27]Vm M,Al S,Aa A,et al.Circulating interleukin-18:Association with IL-8,IL-10 and VEGF serum levels in patients with and without heart rhythm disorders[J].Int J Cardiol,2016,215:105-109.
[28]張圓,曹志鵬,毛瑞明,等.HIF-1α、VEGF-A在心律失常大鼠心肌組織中的變化[J].法醫學雜志,2017,33(3):225-231.
[29]Byeon SE,Yi YS,Oh J,et al.The role of Src kinase in macrophage-mediated inflammatory responses[J].Mediators Inflamm,2012,2012:512926.
[30]Rutledge CA,Ng FS,Sulkin MS,et al.c-Src kinase inhibition reduces arrhythmia inducibility and connexin43 dysregulation after myocardial infarction[J].J Am Coll Cardiol,2014,63(9):928-934.
[31]Ezeani M,Elom S.Necessity to evaluate PI3K/Akt signalling pathway in proarrhythmia[J].Open Heart,2017,4(2):e000596.
[32]宋娟,王佳,李寶紅,等.PI3K/Akt信號通路在白藜蘆醇抗大鼠缺血/再灌注性心律失常中的作用及機制[J].中國應用生理學雜志,2017,33(3):239-243.
[33]Yang Z,Kirton HM,Al-Owais M,et al.Epac2-Rap1 Signaling Regulates Reactive Oxygen Species Production and Susceptibility to Cardiac Arrhythmias[J].Antioxid Redox Signal,2017,27(3):117-132.
[34]Vale C,Neves JS,von Hafe M,et al.The Role of Thyroid Hormones in Heart Failure[J].Cardiovasc Drugs Ther,2019,33(2):179-188.
[35]Li H,Scherlag BJ,Kem DC,et al.Atrial tachyarrhythmias induced by the combined effects of β1/2-adrenergic autoantibodies and thyroid hormone in the rabbit[J].J Cardiovasc Transl Res,2014,7(6):581-589.
[36]Zhang D,Li Y,Liu S,et al.microRNA and thyroid hormone signaling in cardiac and skeletal muscle[J].Cell Biosci,2017,7:14.
[37]Delaunay M,Osman H,Kaiser S,et al.The Role of Cyclic AMP Signaling in Cardiac Fibrosis[J].Cells,2019,9(1):69.
[38]王蘋蘋,孔繁平,陳學群,等.低氧細胞應激的HIF-1信號通路[J].浙江大學學報:醫學版,2011,40(5):559-566.
(2021-01-14收稿 責任編輯:魏慶雙,徐穎)

