基于缺氧相關基因甲狀腺癌預后模型的研究
張弘揚,李思嘉,李巍
(中國醫科大學附屬第一醫院耳鼻咽喉科,沈陽 110001)
甲狀腺癌是一種常見的腫瘤,可發生于所有年齡段[1]。目前,針對甲狀腺癌的診斷主要依靠超聲和經皮細針穿刺,治療手段上則以手術和I131放射治療為主。雖然,這種成熟的診斷和治療方案得到了廣泛的認可,但是,關于甲狀腺癌的預后分析仍然是學者們探討的熱點。
眾所周知,腫瘤細胞內微環境的紊亂多由供氧不足導致。缺氧可使基因和蛋白質的表達發生異常,也可能在遺傳不穩定性、腫瘤發生和進展中發揮作用。已有研究[2]表明,缺氧引起腫瘤微環境的變化,促進炎癥發生、免疫抑制和治療抵抗,從而誘發肺癌。
近年來,研究者們致力于利用缺氧相關標志物評估腫瘤的預后。例如,3個缺氧相關基因(PDSS1、CDCA8和SLC7A11)被用于構建肝細胞癌的預后、復發和診斷模型[3]。基于缺氧相關基因,開發了缺氧風險模型來評估膠質瘤患者的預后[4]。這些缺氧相關預后獨立模型的建立對癌癥患者的綜合治療做出了重大貢獻。本研究旨在為甲狀腺癌患者的綜合治療提供新的、可靠的預后標志物。
1 材料與方法
1.1 缺氧相關基因的獲得
甲狀腺癌樣本的轉錄組數據和臨床數據從腫瘤與癌癥基因組圖譜(the cancer genome atlas,TCGA)網站下載,其中,包括510份甲狀腺癌樣本數據和58份癌旁樣本數據,以供進一步分析。根據錯誤發現率(false discovery rate,FDR)<0.05和| log2FC |>1,獲得2 215個差異表達基因,結合從hypoxiaDB數據庫(此數據庫為人類缺氧相關調節蛋白的研究提供了一個完整的最新數據庫)下載的差異表達基因,共獲得了373個差異表達的缺氧相關基因。
1.2 功能分析
為進一步了解基因本身的功能,以及基因可能參與的通路,采用clusterProfiler進行基因本體(gene ontology,GO)分析及京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)分析,以研究差異表達的缺氧相關基因之間的功能相關性。
1.3 蛋白質-蛋白質相互作用網絡的構建
將缺氧相關基因映射至STRING數據庫,以創建一個交互網絡來闡明差異表達基因之間的關聯。隨后,采用Cytoscape軟件對蛋白質-蛋白質相互作用網絡進行了可視化處理。
1.4 缺氧相關標志物預測模型的構建與驗證
用Cox單因素回歸分析鑒定與總生存時間相關的差異表達缺氧相關基因,并結合每個基因特定回歸系數(β),構建患者的風險評分公式。風險評分=β(基因1)×表達量(基因1)+β(基因2)×表達量(基因2)+……+β(基因n)×表達量(基因n)。
從整個甲狀腺癌TCGA數據庫中隨機選擇50%甲狀腺癌樣本(n=255)作為實驗組,其余50%甲狀腺癌樣本(n=255)作為驗證組,在2組根據風險評分公式,以中位風險評分為臨界點,將患者分為低危組和高危組。用Kaplan-Meier分析評估2組的生存差異,并用log-rank統計方法進行比較。受試者操作特 征(receiver operating characteristic,ROC)曲線和Harrell一致性指數用于評估模型預測的準確性。最后,采用單變量Cox回歸分析來確定風險評分、年齡、腫瘤TNM分期以及性別之間的獨立預后功能。
1.5 預測模型的內部驗證
為了進一步驗證該模型的預測能力,從整個甲狀腺癌TCGA數據庫中隨機選擇了50%甲狀腺癌樣本作為內部驗證數據集(n=255)。采用C指數評估所建立模型的性能。
1.6 統計學分析
采用R語言分析TCGA數據庫。繪制Kaplan-Meier生存曲線,并通過log-rank檢驗進行比較。多因素Cox回歸分析用于建立缺氧相關基因的預后預測模型。所有統計分析均使用R語言進行。所有統計檢驗均為雙側檢驗,P< 0.05為差異有統計學意義。
2 結果
2.1 差異表達缺氧相關基因的鑒定
從TCGA數據庫中獲得2 215個差異表達的甲狀腺癌基因,結合hypoxiaDB數據庫,共獲得373個差異表達的缺氧相關基因。圖1A、1B所示為373個差異表達的缺氧相關基因中的前30個基因。其中,只有1個上調基因(CCND1),而下調基因有29個。采用箱氏圖來總結甲狀腺癌和癌旁組織之間30個差異表達的缺氧相關基因的表達模式,見圖1C。
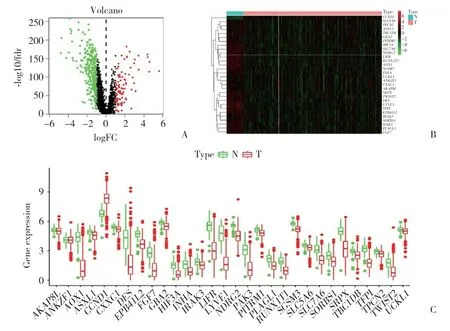
圖1 缺氧相關基因的差異表達Fig.1 Differentially expressed hypoxia-related genes
2.2 差異表達的缺氧相關基因的功能富集分析
對差異表達的缺氧相關基因進行功能富集分析有助于理解其生物學作用。GO富集分析的前10個生物學過程和KEGG富集分析的前10個通路分析如圖2所示。差異基因的生物學過程主要涉及“細胞外結構組織”“含有膠原的細胞外基質”和“細胞外基質結構成分”(圖2A)。而差異基因的通路分析主要涉及“PI3K-Akt信號通路”“細胞因子-細胞因子-受體相互作用”和“MAPK信號通路”(圖2B)。
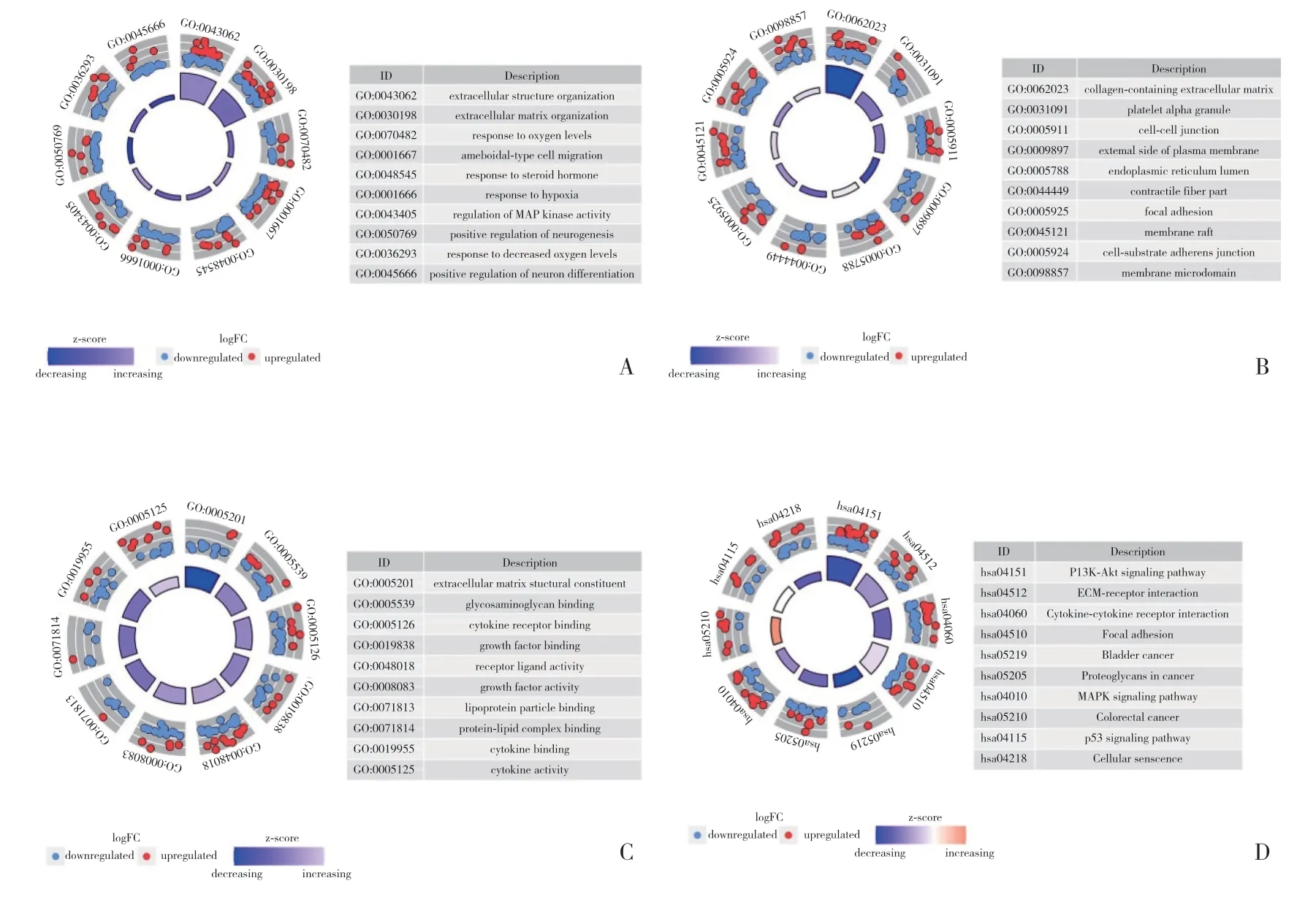
圖2 差異表達的缺氧相關基因的功能富集分析Fig.2 Functional enrichment of differentially expressed hypoxia-related genes
2.3 蛋白質-蛋白質相互作用網絡的構建與重要基因模塊
為了充分了解缺氧相關基因的差異表達,利用Cytoscape軟件構建了一個交互式蛋白質-蛋白質相互作用網絡。采用Cytoscape軟件中的分子復合物檢測(MCODE)工具來識別重要的基因模塊(hub genes),并篩選出3個重要的基因模塊。
2.4 缺氧相關基因的鑒定與預后
采用單變量Cox回歸分析確定與甲狀腺癌患者預后相關的缺氧相關基因。森林圖顯示有23個基因在甲狀腺癌患者中具有顯著的預后價值(P< 0.05,圖3A)。進一步的多變量Cox回歸分析共鑒定出11個基因(P< 0.05,圖3B)。
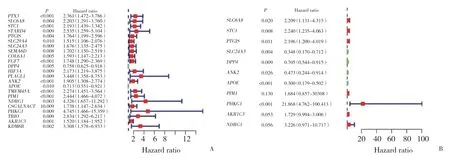
圖3 差異表達基因的單因素和多因素分析Fig.3 Univariate and multivariate analysis of differentially expressed genes
2.5 多因素Cox回歸分析預測公式的建立
根據以下公式建立基因風險評分:遺傳風險評分=0.792 6×SLC6A8+0.806 4×STC1+0.7867×PTGIS-1.057×SLC24A3-0.349 2×DPP4-0.749 2×ANK2-1.204 0×APOE+0.521 1×PIM1+3.085 0×PHKG1+0.547 3×AKR1C3+1.171 4×NDRG1。根據缺氧相關基因的預后公式,在實驗組和驗證組中分別確定了這些基因在不同風險人群中的分布以及患者的生存率。為了確定11個缺氧相關基因在預測甲狀腺癌患者臨床預后中的作用,進一步繪制了Kaplan-Meier生存曲線,以分析實驗組和對照組中高危組和低危組的不同生存時間。Kaplan-Meier 分析結果顯示,高危組患者的生存率明顯低于低危組,見圖4。
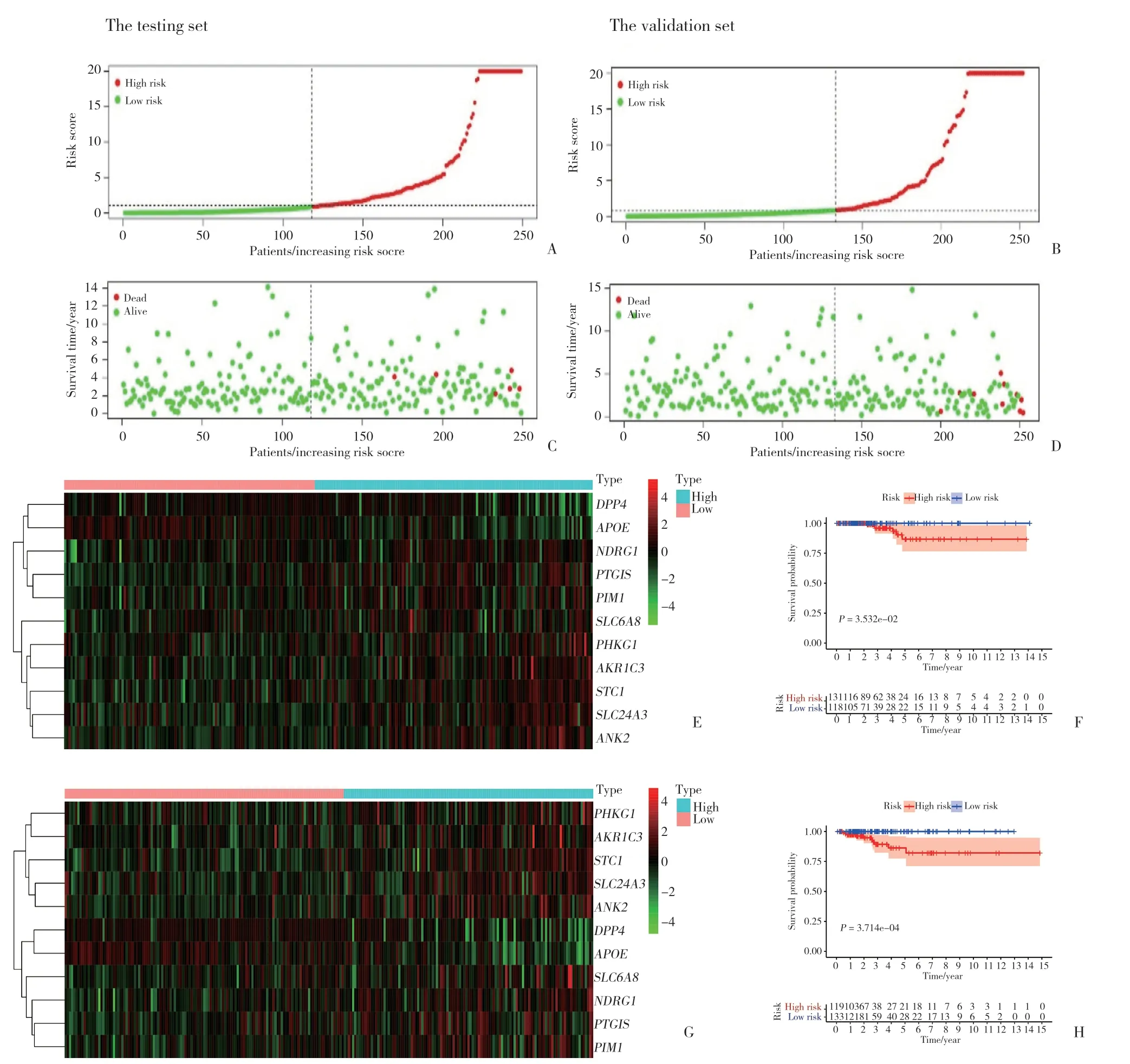
圖4 基于缺氧相關基因的甲狀腺癌預后指標驗證Fig.4 Verification of prognostic indicators for thyroid cancer based on hypoxia-related genes
采用11個與缺氧相關的基因構建了2組甲狀腺癌患者1年、3年和5年生存率的ROC曲線,來評估模型的預測性能(圖5)。在實驗組中,ROC曲線下面積(area under curve,AUC)分別為0.943(1年)、0.897(3年)和0.831(5年)。而在驗證組中,AUC分別為0.944(1年)、0.964(3年)和0.992(5年)。

圖5 基于缺氧相關基因的預后指標顯示出良好的預測性能Fig.5 Prognostic indicators based on hypoxia-related genes showed good predictive performance
對甲狀腺癌患者的臨床數據(包括風險評分)的預后價值進行單因素Cox回歸分析(表1),結果顯示,構建的風險評分在預后評估中具有較高的預測價值。
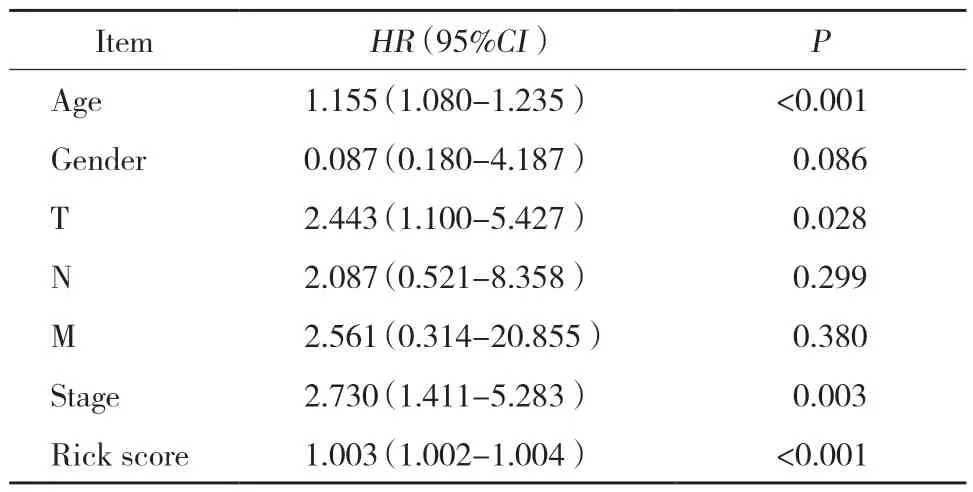
表1 甲狀腺癌患者潛在標志物的單變量分析Tab.1 Univariate analyses of potential markers for thyroid cancer patients
3 討論
近年來,甲狀腺癌的發病率呈上升趨勢,對人類健康構成了重大威脅。在美國,男性和女性甲狀腺癌的檢出率均有所上升,從1975年的每10萬人中可檢出4.9例上升至2014年的每10萬人中14.3例[4]。同時,由于5年特異性生存率差的低分化甲狀腺癌的存在[5],對甲狀腺癌的預后研究更為關鍵。
隨著對缺氧引起的腫瘤微環境變化的深入了解以及TCGA和hypoxiaDB數據庫的完善,學者們將更多的目光放在了通過缺氧相關基因來預測腫瘤的預后[6-7],近來新興的證據都在強調免疫及炎癥微環境在甲狀腺癌中的重要性[8-9]。然而,還沒有一項研究致力于通過缺氧相關基因來對甲狀腺癌患者進行預后分析。
目前,對甲狀腺癌缺氧微環境的研究大多集中在單個基因上[10-12]。本研究中鑒定的11個缺氧相關基因中,部分基因已被證實與腫瘤的預后密切相關。研究[13]顯示,CrT(SLC6A8)基因的敲除導致肌酸攝取不足,同時損害抗腫瘤T細胞的免疫功能。補充肌酸可顯著抑制腫瘤生長,并與PD-1/PD-L1阻滯劑協同抑制腫瘤生長[14]。載脂蛋白E作為高脂血癥的主要病因,被證明在高脂血癥模型中,可通過運動改善腫瘤的缺氧微環境,同時減緩原發性和繼發性EO771乳腺腫瘤的形成[15]。
此外,PTGIS和DPP4在生物信息學研究中也得到了證實。在先前與肝細胞肝癌相關的新生物標志物研究中,PTGIS是通過mRNA表達網絡分析確定的21個核心基因之一,可能是抑制肝細胞肝癌的潛在治療靶點[16],而DPP4也被證明是NF-κB 15的靶基因[17]。
STC1、PIM1和NDRG1這3種基因在癌癥中的研究更加成熟。由于STC1可能通過Bcl-2的失調在缺氧性胃癌中發揮致癌作用,因此被視為可能的胃癌潛在治療靶點[18]。在缺氧微環境下,miR-124和miR-144的下調可通過減弱PIM1的抑制作用使細胞發生缺氧,而增加患前列腺癌的風險[19]。NDRG1作為調節脂質代謝的關鍵基因可促進乳腺癌的侵襲性。因NDRG1與乳腺癌預后不良之間的關系密切,故NDRG1成為了乳腺癌中一種有前途的治療靶點[20]。
總之,本研究基于對差異表達的缺氧相關基因表達譜和相應臨床特征的綜合分析,確定了多種甲狀腺癌的預后標志物。并通過構建一個新的風險評分模型,以有效地評估甲狀腺癌患者的預后。本研究的局限性在于其為回顧性研究,今后應該進行更多的前瞻性研究,以驗證缺氧相關基因的預后功能。當然,這也需要多中心數據來證實本研究的發現。

