應用5%果糖飲水聯合鏈脲佐菌素建立妊娠期糖尿病大鼠模型
刁天,姚燦燦,徐祥波,陳西華,賀斌*
(1.國家衛生健康委科學技術研究所,國家衛生健康委員會生殖健康工程技術研究中心,北京 100081;2.北京協和醫學院研究生院,北京 100730)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一類最初診斷于妊娠中晚期(第二或第三階段)的糖尿病,且孕婦之前并不存在明確的1型或2型糖尿病[1]。GDM的定義強調兩點:一是糖尿病的癥狀于妊娠期(中或后期)出現;二是糖尿病的癥狀僅限于妊娠期,分娩后大多數恢復正常。近年來,隨著人們生活方式的改變,GDM的發病率逐年上升,并成為妊娠期最常伴發的代謝紊亂性疾病[2]。2019年的一項系統回顧和薈萃分析研究顯示,根據IADPSG標準,中國大陸GDM的總患病率為14.8%[3]。盡管GDM的患病率因診斷標準的不同而有所不同,但在最近幾年中仍呈上升趨勢,且隨著中國三胎政策的放開,GDM的發病率在未來幾年內很可能會持續增加[4]。GDM對母親以及發育中的胎兒造成嚴重的不良影響,并對母親以及嬰兒以后的生活造成長遠的不良影響,如患過GDM的母親在以后的生活中罹患2型糖尿病的概率會大大增加,且其后代在兒童期及成年后罹患代謝性疾病的風險要高于正常母親的后代[2,5]。
建立契合人類GDM主要特征的實驗動物模型對于揭示GDM的發病機制及其對母親及胎兒的影響機制、尋找干預靶點等至關重要。然而,GDM不是由單一的環境或遺傳因素造成的,其風險因素包括肥胖、種族、遺傳和家族史等[6],這使得建立完全重現該疾病的動物模型變得十分困難。目前常見的GDM建模方法有胰腺切除手術建模、藥物誘導建模如鏈脲佐菌素(Streptozotocin,STZ)[7]和四氧嘧啶(Alloxan)、飲食誘導建模、基因編輯及轉基因技術建模以及飲食合并STZ注射誘導建模等[8-10]。但現有的建模方法多數只能通過各種干預手段使實驗動物在妊娠中后期出現高血糖,而這并不符合GDM妊娠中后期自發的出現血糖升高及糖耐量異常的主要特征,因此這些模型更適用于研究GDM對妊娠及胎兒的影響。因人類GDM絕大多數符合2型糖尿病特征[5],嚙齒類動物中應用飲食合并注射STZ作為2型糖尿病常用的建模方法[11],已成為GDM最常用的建模方式[8-10]。該方法在妊娠前給予大鼠5周左右的高熱量飲食并在妊娠期給予小劑量STZ,通常為25 mg/kg[10]。然而,這種建模方法在妊娠期給予STZ后,大鼠多出現血糖過高的情況,餐后血糖達到450~540 mg/dL(25~30 mmol/L),空腹血糖達到270~360 mg/dL(15~20 mmol/L)[9-10],且由于STZ的促進胰腺β細胞損傷作用,導致大鼠體內發生強烈的蛋白質水解和脂肪分解,因此體重會相對下降[11-12]。而在人類GDM時,血糖升高及糖耐量異常癥狀多數較輕,加上醫療以及藥物的干預,嚴重的高血糖情況很少發生,實驗動物過高血糖的表型也限制了這類模型在研究GDM中的應用。
因此,本研究給予雌性Wistar大鼠5周果糖飲水代替高熱量飲食,并在妊娠期腹腔注射給予STZ,探索更符合人類GDM特征且均一性更好的實驗動物GDM模型建模方法。
資料與方法
一、實驗動物
雌性Wistar大鼠(8~9周齡,SPF Ⅱ級,北京維通利華實驗動物技術有限公司)50只;雄性Wistar大鼠(8~9周齡,SPF Ⅱ級,北京維通利華實驗動物技術有限公司)15只。飼養于國家衛生健康委科學技術研究所實驗動物中心,環境溫度20~22℃,相對濕度65%~85%,光照/黑暗12 h循環,所有大鼠均自由進食和飲水。
所有實驗相關操作都遵循國家衛生健康委科學技術研究所動物倫理委員會的相關規定。
二、研究方法
1.GDM實驗動物模型的建立:50只雌性Wistar大鼠適應一周后,隨機分為5組:正常飲食+正常飲水合并溶劑注射(NC組,n=10);正常飲食+正常飲水合并STZ注射(STZ組,n=10);高熱量飲食+正常飲水合并STZ注射(HDSTZ組,n=10);正常飲食+5%(5 g/100 ml)果糖(Sigma-Aldrich,美國)飲水合并STZ注射(F5STZ組,n=10);正常飲食+10%(10 g/100 ml)果糖飲水合并STZ注射(F10STZ組,n=10)。不同的飲食飲水持續5周后,雌雄大鼠按照1:1的比例于20:00 pm合籠,次日上午見陰栓則記為妊娠第0.5天(GD0.5)。GD6.5晚20:00 pm禁食,禁食期間自由飲水,GD7.5上午10:00 am,NC組雌性大鼠按照25 mg/kg體重腹腔注射溶劑(0.1 mol/L,pH4.5的檸檬酸鈉緩沖液無菌溶液),其余各組雌性大鼠按照25 mg/kg體重腹腔注射STZ[9-10]。
北京科澳協力飼料有限公司的大/小鼠生長維持飼料和2型糖尿病飼料分別作為正常飼料和高熱量飼料。2型糖尿病飼料含有10%豬油、20%蔗糖、2.5%膽固醇、0.5%膽酸鈉和67%的大/小鼠生長維持飼料。5%和10%的果糖飲水每日配制。
腹腔注射用STZ(Sigma-Aldrich,美國)溶液現用現配:用0.1 mol/L 的檸檬酸鈉緩沖液(pH4.5)無菌溶液配制1%(1 g/100 ml)的STZ溶液,溶液配制完成到注射前避光保存。
2.體重監測:分別在適應1周后的基線時(W0)、飲食/飲水干預1周后(W1)、2周后(W2)、3周后(W3)、4周后(W4)、5周后(W5)、GD7.5和GD19.5測量每組雌性大鼠的體重。
3.血糖水平及葡萄糖糖耐量檢測:用羅氏血糖儀(Accu-Chek Active[型號GB],德國)分別在W0、W5、GD7.5、GD10.5、GD15.5和GD19.5檢測各組雌性大鼠的空腹血糖(fasting blood glucose,FBG);在GD6.5、GD9.5、GD13.5、GD16.5、GD20.5測量各組大鼠的餐后血糖(postprandial blood glucose,PBG)。將雌性大鼠禁食10 h(9:00 am至19:00 pm)后測量FBG,禁食期間自由飲水,并將F5STZ組和F10STZ組的果糖飲水更換為正常飲用水;在非禁食狀態下當日14:00 pm測量PBG。分別在W0、W5和GD19.5對各組雌性大鼠進行口服葡萄糖耐量試驗(OGTT)。實驗前將雌性大鼠禁食10 h(9:00 am至19:00 pm),禁食期間自由飲水,并將F5STZ組和F10STZ組的果糖飲水更換為正常飲用水。在用50%(0.5 g/1 ml)葡萄糖(北京索萊寶)溶液(用蒸餾水配置)灌胃之前,測量大鼠的FBG,并通過尾靜脈采集空腹外周血于離心管中,用于后續生化分析。將50%的葡萄糖溶液按2 g/kg體重的劑量對大鼠進行灌胃,分別在0、10、15、30、45、60、90、120 min后測量血糖,并計算曲線下面積(AUC)。
4.血生化分析:將上述采集的空腹外周血于4℃、3 000 r/min離心15 min,收集血清。采用酶聯免疫吸附試驗(ELISA)測定空腹血清中胰島素的濃度(Mercodia Rat insulin ELISA kit,瑞典);采用比色法(南京建成生物工程研究所)測定空腹血清中甘油三酯(TGs)的濃度。
5.胎盤及胎兒的數量和重量:于GD20.5處死大鼠,小心剝離胎盤及胎兒,拍照記錄胎盤形態并稱重,記錄胎兒數量并稱重。
三、統計學分析
結 果
一、各組大鼠的體重變化比較
在飲食/飲水干預5周(W5)時,與NC組[(268.00±4.234)g]比較,HDSTZ組[(283.40±4.372)g]和F10STZ組[(291.98±5.518)g]的體重均顯著增加(P<0.05),而F5STZ組體重接近NC組(P>0.05)。GD7.5時,與NC組比較,F10STZ組的體重顯著升高(P<0.05)(圖1A)。在GD7.5給予STZ后,至GD19.5時各組的體重增幅結果顯示,與對照組比較,除HDSTZ組體重增幅顯著減少(P<0.05),其他各組盡管增幅有所下降,但差異無統計學意義(P>0.05)(圖1B)。
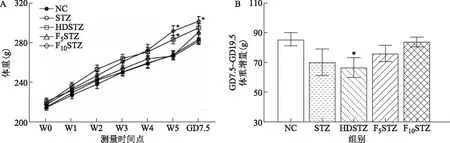
A:各組大鼠體重變化。與相同時間點NC組比較,*P<0.05;B:GD7.5~GD19.5體重增量。與NC組比較,*P<0.05。圖1 各組大鼠的體重變化結果
二、各組大鼠的血糖檢測結果
經過5周不同的飲食或飲水干預后,與NC組相比,F10STZ組的空腹血糖(FBG)水平顯著升高(P<0.05),其余各組FBG水平盡管略有上升,但差異無統計學意義(P>0.05)(圖2A);各組的餐后血糖(PBG)差異無統計學意義(P>0.05)(圖2B)。
當給予STZ注射后,STZ組的血糖在GD9.5時有所升高(150 mg/dL左右),GD13.5后恢復至NC組水平;HDSTZ組血糖則劇烈升高,PBG水平高達350~400 mg/dL,FBG也達到250~300 mg/dL;F5STZ組和F10STZ組的PBG波動在250~300 mg/dL,FBG波動在150~200 mg/dL,介于NC組與HDSTZ組之間(圖2C)。由各組大鼠GD16.5時PBG分布情況可以看出,HDSTZ組、F5STZ組和F10STZ組分別有60%(n=6)、10%(n=1)和30%(n=3)的大鼠出現嚴重的高血糖(PBG>360 mg/dL)(圖2D)。至妊娠末期(GD19.5和GD20.5)各組的FBG和PBG均有所降低(圖2C)。
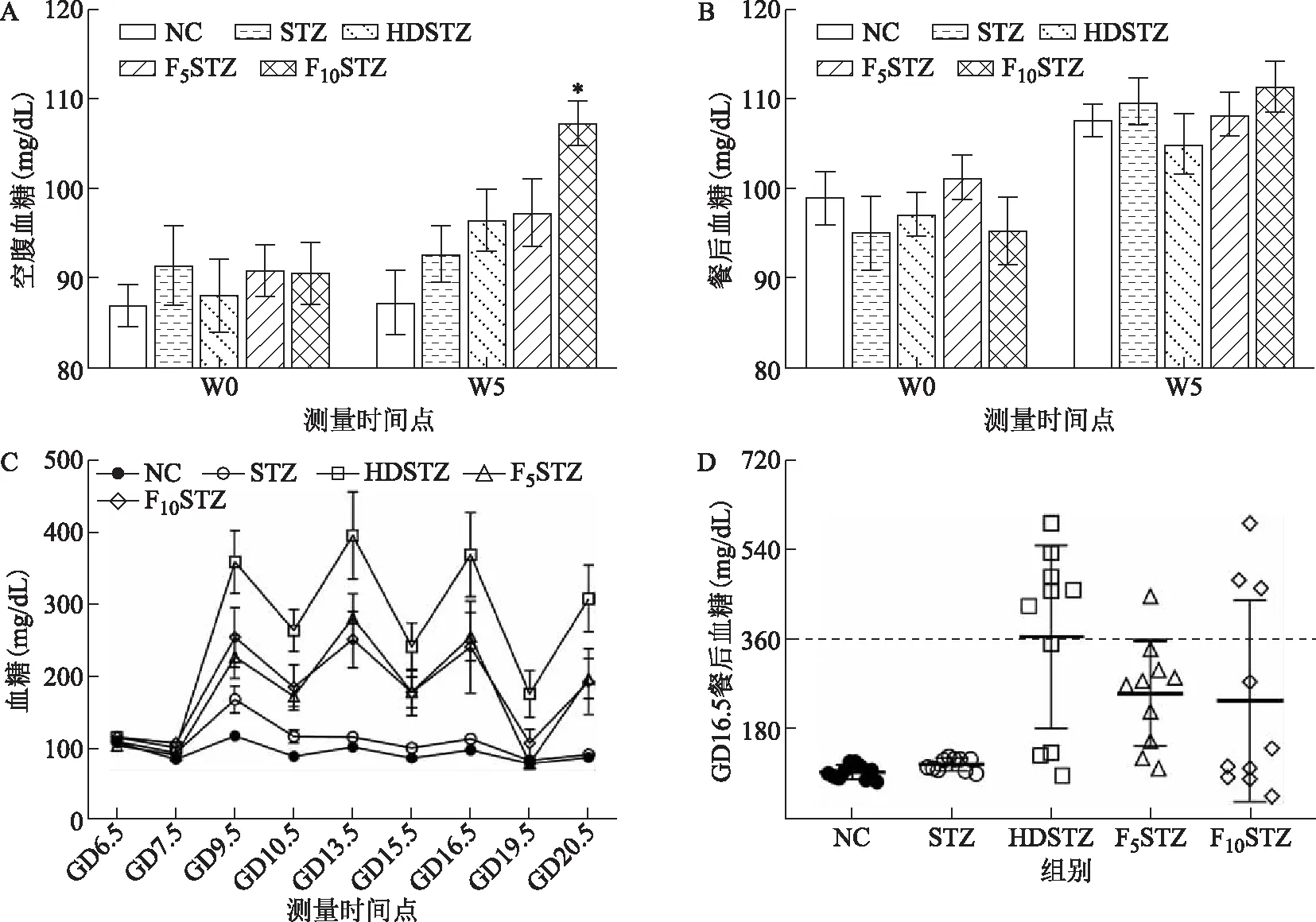
A:飲食或飲水干預5周前后各組大鼠FBG水平的變化;B:飲食或飲水干預5周前后各組大鼠PBG水平的變化;C:妊娠期間各組大鼠的FBG及PBG水平變化,其中GD6.5、9.5、13.5、16.5和20.5為PBG水平;GD7.5、10.5、15.5和19.5為FBG水平;D:各組大鼠GD16.5時PBG散點圖。與相同時間點NC組比較,*P<0.05。圖2 各組大鼠的血糖水平變化結果
三、各組大鼠口服葡萄糖耐量試驗(OGTT)結果比較
口服葡萄糖耐量試驗結果顯示:在W0時,各組的糖耐量水平相當(圖3A、D);在W5時,與NC組相比,F5STZ組和F10STZ組的大鼠在被給予50%葡萄糖溶液灌胃后,血糖峰值明顯升高且2 h血糖仍高于NC組(圖3B),AUC顯著增加(P<0.01)(圖3D);在GD19.5時,與NC組相比,HDSTZ組、F5STZ組和F10STZ組的大鼠在被給予50%葡萄糖溶液灌胃后,血糖峰值明顯升高,HDSTZ組和F10STZ組2 h后血糖仍分別高達約330 mg/dL和240 mg/dL,F5STZ組2 h后血糖約為180 mg/dL,仍高于空腹時水平(圖3C),3組的AUC顯著增加(P<0.01),且以HDSTZ組最為顯著(圖3D)。
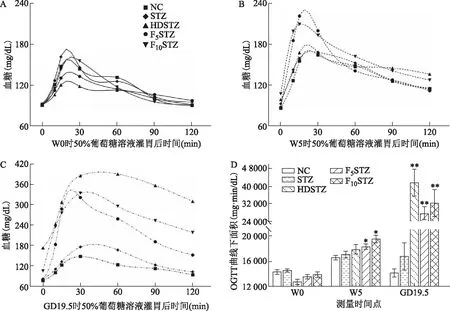
A:基線時(W0)各組大鼠在50%葡萄糖溶液灌胃后血糖水平隨時間的變化;B:飲食或飲水干預5周后(W5)各組大鼠在50%葡萄糖溶液灌胃后血糖水平隨時間的變化;C:GD19.5各組大鼠在50%葡萄糖溶液灌胃后血糖水平隨時間的變化;D:3次OGTT試驗結果的AUC統計。圖B、C圖例同圖A;與相同時間點NC組比較,*P<0.05,**P<0.01。圖3 各組大鼠的葡萄糖耐量變化結果
四、各組大鼠空腹血清胰島素和甘油三酯濃度變化比較
在W5時,與NC組相比,HDSTZ組和F10STZ組的空腹血清胰島素濃度均顯著升高(P<0.05);在GD19.5時,與NC組相比,其余4組的空腹血清胰島素濃度均顯著升高(P<0.05)(圖4A)。在W5時,與NC組相比,F5STZ組和F10STZ組的空腹血清甘油三酯濃度均顯著升高(P<0.05);在GD19.5時,與NC組相比,其余4組的空腹血清甘油三酯濃度均顯著升高(P<0.05)(圖4B)。
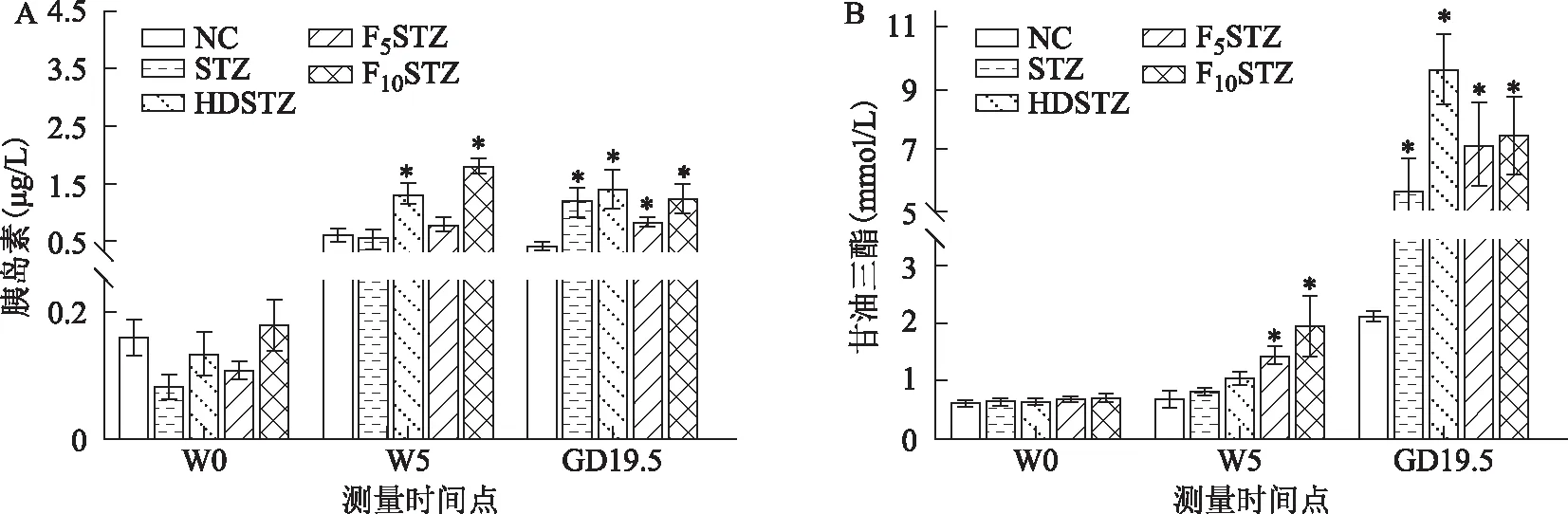
A:基線時(W0)、飲食或飲水干預5周后(W5)和GD19.5各組大鼠空腹血清中的胰島素濃度;B:基線時(W0)、飲食或飲水干預5周后(W5)和GD19.5各組大鼠空腹血清中的甘油三酯濃度。與相同時間點NC組比較,*P<0.05。圖4 各組大鼠空腹血清胰島素和甘油三酯濃度變化結果
五、各組大鼠胎盤大體形態學比較
與NC組(PBG穩定在90~180 mg/dL)比較,F5STZ組(PBG波動在270~360 mg/dL)大鼠的胎盤體積略增大,顏色無明顯變化;HDSTZ組(PBG波動在450~540 mg/dL)大鼠的胎盤體積略增大,表面顏色更深,呈暗紅色(圖5)。

圖5 NC組、F5STZ組和HDSTZ組大鼠的胎盤大體形態學改變
六、各組大鼠妊娠結局比較
從表1中可以看出,與NC組比較,HDSTZ組的平均胎鼠數量顯著降低(P<0.05),與取材時該組部分孕鼠可見1~3個吸收胎相一致;F5STZ組的平均胎鼠數量無顯著改變(P>0.05)。HDSTZ組和F5STZ組的胎鼠重量均顯著高于NC組(P<0.05)。STZ組、HDSTZ組、F5STZ組和F10STZ組的胎盤重量相對于NC組均顯著升高(P<0.05)。
表1 各組大鼠胎鼠數量及重量和胎盤重量結果比較(-±s)
討 論
本研究應用5周正常飲食合并5%果糖飲水并于GD 7.5 按25 mg/kg體重腹腔注射STZ建立妊娠期糖尿病實驗動物模型,與常用的5周高熱量飲食并于妊娠期按25 mg/kg體重注射STZ相比,妊娠期大鼠高血糖癥狀較輕,且妊娠末期葡萄糖耐量異常程度較輕,更加契合人類GDM特征。
目前GDM實驗動物模型最常用的建模方法為5周高熱量飲食,并于妊娠期給予小劑量STZ[8-10]。經過5周的飲食誘導,大鼠出現肥胖、糖耐量異常、高脂血癥等病理現象;在給予STZ后,大鼠出現高血糖[9-10],符合GDM慢性胰島素抵抗背景下的葡萄糖耐受不良的主要特征。然而,這種方法誘導的高血糖大鼠的PBG高達450~540 mg/dL(25~30 mmol/L),已達到正常Wistar大鼠PBG[(101.7±29.34)mg/dL,(5.65±1.63)mmol/L][13]的5倍左右;FBG達到270~360 mg/dL(15~20 mmol/L)[9-10],也高達正常Wistar大鼠FBG[(71.1±23.58)mg/dL,(3.95±1.31)mmol/L][13]的4倍左右,表明此類建模方法誘導的GDM大鼠妊娠期的血糖明顯過高。推測可能的原因為高熱量飲食誘導了肥胖表型,因此當妊娠期按照25 mg/kg體重注射STZ時,STZ的實際注射量是比較高的,可能過度損傷了胰島β細胞,故出現了嚴重的血糖升高,過高的血糖水平還會導致吸收胎的比率增加[14]。而在人類GDM時,由于醫療和藥物等的干預,這種嚴重高血糖的情況很少出現,因此這種模型可能更適用于研究妊娠期嚴重的高血糖對妊娠及胎兒等的影響。此外,GD7.5給予STZ后,HDSTZ組GD7.5至GD19.5的體重增幅顯著減少,提示可能與HDSTZ組的胚胎數量減少有關(表1)。
鑒于果糖在誘導胰島素抵抗方面的能力[15]以及10%果糖飲水已成為誘導大鼠代謝綜合征常用的建模方法[16],本研究嘗試給予雌性大鼠5周正常飲食及5%或10%果糖飲水(F5STZ組、F10STZ組)。處理5周后(W5),與其他3組相比,F5STZ組和F10STZ組大鼠即出現了糖耐量異常(圖3B、D),表明果糖誘導大鼠出現糖耐量異常的能力要強于單純的高熱量飲食。至GD7.5時,與正常飲食飲水對照組(NC組)相比,F5STZ組和F10STZ組的體重也呈現升高趨勢,但未及高熱量飲食組(HDSTZ組)明顯(圖1A)。在給予STZ后,妊娠期HDSTZ組、F5STZ組和F10STZ組均表現明顯的高血糖及葡萄糖耐受不良,其中分別有60%、10%和30%的大鼠出現嚴重的高血糖(PBG>360 mg/dL)(圖2C),以F5STZ組出現嚴重高血糖的比例最低,且F5STZ組血糖的一致性更佳。鑒于GD7.5時F5STZ組的體重與HDSTZ組相比無明顯差異,但注射STZ后,F5STZ組的血糖升高得更加溫和(圖1B);且F10STZ組的體重要高于HDSTZ組,但其出現嚴重高血糖的比例要低于HDSTZ組,表明大量的果糖攝入可能通過某種作用機制緩解了STZ對大鼠胰島β細胞的破壞,或者誘導了某種代償性機制以拮抗血糖異常。OGTT結果提示HDSTZ、F5STZ和F10STZ組在GD19.5時表現出明顯的葡萄糖耐受不良,且HDSTZ、F10STZ組較F5STZ組尤為顯著(圖3C、D)。另外,實驗各組(STZ組、HDSTZ組、F5STZ組和F10STZ組)在GD19.5時均出現了脂代謝異常,以HDSTZ組最為顯著(圖4B)。因此,5周5%果糖飲水并于GD7.5腹腔注射STZ這種建模方法誘導的高血糖、糖耐量異常及血脂異常表型均較輕,更符合人GDM 的特征。
此外,盡管肥胖是GDM最大的誘因,臨床上仍有相當一部分GDM患者的體重在正常范圍內[17],因此聯合應用正常飲食+5%果糖飲水和妊娠期STZ注射更適用于研究這類情況。同時,F5STZ組的胚胎數量未受到影響,且與NC組相比,F5STZ組的胎鼠體重、胎盤重量也顯著增加(P<0.05)(表1),符合妊娠期糖尿病伴隨出現“大胎兒”和“大胎盤”的特點[18-19]。而HDSTZ組大鼠妊娠期血糖過高,并呈現暗紅色,很可能已經嚴重影響了胎盤的血管發育(圖5)。
綜上所述,本研究探索出了一種新的大鼠GDM模型建模方法,該方法大鼠血糖升高及糖耐量異常均較溫和,更加契合人GDM特征,因此應用這種建模方法建立GDM動物模型對于揭示GDM對妊娠、胎盤及胎兒等的影響及其機制更有意義。

