腦脊液中miRNAs對膠質瘤診斷價值的Meta分析
馮強 馮書彬 董留建 王朝林 齊林 李濤
【摘要】 目的 系統評價腦脊液中miRNAs對膠質瘤的診斷價值。方法 檢索Cochrane圖書館、PubMed、Embase、萬方數據庫、中國期刊全文數據庫和中國維普數據庫,檢索時間為建庫起至2021年3月,收集腦脊液中miRNAs在膠質瘤中診斷價值的文獻。采用診斷準確性研究的質量評估方法2(QUADAS-2)對納入文獻進行質量評價,應用Stata 14.0和Meta-Disc 1.4軟件進行數據分析。結果 共納入9篇文獻14項研究,累計膠質瘤患者427例,對照組423例。Meta分析結果顯示合并靈敏度為0.80(95% CI:0.76~0.84),特異度為0.84(95% CI:0.81~0.88),陽性似然比為5.28(95% CI:3.53~7.89),陰性似然比為0.22(95% CI:0.14~0.35),診斷比值比為29.05(95% CI:15.42~54.76);綜合受試者工作特征曲線下面積(AUC)為0.908 3(Q*=0.840 3)。結論 腦脊液中miRNAs在膠質瘤中具有較高的診斷性能,可以作為其潛在的診斷標志物。
【關鍵詞】 微小RNAs;膠質瘤;診斷;Meta分析
【中圖分類號】 R739.41 【文獻標志碼】 B 【文章編號】 1672-7770(2023)02-0195-05
Abstract: Objective To systematically evaluate the diagnostic value of miRNAs in cerebrospinal fluid for glioma. Method Cochrane Library, PubMed, Embase, WanFang Database, China National Knowledge Infrastructure and VIP Database were searched and retrieved. The literature of miRNAs in cerebrospinal fluid for the diagnosis of glioma were obtained from inception to March 2021. Quality assessment of diagnostic accuracy studies-2(QUADAS-2) was used to evaluate the quality of included literature. STATA 14.0 and Meta-Disc 1.4 were used to conduct all statistical analyses. Results A total of 9 articles and 14 studies were included, with 427 patients with glioma and 423 in the control group. Meta analysis showed that the combined sensitivity was 0.80(95% CI:0.76-0.84), the specificity was 0.84(95% CI:0.81-0.88), the positive likelihood ratio was 5.28(95% CI:3.53-7.89), the negative likelihood ratio was 0.22(95% CI:0.14-0.35), and the diagnostic odds ratio was 29.05(95% CI:15.42-54.76). The area under the working characteristic curve(AUC) of the comprehensive subject was 0.908 3(Q*=0.840 3). Conclusion MiRNAs in cerebrospinal fluid have high diagnostic performance and can be used as potential diagnostic markers for glioma.
Key words: miRNAs; glioma; diagnosis; Meta-analysis
基金項目:2018年度河南省醫學科技攻關計劃(聯合共建項目)(2018020671)
作者單位:450000 鄭州,鄭州大學附屬兒童醫院,河南省兒童醫院(鄭州兒童醫院)神經外科
通信作者:齊林
膠質瘤是中樞神經系統最常見的原發性惡性腫瘤,約占惡性腦腫瘤的81%[1]。根據WHO分類分為低級別膠質瘤(low-grade glioma,LGG)即Ⅰ-Ⅱ級和高級別膠質瘤(h-gradhige glioma,HGG)即Ⅲ-Ⅳ級,級別越高、惡性程度越高、預后越差,尤其是Ⅳ級膠質母細胞瘤,1年生存率為40.8%,而5年生存率僅為6.8%[2]。因此,對于膠質瘤的早期識別尤為重要。微小RNAs(microRNAs,miRNAs)是一類小的非編碼RNA,是基因表達的關鍵調節因子,與腫瘤的發生發展密切相關 [3]。研究表明,miRNAs在多種疾病尤其是腫瘤性疾病中異常表達,而腦脊液中miRNAs也常被作為膠質瘤潛在的診斷標志物被研究[4-12],但結果不盡相同。本研究旨在通過Meta分析系統評價腦脊液中miRNAs對膠質瘤的診斷效能。
1 資料與方法
1.1 文獻檢索 檢索數據庫包括Cochrane圖書館、PubMed、EMBASE、萬方數據庫、中國期刊全文數據庫和中國維普數據庫,文獻檢索時間均為建庫起至2021年3月。中文數據庫檢索詞:膠質瘤、膠質母細胞瘤、微小RNA、miRNA、microRNA、miR、診斷、標志物、靈敏度和特異度、ROC曲線、腦脊液;英文數據庫檢索詞:glioma、glioblastoma、neuroglioma、miRNA、microRNA、miR、diagnosis、biomarkers、sensitivity and specificity、ROC curve、CSF、cerebrospinal fluid。
1.2 文獻篩選標準 納入標準:(1)實驗組為金標準(病理檢查)確診的膠質瘤患者;(2)報道了腦脊液中miRNAs對膠質瘤的診斷能力;(3)能獲得完整的四格表數據(真陽性、假陽性、假陰性和真陰性);(4)實驗組和對照組樣本總量≥20例。排除標準:(1)無有效數據的研究;(2)非臨床研究、綜述、病案報告、會議摘要。
1.3 資料提取與質量評價 由兩名研究者獨立進行文獻篩選、提取數據、評價文獻質量,并交叉核對,出現不同意見時與第三方討論解決。資料提取主要包括研究第一作者、發表年份、種族、膠質瘤類型、對照組情況、腦脊液來源、樣本量、miRNA類別以及診斷參數(靈敏度、特異度)。質量評價主要根據診斷準確性研究的質量評價方法2(quality assessment of diagnostic accuracy studies-2,QUADAS-2)清單進行質量評估[13]。QUADAS-2從4個部分(病例選擇、待評價試驗、金標準、病例流程和進展情況)和2個方面(偏倚風險和臨床適用性)評估研究。標志性問題的回答包括“是”“否”“不確定”, 對應偏倚風險等級為“低”“高”“不確定”。將結果為“是”的計1分,“否”或“不確定”則為0分。
1.4 統計學方法 應用Stata 14.0和Meta-Disc 1.4軟件進行數據分析。通過計算靈敏度對數與(1-特異度)對數的Spearman相關系數判斷是否存在閾值效應;通過Cochran's Q檢驗和I2 檢驗評價由非閾值效應引起的異質性,I2>50%表示存在明顯異質性。若存在閾值效應或明顯異質性,則采用隨機效應模型來合并計算靈敏度、特異度、陽性似然比(positive likelihood ratio,PLR)、陰性似然比(negative likelihood ratio,NLR)和診斷比值比(Diagnostic odds ratio,DOR),繪制綜合受試者工作特征曲線(summary receiver operating characteristic curve,SROC)及獲得曲線下面積(area under the curve,AUC),并進一步行回歸分析、亞組分析探討異質性來源;反之,則采用固定效應模型。此外,行敏感性分析檢驗結果的穩定性,繪制Deek's漏斗圖評價發表偏倚。
2 結 果
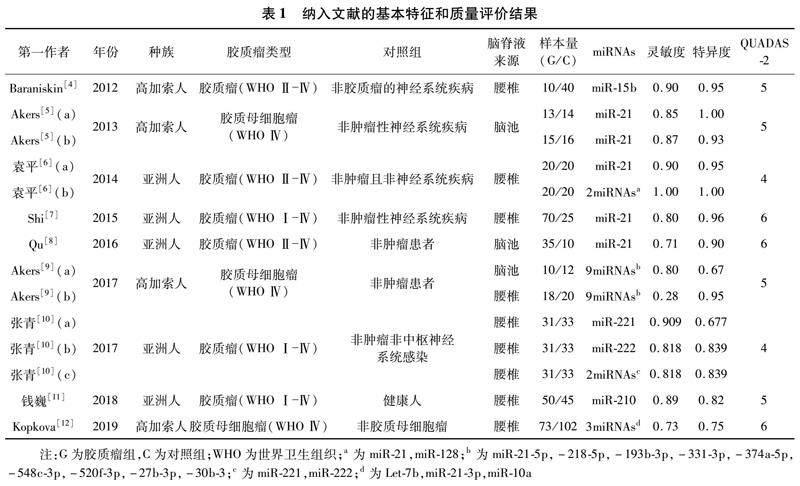
2.1 文獻檢索結果和質量評價 共檢索出文獻138篇,其中中文文獻26篇,英文文獻112篇。通過閱讀題目、摘要及全文,根據納入和排除標準,最終納入9篇符合要求的文獻[4-12],6篇為英文,3篇為中文。 納入的9篇文獻包含14組研究,850例研究對象,其中膠質瘤患者427例,對照組423例。見表1。
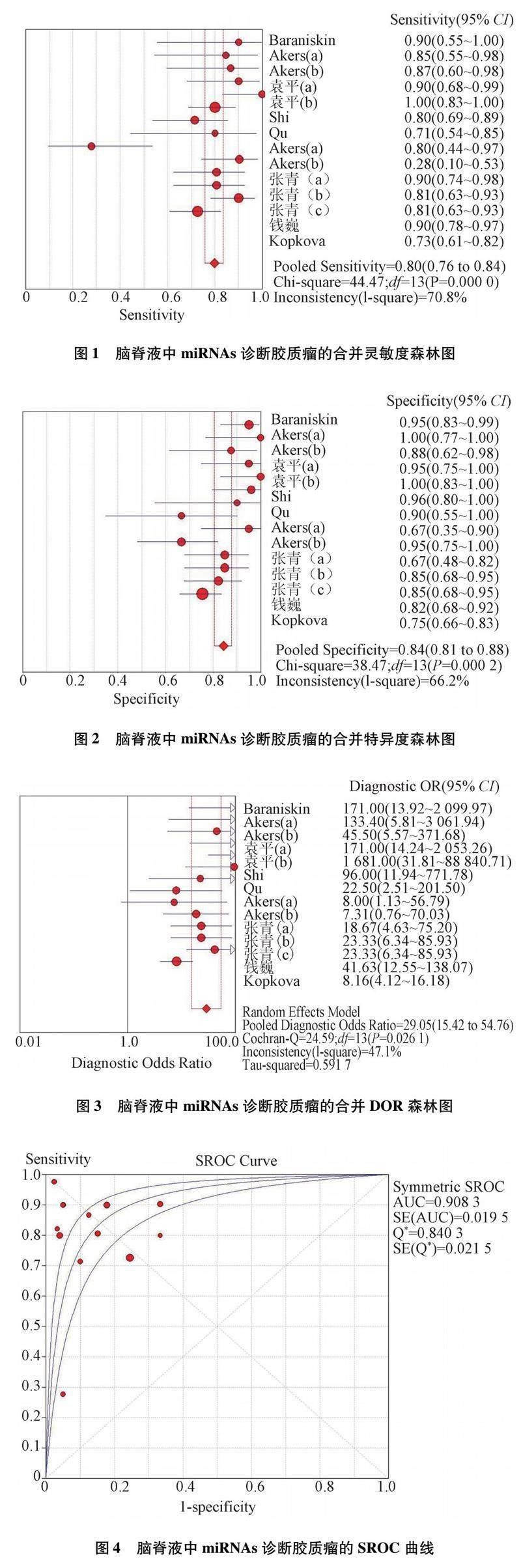
2.2 腦脊液中miRNAs診斷膠質瘤的價值 Spearman相關系數= -0.117,P=0.691,提示納入研究不存在閾值效應。異質性檢驗提示研究間靈敏度(I2=70.8%)、特異度(I2=66.2%)、PLR(I2=54.4%)、NLR(I2=81.7%)均存在明顯異質性,DOR(I2=47.1%)存在輕度異質性,采用隨機效應模型進行Meta分析。結果顯示合并靈敏度為0.80(95% CI:0.76~0.84),特異度為0.84(95% CI:0.81~0.88),PLR為5.28(95% CI:3.53~7.89),NLR為0.22(95% CI:0.14~0.35),DOR為29.05(95% CI:15.42~54.76);SROC曲線下面積(AUC)為0.908 3(Q*=0.840 3)。見圖1-4。
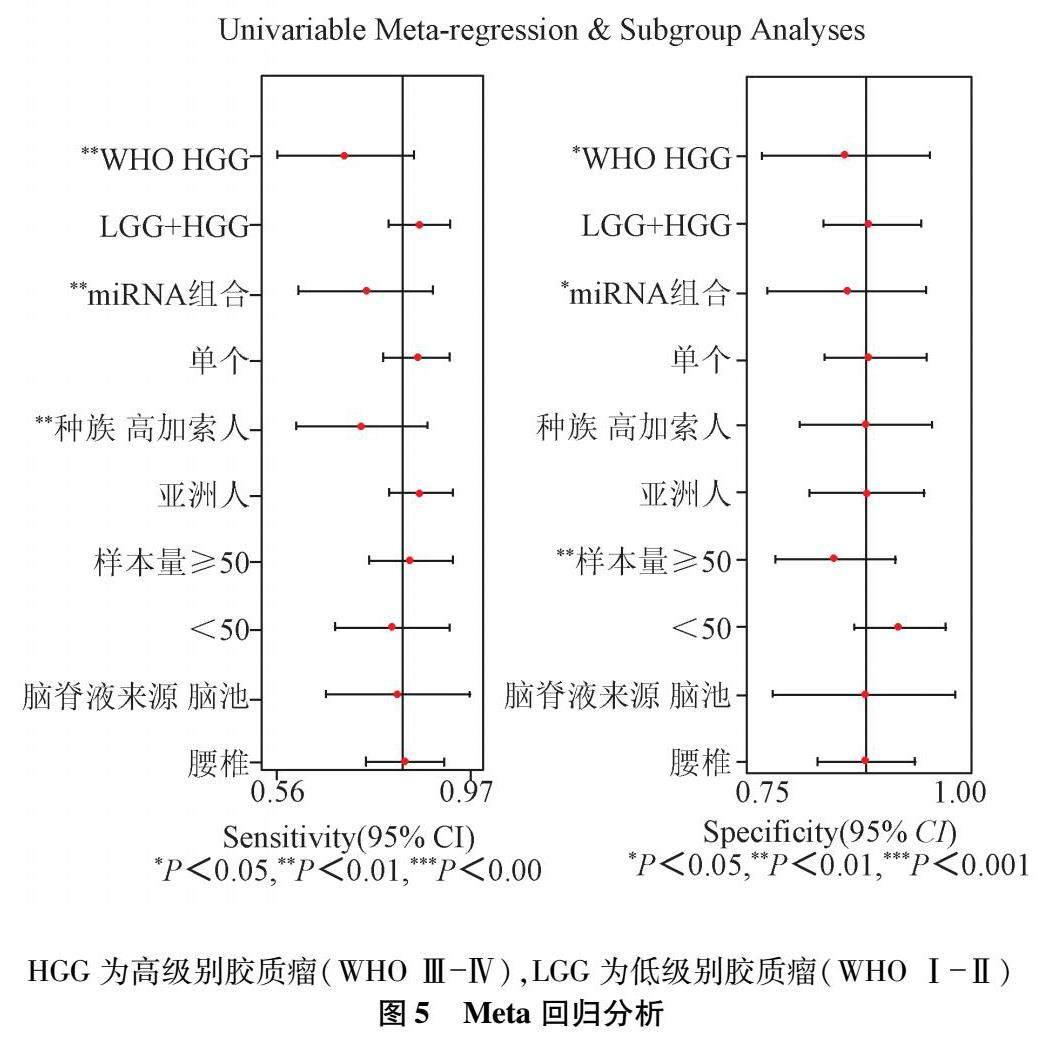
2.3 Meta回歸分析和亞組分析 為進一步探索異質性來源,基于WHO分級(HGG/LGG+HGG)、miRNA類別(組合/單個)、種族(高加索人/亞洲人)、樣本量(≥50/<50)和腦脊液來源(腦池/腰椎)進行Meta回歸分析和亞組分析。回歸分析結果顯示,WHO分級、miRNA類別、種族是靈敏度異質性的潛在來源(P均<0.01),WHO分級、miRNA類別、樣本量是特異度異質性的潛在來源(前兩者P<0.05,后者P<0.01)。見圖5。
亞組分析結果顯示:(1)基于WHO分級分組,膠質瘤組WHO級別為LGG+HGG時靈敏度和特異度的I2均較整體下降,但級別為HGG時I2較整體上升;另外,級別為LGG+HGG時具有相對高的診斷性能,靈敏度和特異度分別為(0.84∶0.70)(0.87∶0.80);(2)按miRNA類別分組,單個miRNA時靈敏度和特異度的I2均較整體下降,而組合miRNA I2較整體上升;另外,單個miRNA較組合miRNA有更高的診斷性能,靈敏度和特異度分別為(0.84∶0.73)(0.87∶0.81);(3)按種族分組,亞洲人中靈敏度和特異度的I2均較整體下降,而高加索人中I2較整體上升;另外,亞洲人中較高加索人中具有更高的靈敏度(0.84∶0.71),而特異度差異較小(0.85∶0.83);(4)按樣本量大小分組,樣本量<50或≥50時靈敏度和特異度的I2有不同程度的上升或下降;另外,樣本量<50者較≥50者特異度更高(0.92∶0.82),而靈敏度稍低(0.76∶0.81);(5)按腦脊液來源分組,腦池組中靈敏度和特異度的I2均較整體下降,而腰椎組中I2較整體上升;而診斷性能上不同腦脊液來源間差異不大。綜上,亞組分析結果提示WHO分級、miRNA類別、種族、樣本量和腦脊液來源均可能是異質性的來源,見表2。
2.4 敏感性分析 擬合優度和二元正態性分析,表明本研究的模型是可靠的。離群值檢測提示發現1項異常值即Akers等[9](b),去除異常值后,合并靈敏度為0.82(95% CI:0.78~0.86),特異度為0.84(95% CI:0.80~0.87),結果未見明顯變化,說明Meta分析結果較穩定。見圖6。
2.5 發表偏倚分析 繪制Deek's 漏斗圖評價發表偏倚,結果顯示P=0.13>0.10,提示不存在發表偏倚。見圖7。
3 討 論
目前,組織病理學檢查依然是膠質瘤診斷的金標準,影像學檢查如正電子發射斷層顯像/計算機體層攝影術(PET/CT)和磁共振成像(MRI)是診斷和監測病情的主要常規方法[14],但侵入性操作、成本過高或對診斷的能力不足等原因使之對于膠質瘤的診療仍有欠缺。近年來,液體活檢在腫瘤中顯示出巨大的臨床和研究潛力,其中,miRNAs因其可穩定地表達于血漿、尿液及其他體液中而成為疾病診斷標志物的研究熱點[15-18]。對于膠質瘤而言,與其直接接觸的腦脊液更是診斷性生物標志物的重要來源,已有諸多研究探討了腦脊液中miRNAs對于膠質瘤的診斷價值[4-12],但結果差異較大。因此,本研究總結了近年來的相關研究進行系統評價。
本研究共納入9篇文獻14項研究,累計膠質瘤患者427例,對照組423例。納入文獻整體質量中等。Meta分析結果顯示合并靈敏度、特異度、DOR、AUC分別為0.80、0.84、29.05、0.908 3,提示腦脊液中miRNAs對膠質瘤具有較高的診斷性能。對比近年其他關于miRNAs診斷膠質瘤的Meta分析,Zhou等[19]納入28篇涵蓋所有樣本來源的研究合并靈敏度、特異度分別為0.85、0.90。He等[20]納入18篇樣本來源為血液的研究合并靈敏度、特異度分別為0.84、0.84。Zhao等[21]則納入11篇關于miR-21的研究,合并靈敏度、特異度分別為0.83、0.92。本研究顯示的腦脊液中,miRNAs對于膠質瘤的診斷性能與其他樣本來源、綜合樣本來源或突出的單個miRNA相比,水平相當。
異質性檢驗提示,納入研究間存在較大的異質性,Meta回歸分析和亞組分析提示WHO分級、miRNA類別、種族、樣本量、腦脊液來源可能均是導致異質性的原因。另外,亞組分析顯示,膠質瘤組WHO級別為低級別和高級別混合者較單純高級別者、單個miRNA較組合miRNA、亞洲人較高加索人、樣本量<50者較≥50者相對具有更高的診斷性能,此結果與Zhou等[19]、 He等[20]、Zhao等[21]在不同樣本來源或miRNA類別中的亞組分析結果不同。分析異質性較大及影響本研究Meta分析結果的可能原因:(1)不同研究間納入對象的選擇除病例組WHO分級不同外,對照組的選擇也多樣,如非膠質瘤的神經系統疾病(含其他腫瘤)、非腫瘤性神經系統疾病、非腫瘤疾病等,其中Kopkova等[12]病例組和對照組則分別是膠質母細胞瘤和非膠質母細胞瘤(含低級別膠質瘤、腦膜瘤、腦轉移瘤),加之該研究樣本量大,對整體結果則會產生一定影響,而因對照組選擇過于多樣及整體納入文獻偏少未進一步基于對照組的選擇進行亞組分析;(2)各研究所檢測的miRNAs種類不一,且僅能針對是單個或組合進行亞組分析,難以按具體指標一一分析;(3)多數納入研究樣本量小;(4)納入研究的數量少,且均為病例對照研究,多數研究對于是否盲法描述不明,從而影響文獻質量。
綜上所述,腦脊液中miRNAs可以作為膠質瘤潛在的診斷標志物,但受諸多因素限制,尚需進一步開展高質量、大規模的研究,以提供更可靠的證據。
[參 考 文 獻]
[1]Ostrom QT,Bauchet L,Davis FG,et al.The epidemiology of glioma in adults:a“state of the science”review[J].Neuro Oncol,2014,16(7):896-913.
[2]Ostrom QT,Cioffi G,Gittleman H,et al.CBTRUS statistical report:primary brain and other central nervous system tumors diagnosed in the United States in 2012—2016[J].Neuro Oncol,2019,21(Suppl 5):v1-v100.
[3]Romano G,Acunzo M,Nana-Sinkam P.microRNAs as novel therapeutics in cancer[J].Cancers(Basel),2021,13(7):1526.
[4]Baraniskin A,Kuhnhenn J,Schlegel U,et al.Identification of microRNAs in the cerebrospinal fluid as biomarker for the diagnosis of glioma[J].Neuro Oncol,2012,14(1):29-33.
[5]Akers JC,Ramakrishnan V,Kim R,et al.MiR-21 in the Extracellular Vesicles(EVs) of Cerebrospinal Fluid(CSF):a platform for glioblastoma biomarker development[J].PLoS One,2013,8(10):e78115.
[6]袁平,何曉英,李小剛.腦脊液中miR-21和miR-128診斷神經膠質瘤的價值[J].國際檢驗醫學雜志,2014,35(18):2464-2465,2468.
[7]Shi R,Wang PY,Li XY,et al.Exosomal levels of miRNA-21 from cerebrospinal fluids associated with poor prognosis and tumor recurrence of glioma patients[J].Oncotarget,2015,6(29):26971-26981.
[8]Qu K,Lin T,Pang Q,et al.Extracellular miRNA-21 as a novel biomarker in glioma:evidence from meta-analysis,clinical validation and experimental investigations[J].Oncotarget,2016,7(23):33994-34010.
[9]Akers JC,Hua W,Li HY,et al.A cerebrospinal fluid microRNA signature as biomarker for glioblastoma[J].Oncotarget,2017,8(40):68769-68779.
[10]張青,仇誠,夏東彥,等.miR-221/miR-222家族在神經膠質瘤患者腦脊液中的表達及其診斷價值[J].臨床神經外科雜志,2017,14(6):401-405.
[11]錢巍,潘云青.腦脊液小分子核糖核酸210對神經膠質瘤早期診斷的研究[J].中國慢性病預防與控制,2018,26(2):143-145.
[12]Kopkova A,Sana J,Machackova T,et al.Cerebrospinal fluid microRNA signatures as diagnostic biomarkers in brain tumors[J].Cancers(Basel),2019,11(10):1546.
[13]Whiting PF,Rutjes AWS,Westwood ME,et al.QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies[J].Ann Intern Med,2011,155(8):529-536.
[14]Hu LS,Hawkins-Daarud A,Wang LJ,et al.Imaging of intratumoral heterogeneity in high-grade glioma[J].Cancer Lett,2020,477(5):97-106.
[15]Galva~o-Lima LJ,Morais AHF,Valentim RAM,et al.miRNAs as biomarkers for early cancer detection and their application in the development of new diagnostic tools[J].Biomed Eng Online,2021,20(1):21.
[16]焦婷婷,韓秋霞,張冬,等.微小RNA在糖尿病腎病中的作用機制研究進展[J].中華腎病研究電子雜志,2019,8(3):138-141.
[17]唐錦莉,嚴楓,王曉明,等.血漿miR-199a-5p與miR-200c-3p在胃腺癌中的臨床應用[J].中華檢驗醫學雜志,2015,38(6):402-406.
[18]王成,汪俊軍.細胞外囊泡miRNA作為腫瘤新型液體活檢分子指標的價值[J].中華檢驗醫學雜志,2021,44(3):250-254.
[19]Zhou Q,Liu J,Quan J,et al.MicroRNAs as potential biomarkers for the diagnosis of glioma:a systematic review and meta-analysis[J].Cancer Sci,2018,109(9):2651-2659.
[20]He JM,Jiang Y,Liu L,et al.Circulating microRNAs as promising diagnostic biomarkers for patients with glioma:a meta-analysis[J].Front Neurol,2021,11(2):610163.
[21]Zhao XL,Xiao ZH,Li B,et al.miRNA-21 may serve as a promising noninvasive marker of glioma with a high diagnostic performance:a pooled analysis of 997 patients[J].Ther Adv Med Oncol,2021,13(1):1758835920987650.
(收稿2021-07-27 修回2021-12-03)