宰后肌肉嫩度檢測技術研究進展
狄雨晗 廖博群 李加慧 張雅瑋
摘 要:嫩度作為評價肉品品質的重要指標之一,影響消費者對于肉制品的購買選擇。對宰后肉品的組成結構、蛋白特性進行檢測,可以準確判定肉品嫩化程度。本文就宰后成熟過程中各類肌肉蛋白質的變化及其嫩化作用、現有檢測技術及相關機理進行綜述,討論目前技術存在的局限性,為研發新型嫩度檢測技術提供理論參考。
關鍵詞:肌肉蛋白質;檢測技術;肉的嫩度;肉品質;宰后嫩化
Advances in Techniques for Testing Postmortem Muscle Tenderness
DI Yuhan, LIAO Boqun, LI Jiahui, ZHANG Yawei*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: Tenderness is one of the most important indicators of meat quality and influences consumers choice of meat products. Meat tenderness can be determined accurately by testing the composition, structure and protein characteristics of postmortem meat. This paper presents a review of the changes in various muscle proteins during postmortem aging, their roles in meat tenderization, the existing detection techniques for meat tenderness and the related mechanisms, and discusses the limitations of the current techniques. It is hoped that this review will provide a theoretical reference for the development of new tenderness detection techniques.
Keywords: muscle proteins; detection techniques; meat tenderness; meat quality; postmortem tenderization
DOI:10.7506/rlyj1001-8123-20230509-041
中圖分類號:TS251.1? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼:A 文章編號:1001-8123(2023)07-0052-08
引文格式:
狄雨晗, 廖博群, 李加慧, 等. 宰后肌肉嫩度檢測技術研究進展[J]. 肉類研究, 2023, 37(7): 52-59. DOI:10.7506/rlyj1001-8123-20230509-041.? ? http://www.rlyj.net.cn
DI Yuhan, LIAO Boqun, LI Jiahui, et al. Advances in techniques for testing postmortem muscle tenderness[J]. Meat Research, 2023, 37(7): 52-59. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230509-041.? ? http://www.rlyj.net.cn
肉品的食用品質可以通過感官評定和客觀測定的方法進行評價,通過檢測肉品嫩度、風味、色澤和多汁性等指標,反映肉品食用價值[1]。嫩度作為評價肉質優劣及優質畜禽肉選種的重要指標,展現了肌肉組織的機械強度,包括蛋白質的結構特性、脂肪的數量及分布等[2-4]。
研究影響嫩度的關鍵因子、檢測技術以及提高肉品嫩度是國內外肉品加工科學的研究熱點之一。肉品嫩度受到宰前因素和宰后因素的共同影響,宰前因素包括畜禽品種、年齡、性別、飼養條件及宰前狀況等;動物宰后處理過程中的影響因素包括排酸時間、貯藏溫度、嫩化技術及烹調方式等[5-8]。肉品在宰后成熟的過程中會發生一系列復雜的生化反應,肉的嫩化是鈣激活酶、細胞凋亡酶、過氧化物還原酶等多種內源酶共同調控的結果[9-12],多種酶的共同作用使得肌原纖維蛋白發生降解,網狀結構消失[13]。因此,深入研究宰后肌肉蛋白質的變化是理解肉品嫩化機制的關鍵。
借助現代儀器對肌肉的物理、生化和組織結構進行檢測,能夠客觀、定量化地評定肉品嫩度[14]。常見的嫩度測定方法包括剪切力法、光譜分析、質地剖面分析(texture profile analysis,TPA)等,這些傳統檢測方法也存在一定局限性。例如,剪切力法是最早、最常用的機械測定方法[1],但也存在難以區分不同處理組間肌肉嫩度差異的問題[15-17]。關于宰后肉品嫩度的檢測技術很多,綜合國內外學者的相關研究,本文就有關反映肌肉蛋白質變化的嫩度檢測技術及其原理等方面進行綜述,為改進和開發肉品嫩度檢測技術提供思路。
1 宰后成熟過程中肌肉蛋白質的變化對嫩度的影響
1.1 肉的嫩度
畜禽宰后會發生由僵直、解僵到成熟一系列復雜的生理生化反應過程,肌肉組織的生化條件會發生較大轉變。宰后早期肉品逐步進入僵直階段,肌纖維收縮導致肌節長度明顯減小,肌球蛋白和肌動蛋白交聯導致硬度明顯增大[18-19],嫩度降低。僵直持續時間受到三磷酸腺苷(ATP)、糖原儲備等因素的影響[20],在僵直結束時肉品達到極限pH值,肉品嫩度最小,口感最差。隨著肌肉解僵進入成熟期,維持肌原纖維完整性的關鍵蛋白質,如肌聯蛋白、伴肌動蛋白等被鈣蛋白酶降解[21],肌肉超微結構受到破壞,大部分Z線斷裂,M線和I帶消失[22],H區模糊難辨,肌原纖維小片化程度增加,肉品持水能力和嫩度增加。針對肉品成熟機制,有學者提出四大成熟理論:鈣蛋白酶理論、溶酶體組織蛋白酶理論、細胞凋亡酶理論和蛋白酶體理論,其中鈣蛋白酶理論在大量研究中得到了更多學者的認可,鈣蛋白酶也被認為在降解宰后肌肉蛋白質的過程中起到主導作用[23-24]。
1.2 肌肉蛋白質的嫩化作用
骨骼肌由肌纖維、結締組織、肌內脂肪細胞、血管和神經組織組成[25],其中水約占75%,蛋白質約占19%[26]。肌肉中的蛋白質主要分為三大類:肌原纖維蛋白、結締組織蛋白和肌漿蛋白。肌原纖維蛋白占總蛋白含量的一半以上,是影響肉品品質的重要因素之一;結締組織蛋白在肌肉中起到結構支撐作用,因此對肉品嫩度也有較大影響。
肌纖維作為骨骼肌結構的組成單位,是成束排列的多核條帶狀細胞。大量研究表明,肌纖維特性與肉品嫩度密切相關[27-29],肌纖維類型(Ⅰ型和Ⅱ型)及其完整性、肌纖維蛋白的降解、肌纖維直徑、肌節長度和收縮狀態等均會影響嫩度。肌原纖維占肌纖維含量的65%左右,每條肌原纖維由許多平行排列的肌球蛋白粗絲和肌動蛋白細絲構成。目前研究表明,在肉品成熟過程中,肌原纖維的關鍵蛋白質水解是肉品嫩化的主要原因,這些關鍵蛋白質在維持肌原纖維結構中起到重要作用,例如,肌間線蛋白參與肌原纖維間的連接,肌聯蛋白和伴肌動蛋白參與肌原纖維內的連接等[23,30]。通過電子顯微鏡觀察肉品的超微結構,如肌原纖維的排列情況、肌原纖維中肌節、A帶、I帶、Z線、H區的清晰程度,可以判斷肉品成熟程度。
肌肉中的結締組織以肌外膜、肌束膜和肌內膜的結構形式存在,在維持肌肉結構完整性方面起到關鍵作用[31-32]。結締組織蛋白包括膠原蛋白、彈性蛋白、網狀蛋白和糖蛋白,結締組織中還含有少量起到連接作用的蛋白多糖[33-34]。膠原蛋白作為結締組織的主要組成成分,其含量、熱溶解性、蛋白交聯程度等均會對肉品嫩度產生影響[35],牛肉嫩度與膠原蛋白含量和交聯程度呈負相關[36-37],而與膠原蛋白熱溶解性呈正相關[38]。
宰后成熟過程中,早期肌原纖維蛋白發生降解,肌原纖維結構弱化,肉品處于快速嫩化階段;成熟階段后期肉品處于慢速嫩化階段,肌束膜和肌內膜組織結構破壞,結締組織結構發生弱化[39-40]。肌漿蛋白中包括大多數與糖酵解有關的酶,如丙酮酸激酶、磷酸丙糖異構酶等,這些蛋白的磷酸化水平與肌肉嫩度密切相關[41],磷酸化水平越高越不利于肉的嫩化。Carlson等[42]研究發現,過氧化物還原酶2等應激反應蛋白在氧化應激中的含量變化也可能會對豬肉嫩度產生影響,應激反應蛋白含量升高會導致肉嫩度的降低。
2 肉嫩度檢測技術
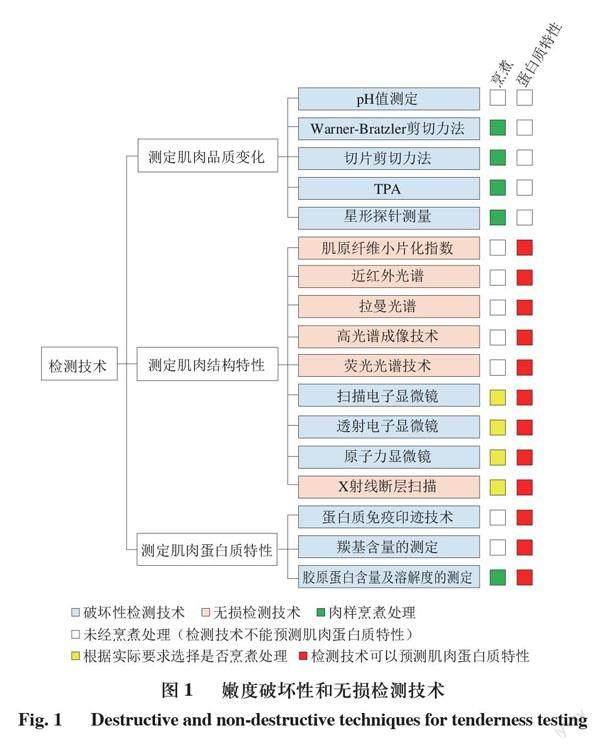
嫩度能夠反映肉的質地,以及肉在食用時的口感[43],是肉品質評價的重要指標之一。肌原纖維的結構和狀態會導致嫩度的差異,肌內結締組織的含量和性質決定了肉的硬度[1],因此針對肌內蛋白質對肉品的嫩化作用,可以從觀察質構、持水性等肉品品質變化、組成結構以及肌肉蛋白特性的角度進行研究(圖1),開發肉嫩度的檢測方法。下文選取了部分具有代表性的用于嫩度測定的常用檢測技術,并對其基本原理和應用進行描述。
2.1 測定肌肉品質變化
2.1.1 pH值測定
pH值常用作評價肉品質的重要指標之一,其能夠直接影響肉的風味、嫩度、持水性等品質[44]。宰后早期肌肉細胞通過糖酵解途徑產生乳酸,ATP水解產生磷酸,引起pH值下降[45]。pH值變化的程度和速率會影響嫩度、持水力等肉品品質[46],pH值的降低會導致肌原纖維收縮,鈣蛋白酶活性降低,影響蛋白質的降解程度,從而影響肉品嫩度[47]。在宰后成熟過程中,肉品pH值會隨著貯藏時間的延長先快速降低到極限pH值,再緩步上升達到穩定狀態,整體仍呈現下降趨勢。由于畜禽種類、測量部位、屠宰條件的不同會導致蛋白水解、能量代謝等情況的差異,因此同一宰后時間肉品的pH值也會存在一定差異,但總體趨勢不會發生變化[48]。
pH值的測定通常使用pH檢測儀,在經4 ℃校準液校準后,將電極沿肌原纖維方向插入樣品內部或加入緩沖液將樣品勻漿,平行重復測定,記錄最終數值[49-50]。在測定過程中,由于宰后早期pH值下降較快,應當注意時間的把控,避免檢測時間過長導致數據誤差過大,以牛肉為例,一般牛肉的檢測時間為0、6、12、24、48、72、120 h。
近年來,研究學者通過檢測宰后肉品pH值的變化,分析肌肉中能量代謝過程中的關鍵因子。Schulte等[51]指出,鈣蛋白酶-1自溶和肌間線蛋白降解越多,到達極限pH值的速度越快。糖酵解速率的升高將加速pH值下降速率。Wang Chengcheng等[52]通過動力學研究模型,發現磷酸果糖激酶將加速宰后豬肉pH值的降低速率。
2.1.2 剪切力法
最常用的剪切力測定儀器為Warner-Bratzler剪切儀,用于測量切割一定厚度的肉柱所需力的大小[1]。常見的剪切力測定方法還有切片剪切力法等。最早的肉類剪切力測定標準由美國肉類科學協會制定[53]。剪切儀的使用是在樣品中插入熱電偶溫度計,水浴加熱至肉樣中心溫度為70~72 ℃時取出,流水冷卻或自然冷卻至室溫后平行于肌原纖維方向取肉柱,再用剪切力測試儀沿肌纖維垂直方向進行剪切,記錄峰值,重復測量取
均值[54]。切割速度及V型切割刀片的夾角大小會影響剪切力[55],為了提高實驗的重復性和準確性,每組至少取6 個直徑相同的肉柱進行檢測[56]。不過剪切力法仍會受到肌肉類型、烹飪方式、設備差異等干擾因素的影響,造成一定的誤差[57]。
剪切力和肉嫩度呈負相關,隨著宰后時間的延長,剪切力整體上呈先增大后減小的趨勢,其下降幅度大于上升幅度[58]。宰后成熟過程中,在內源性蛋白酶系統和微生物的作用下,肌肉中的肌原纖維蛋白發生降解,剪切力下降。肉的嫩度可直觀表現為肉品在咀嚼時牙齒所用力的大小,Warner-Bratzler剪切力(Warner-Bratzler shear force,WBSF)是最常用的將肉品嫩度進行量化的檢測方法[59]。將WBSF與感官評價方法結合是目前研究的熱點,通過可量化數據與感官評分進行比較分析可以確定肉品可接受嫩度的閾值[60]。Silva等[61]研究發現,用方形橫截面芯的WBSF測量方法在檢測肉品嫩度中的效果較使用圓形橫截面芯的Warner-Bratzler剪切儀更好,表明剪切儀的特性也會影響嫩度的檢測效果,這也為進一步改進嫩度檢測儀器與檢測方法提供了一定的方向和思路。
2.1.3 TPA
TPA廣泛應用于各類食品的質構分析,包括果蔬制品、面制品、肉制品等。通過模仿咀嚼過程,能夠客觀反映食品硬度、黏性、內聚性、彈性、咀嚼性和回復性等質構指標[62],能夠較為全面衡量肉的質地特性。實驗方法參照NY/T 1180—2006《肉嫩度的測定 剪切力測定法》[62],用質構儀進行測定即可。魏直升等[63]通過研究不同部位牛肉在宰后成熟過程中的品質特性,發現宰后成熟能夠改善肉的質構,且由于測量部位、肉品成熟時間等因素的不同,肌纖維類型及肌纖維蛋白的降解模式存在差異,對質構特性結果存在一定影響。
TPA是常見的用于食品質地評估的方式,de Huidobro等[64]在研究中發現,TPA與WBSF相比,能夠更好地預測感官特性中的硬度。TPA和WBSF作為2 種公認有效的食品機械評估方式,TPA能夠模擬食物在口腔咀嚼時的變化,WBSF能夠模擬最佳的切割效果。目前越來越多的研究關注于儀器測定指標(TPA和WBSF)與感官評定測定數據間的相關性分析,TPA能夠提供更全面的量化參數進行嫩度預測,且TPA的成本和耗時相較于感官評定更低。不過基于食品機械屬性的食品質地評估也存在一定的局限性,由于受到主觀因素的影響,TPA所測量參數不能完全代表食物在口腔中的真實口感,測量結果也會受到材料機械性能的影響[65-66]。
2.2 測定肌肉結構特性
2.2.1 光譜檢測技術
常用于食品分析的光譜檢測技術包括近紅外光譜(near infrared spectroscopy,NIRS)、拉曼光譜、高光譜成像技術、熒光光譜技術等。光譜檢測技術可以深入了解食品的組成結構、分子間相互作用及各向異性。NIRS分析廣泛應用于肉嫩度檢測中,其根據吸收峰在光譜中的位置和強度進行定性和定量分析,可以測得肌肉的基本成分,如水、蛋白質、脂肪、灰分和結締組織含量。
近年來,研究人員將NIRS在肉類研究中的應用進行擴展,不僅用于肉品成分分析,還通過建立預測模型預測肉品質量。de Nadai Bonin等[67]通過偏最小二乘回歸模型成功預測剪切力和嫩度;Tejerina等[68]利用NIRS進行肉質分級,其設計的近紅外定量預測模型在肉品色度和色相角中表現出良好的預測效果;Balage等[69]通過可見光/NIRS(Vis/NIRS)技術預測豬肉樣品的最終pH值和顏色等品質指標。一些研究報告也指出,NIRS在預測肉的質量性狀方面仍存在一定的缺陷,Balage等[69]研究發現,Vis/NIRS在定量預測豬肉肌內脂肪方面效果較差,WBSF預測的準確性較低。目前近紅外檢測技術在肉品品質檢測方面仍存在一定的局限性,需要進一步的研究來建立更加精準的預測模型。
2.2.2 肌原纖維小片化指數(myofibril fragmentation index,MFI)
MFI是評估肌肉肌原纖維超微結構變化的關鍵指標,可直接反映肌原纖維的降解程度,并間接反映受肌原纖維蛋白降解影響的新鮮肉嫩度。通常情況下,MFI越高,表明肌原纖維結構破壞程度越高,肉品的嫩度越好。MFI的檢測步驟較為復雜,耗時較長,需要精確稱取樣品(少量),進行2 次離心,控制實驗溫度,在得到肌原纖維蛋白懸濁液后采用考馬斯亮藍法或雙縮脲法測定溶液的蛋白質量濃度,再經調整蛋白質量濃度后測定吸光度[49]。除肉樣自身因素外,MFI也會受到勻漿速率、刀片類型等其他均質條件的影響[67]。MFI一般在540 nm波長處進行吸光度測定[70-71]。肉品在宰后成熟過程中,MFI持續升高,表明其Z線蛋白發生降解,肌原纖維細胞凋亡,嫩度升高。
MFI是測定宰后早期肉嫩度的有效工具,研究學者發現,其與WBSF之間存在顯著的正相關性(P<1.8)[72]。Aroeira等[73]研究發現,肌原纖維的碎裂程度還可以通過WBSF、MFI等不同方法來進行檢測,目前大部分學者將MFI作為肉嫩度的檢測指標之一。在未來的研究中,可以對MFI與嫩化相關的蛋白質表達量進行相關性分析,篩選出影響MFI的關鍵蛋白質,研究其在蛋白質降解和細胞凋亡中發揮的作用,對于幾種關鍵蛋白間的協同作用也可進行進一步的研究。
2.2.3 成像技術
肉中蛋白質、脂肪的分布會直接影響肉品嫩度。宰后成熟期間,肌肉蛋白質的降解會導致肌纖維結構發生改變,成像技術能夠直接觀察肌肉纖維微觀結構以及肌肉蛋白質的變化。目前常見的成像技術包括透射電子顯微鏡(transmission electron microscopy,TEM)、掃描電子顯微鏡(scanning electron microscope,SEM)、原子力顯微鏡、X射線斷層掃描等,這些技術能夠快速、直觀地得到不同長度尺度的圖像,但與NIRS等光譜技術相比,這些成像技術的缺陷是需要制備大量樣品且通常對樣品具有一定的破壞性[57]。
SEM可以揭示肉類結構中與過程相關的變化,SEM在明場不同視線下拍取樣品圖像,用圖像處理軟件測定肌原纖維直徑(myofibril diameter,MYD)、肌原纖維間距(myofibril spacing,MYS)、肌纖維直徑(muscle fibre diameter,MFD)、肌纖維間距(muscle fibre spacing,MFS)、肌節長度(sarcomere length,SL)等指標[74],觀察肌肉表面結構變化、肌纖維分離以及收縮和舒張狀態等情況。當纖維束結構變得松散,肌纖維間密度降低時,會引起肌肉硬度和剪切力下降,肉品持水性部分降低,蒸煮損失率增加,肉品嫩度增加[75]。Nishimura等[76]通過SEM觀察肌內結締組織(intramuscular connective tissue,IMCT)結構的變化,證實IMCT的降解有助于豬肉在宰后成熟期間嫩度的提高。Soji等[77]將測得的MYD、MYS、MFD、MFS、SL與WBSF進行相關性分析,確定肌纖維束特征對提高肉嫩度具有正向作用。
TEM能夠提供有關肉類內部結構的信息,通過TEM能夠觀察到由肌原纖維蛋白降解引起的肌原纖維中Z盤和M線的超微結構變化,觀察肌原纖維排列,肌原纖維中肌節、A帶、I帶、Z線、M線的長度、寬度及清晰程度。在宰后成熟過程中,肌原纖維結構受損嚴重,大部分Z線扭曲斷裂,H區模糊難辨,明暗帶邊界消失。當Z線明顯斷裂、肌節長度縮小時,肌肉發生自溶[78]。
SEM和TEM作為研發早、使用廣泛的成像技術,揭示了肉品微觀結構中的重要信息。近年來,研究者通過將激光、紅外光譜等技術與顯微鏡進行結合開發了適用范圍更廣、精確度更高的成像技術。例如,朱瑤迪等[79]基于高光譜成像和激光共聚焦顯微鏡技術進行豬肉嫩度的快速測定;環境掃描電子顯微鏡能夠減少溶液對顯示圖像的影響,應用于觀察各類肌肉的微觀結構[80]。
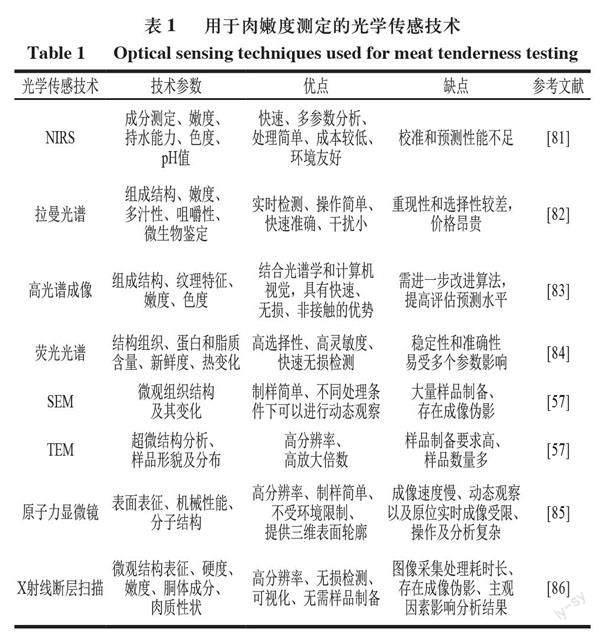
用于肉嫩度測定的光學傳感技術如表1所示。
2.3 測定肌肉蛋白質特性
2.3.1 免疫印跡技術(Western blotting,WB)
肌肉宰后成熟過程中肌纖維蛋白和結締組織蛋白發生降解,其中肌鈣蛋白-T和肌間線蛋白是導致肌肉成熟過程中嫩度變化最關鍵的蛋白質[87]。通過免疫印跡技術檢測關鍵蛋白的降解程度差異可以判斷肉的嫩化進程,從而確定肉的嫩度。WB是檢測蛋白質和蛋白質翻譯后修飾的常用方法,將十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)和酶聯免疫技術結合,可以在簡單或復雜的生物樣本中對相關目的蛋白進行半定量或定量分析檢測[88-89]。
WB作為一門新興的肉嫩度檢測手段,在蛋白質組學研究中得到廣泛應用。Onopiuk等[71]使用SDS-PAGE和WB評估牛肉pH值、肌節長度、MFI、WBSF等數據,并觀測到MFI與WBSF和肌鈣蛋白T降解值密切相關。孫金龍等[90]通過聚丙烯酰胺變性凝膠電泳和免疫印跡分析方法檢測到宰后肉品成熟過程中熱休克蛋白對肌原纖維降解的抑制作用。WB具有高分辨率、高敏感性和特異性的特點,能夠同時對不同蛋白質進行定性和定量比較,也可用于微量級蛋白質的檢測分析。但該技術涉及一系列復雜且連續的操作步驟,需要先通過SDS-PAGE將蛋白質進行分離,電泳后將分離的蛋白質轉移到固相載體(聚偏氟乙烯膜或硝酸纖維素膜)上,再使用抗體進行分析,以進行特異性蛋白質檢測[91]。實驗結果會受到實驗設計及操作精度的影響,包括樣品上樣量、樣品分級分離等因素,因此如何提升檢測結果的精密度和重現性也是該研究領域持續關注的問題[92]。Murphy等[93]提出,少量上樣可以更好地檢測低表達量蛋白,使蛋白質印跡結果更加可靠。
2.3.2 羰基含量的測定
在宰后肉類貯藏和加工過程中常會發生蛋白質氧化,研究表明,蛋白質的氧化作用是影響肉嫩度的重要因素之一[94]。蛋白質的氧化損傷會使氨基酸殘基中衍生出羰基化合物,而羰基化通常被認為是氧化蛋白質中最顯著的化學修飾之一[95],因此羰基含量也常被作為評估蛋白質氧化和鑒定蛋白質嫩化作用的可靠指標。
隨著宰后貯藏時間的延長,肌肉中羰基含量呈整體上升趨勢。肌肉中蛋白質的氧化作用對肉嫩度的影響是復雜的。Chen Qianqian等[96]研究發現,蛋白質氧化可以通過抑制蛋白水解酶(特別是μ-鈣蛋白酶)的活性來降低肌原纖維蛋白的降解程度,不利于肉的嫩化。然而,Malheiros等[94]研究發現,活性氧的產生可能導致肌原纖維蛋白的損傷并激活蛋白酶體,可能有助于結構蛋白的降解,從而提高肉嫩度。Lei Yongdong等[97]通過觀察氧化作用對不同肌原纖維蛋白降解的影響,發現隨著氧化程度的增加,肌動蛋白降解程度增加,肌鈣蛋白-T和肌間線蛋白的降解受到抑制。因此,目前從蛋白組學角度證明不同類別蛋白質的氧化修飾作用對肌肉嫩度的影響尚未達成共識,仍有待進一步研究。
2.3.3 膠原蛋白含量及溶解度測定
膠原蛋白是結締組織的重要組成部分,膠原蛋白的含量及溶解度會影響肉的質構,從而影響肉品嫩度,因此測定膠原蛋白含量及其溶解度對于檢測肉品嫩度、判斷嫩度影響因素具有重要作用。膠原蛋白中的羥脯氨酸含量相對穩定,占總蛋白質的13%~14%,因此生肉樣品中總膠原蛋白含量可以通過羥脯氨酸含量進行確定。生肉中的膠原蛋白含量受性別和動物年齡等因素的影響,膠原蛋白溶解度受性別、品種和動物年齡等因素的影響[98]。
膠原蛋白溶解度可以通過測量肉品中總膠原蛋白和可溶性膠原蛋白的含量來獲得[99]。肌內結締組織中蛋白質在肉嫩化中發揮的作用一直是許多研究的重點。目前Li Xiying等[100]通過薈萃分析建立統計學模型,確定膠原蛋白含量及溶解度對嫩度的影響,研究發現,膠原蛋白特性與肉嫩度的關系受到物種因素的影響,僅在牛肉中可以觀察到其膠原蛋白特性與嫩度的顯著相關性,在豬肉和羊肉中膠原蛋白特性與嫩度屬性之間的相關性不顯著。Torrescano等[101]對肌肉剪切力及膠原蛋白特性的關系進行研究,指出膠原蛋白總量和剪切力的相關性受到肉狀態的影響,二者在生肉中呈現很強的正相關性,在熟肉中相關性較低。Zheng Yanyan等[102]對不同類型膠原蛋白的熱誘導效應進行評估,發現Ⅰ型膠原蛋白的降解是熟豬肚質構改善的主要原因,可能對肌肉嫩度產生影響。在肉的蒸煮過程中,研究者也通過提高烹飪溫度、延長加熱時間、真空低溫烹調等方法改變膠原蛋白溶解程度和結締組織強度,以提高肉品食用品質,改善肉嫩度[103-104]。
3 結 語
嫩度作為評價肉品食用品質的重要指標之一,會影響消費者的選擇。在宰后成熟過程中,肌肉蛋白質的一系列變化會對肉的結構及品質產生較大影響。嫩度可以通過感官評定和儀器分析的方式進行檢測,在研究中將感官評定和儀器分析相結合進行相關性分析可以使檢測結果更加全面、客觀。在進行嫩度測定時,使用多樣化的檢測技術,如質構測定、NIRS分析、免疫印跡技術等,對肌肉的品質變化、組成結構及蛋白質特性進行分析,能夠找到影響肉嫩度的關鍵因素并進行肉質判定。不過目前現有檢測技術也存在一定的局限性,如操作復雜、可重復性低、破壞性檢測等。因此,有必要在現有嫩度檢測技術的基礎上進行改進完善,開發新型肉品嫩度無損檢測技術,并結合數學模型及統計學模型進行分析,實現智能化、精確化檢測。
參考文獻:
[1] 周光宏, 李春保, 徐幸蓮. 肉類食用品質評價方法研究進展[J]. 中國科技論文在線, 2007(2): 75-82.
[2] 丁武, 寇莉萍, 張靜, 等. 質構儀穿透法測定肉制品嫩度的研究[J]. 農業工程學報, 2005(10): 138-141.
[3] 崔薇, 邱燕, 陳韜. 宰后肌肉蛋白質變化與嫩度的關系[J]. 肉類研究, 2009, 23(4): 7-9.
[4] 葛慶聯, 章雙杰, 呂曉娟, 等. 禽肉嫩度檢測方法的探討[J]. 中國家禽, 2007(14): 15-17. DOI:10.16372/j.issn.1004-6364.2007.14.001.
[5] 時海波, 諸永志, 方芮, 等. 宰后肉品嫩化技術及其作用機理研究進展[J]. 食品科學, 2020, 41(23): 311-321. DOI:10.7506/spkx1002-6630-20191106-075.
[6] 張宏博. 宰前因素和宰后處理對商品豬生長發育、屠宰及胴體質量和豬肉品質影響的研究[D]. 呼和浩特: 內蒙古農業大學, 2015: 39-80.
[7] 曹憲福, 楊志成, 姜廷波, 等. 肌肉嫩度的影響因素分析[J]. 黑龍江畜牧獸醫, 2016(21): 60-63. DOI:10.13881/j.cnki.hljxmsy.2016.2085.
[8] 王頌萍, 王雪羽, 楊欣悅, 等. 超聲波技術嫩化機理及其在肉制品中應用效果的研究進展[J]. 食品工業科技, 2022, 43(9): 423-431. DOI:10.13386/j.issn1002-0306.2021040166.
[9] 張坤, 王道營, 張淼, 等. 高強度超聲對鵝胸肉嫩度及品質的影響[J].?食品科學, 2018, 39(15): 122-127. DOI:10.7506/spkx1002-6630-201815018.
[10] HUANG Feng, HUANG Ming, ZHOU Guanghong, et al. In vitro proteolysis of myofibrillar proteins from beef skeletal muscle by caspase-3 and caspase-6[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17): 9658-9663. DOI:10.1021/jf202129r.
[11] 王新怡, 張一敏, 梁榮蓉, 等. 過氧化物氧化還原酶6調控肉品嫩度的研究進展[J]. 食品科學, 2021, 42(11): 236-243. DOI:10.7506/spkx1002-6630-20200427-355.
[12] HUANG Ming, HUANG Feng, MA Hanjun, et al. Preliminary study on the effect of caspase-6 and calpain inhibitors on postmortem proteolysis of myofibrillar proteins in chicken breast muscle[J]. Meat Science, 2012, 90(3): 536-542. DOI:10.1016/j.meatsci.2011.09.004.
[13] KOOHMARAIE M, SEIDEMANN S C, SCHOLLMEYER J E, et al.?Effect of post-mortem storage on Ca2+-dependent proteases, their inhibitor and myofibril fragmentation[J]. Meat Science, 1987, 19(3): 187-196. DOI:10.1016/0309-1740(87)90056-8.
[14] SEIDEMAN S C. Methods of expressing collagen characteristics and their relationship to meat tenderness and muscle fiber types[J]. Journal of Food Science, 1986, 51(2): 273-276. DOI:10.1111/j.1365-2621.1986.tb11107.x.
[15] KING D A, WHEELER T L, SHACKELFORD S D, et al. Comparison of palatability characteristics of beef Gluteus medius and Triceps brachii muscles[J]. Journal of Animal Science, 2009, 87(1): 275-284. DOI:10.2527/jas.2007-0809.
[16] RHEE M S, WHEELER T L, SHACKELFORD S D, et al. Variation in palatability and biochemical traits within and among eleven beef muscles[J]. Journal of Animal Science, 2004, 82(2): 534-550.
[17] SHACKELFORD S D, WHEELER T L, KOOHMARAIE M. Relationship between shear force and trained sensory panel tenderness ratings of 10 major muscles from Bos indicus and Bos taurus cattle[J]. Journal of Animal Science, 1995, 73(11): 3333-3340. DOI:10.2527/1995.73113333x.
[18] WHEELER T L, KOOHMARAIE M. Prerigor and postrigor changes in tenderness of ovine Longissimus muscle[J]. Journal of Animal Science, 1994, 72(5): 1232-1238. DOI:10.2527/1994.7251232x.
[19] ERTBJERG P, PUOLANNE E. Muscle structure, sarcomere length and influences on meat quality: a review[J]. Meat Science, 2017, 132: 139-152. DOI:10.1016/j.meatsci.2017.04.261.
[20] JEACOCKE R E. The kinetics of rigor onset in beef muscle fibres[J]. Meat Science, 1984, 11(4): 237-251. DOI:10.1016/0309-1740(84)90055-X.
[21] ILIAN M A, BEKHIT A E, BICKERSTAFFE R. The relationship between meat tenderization, myofibril fragmentation and autolysis of calpain 3 during post-mortem aging[J]. Meat Science, 2004, 66(2): 387-397. DOI:10.1016/S0309-1740(03)00125-6.
[22] TANABE R, TATSUMI R, TAKAHASHI K. Purification and characterization of the 1 200 kDa subfragment of connectin filaments produced by 0.1 mmol/L calcium ions[J]. The Journal of Biochemistry, 1994, 115(2): 351-355. DOI:10.1093/oxfordjournals.jbchem.a124341.
[23] KOOHMARAIE M, KENT M P, SHACKELFORD S D, et al. Meat tenderness and muscle growth: is there any relationship?[J]. Meat Science, 2002, 62(3): 345-352. DOI:10.1016/ S0309-1740(02)00127-4.
[24] BASSON A, STRYDOM P E, VAN MARLE-K?STER E, et al. Sustained effects of muscle calpain system genotypes on tenderness phenotypes of South African beef bulls during ageing up to 20 days[J]. Animals, 2022, 12(6): 686. DOI:10.3390/ani12060686.
[25] J?RVINEN T A H, J?RVINEN T L N, K??RI?INEN M, et al.?Muscle injuries: biology and treatment[J]. The American Journal of Sports Medicine, 2005, 33(5): 745-764. DOI:10.1177/ 0363546505274714.
[26] LEFAUCHEUR L. A second look into fibre typing: relation to meat quality[J]. Meat Science, 2010, 84(2): 257-270. DOI:10.1016/j.meatsci.2009.05.004.
[27] BROOKE M H, KAISER K K. Muscle fiber types: how many and what kind?[J]. Archives of Neurology, 1970, 23(4): 369-379. DOI:10.1001/archneur.1970.00480280083010.
[28] 王勇峰, 豐永紅, 萬紅兵, 等. 新疆褐牛不同部位牛肉肌纖維類型及品質差異研究[J]. 食品工業科技, 2018, 39(6): 19-24; 37. DOI:10.13386/j.issn1002-0306.2018.06.004.
[29] OKITANI A, ICHINOSE N, ITOH J, et al. Liberation of actin from actomyosin in meats heated to 65 ℃[J]. Meat Science, 2009, 81(3): 446-450. DOI:10.1016/j.meatsci.2008.09.008.
[30] WATERMAN-STORER C M. The cytoskeleton of skeletal muscle: is it affected by exercise? A brief review[J]. Medicine and Science in Sports and Exercise, 1991, 23(11): 1240-1249.
[31] 常海軍, 徐幸蓮, 周光宏. 肌內結締組織與肉嫩度關系研究[J]. 肉類研究, 2009, 23(7): 9-14.
[32] 常海軍, 王強, 徐幸蓮, 等. 肌內膠原蛋白與肉品質關系研究進展[J]. 食品科學, 2011, 32(1): 286-290.
[33] 李春保. 牛肉肌內結締組織變化對其嫩度影響的研究[D]. 南京: 南京農業大學, 2006: 15-21.
[34] WHEELER T L, SHACKELFORD S D, KOOHMARAIE M. Variation in proteolysis, sarcomere length, collagen content, and tenderness among major pork muscles[J]. Journal of Animal Science, 2000, 78(4): 958-965.
[35] LEPETIT J. A theoretical approach of the relationships between collagen content, collagen cross-links and meat tenderness[J]. Meat Science, 2007, 76(1): 147-159. DOI:10.1016/j.meatsci.2006.10.027.
[36] BURKE R M, MONAHAN F J. The tenderisation of shin beef using a citrus juice marinade[J]. Meat Science, 2003, 63(2): 161-168. DOI:10.1016/S0309-1740(02)00062-1.
[37] CHANG Haijun, XU Xinglian, ZHOU Guanghong, et al. Effects of characteristics changes of collagen on meat physicochemical properties of beef Semitendinosus muscle during ultrasonic processing[J]. Food and Bioprocess Technology, 2012, 5(1): 285-297. DOI:10.1007/s11947-009-0269-9.
[38] KIM H, CHOI Y, CHOI J, et al. Tenderization effect of soy sauce on beef M. biceps femoris[J]. Food Chemistry, 2013, 139(1): 597-603. DOI:10.1016/j.foodchem.2013.01.050.
[39] NISHIMURA T, HATTORI A, TAKAHASHI K. Relationship between degradation of proteoglycans and weakening of the intramuscular connective tissue during post-mortem ageing of beef[J]. Meat Science, 1996, 42(3): 251-260. DOI:10.1016/0309-1740(95)00051-8.
[40] NISHIMURA T, HATTORI A, TAKAHASHI K. Structural weakening of intramuscular connective tissue during conditioning of beef[J]. Meat Science, 1995, 39(1): 127-133. DOI:10.1016/0309-1740(95) 80014-X.
[41] ANDERSON M J, LONERGAN S M, HUFF-LONERGAN E. Differences in phosphorylation of phosphoglucomutase 1 in beef steaks from the Longissimus dorsi with high or low star probe values[J]. Meat Science, 2014, 96(1): 379-384. DOI:10.1016/j.meatsci.2013.07.017.
[42] CARLSON K B, PRUSA K J, FEDLER C A, et al. Proteomic features linked to tenderness of aged pork loins[J]. Journal of Animal Science, 2017, 95(6): 2533-2546. DOI:10.2527/jas.2016.1122.
[43] 翟小波. 低脂兔肉灌腸加工工藝及品質變化研究[D]. 重慶: 西南大學, 2017: 23-38.
[44] 李喬, 馬紀兵, 余群力, 等. NO對宰后牛肉成熟過程中AMPK活性、糖酵解及持水力的影響[J]. 食品科學, 2021, 42(12): 17-23. DOI:10.7506/spkx1002-6630-20200425-327.
[45] 郭雨軒, 陳騁, 師希雄, 等. 活性氧激活缺氧誘導因子-1α加速宰后成熟初期牛肉能量代謝[J]. 食品科學, 2023, 44(4): 9-16. DOI:10.7506/spkx1002-6630-20220407-072.
[46] WANG Chengcheng, MATARNEH S K, GERRARD D, et al. Contributions of energy pathways to ATP production and pH variations in postmortem muscles[J]. Meat Science, 2022, 189: 108828. DOI:10.1016/j.meatsci.2022.108828.
[47] DIESBOURG L, SWATLAND H J, MILLMAN B M. X-ray diffraction measurements of postmortem changes in the myofilament lattice of pork[J]. Journal of Animal Science, 1988, 66(4): 1048-1054.
[48] 吳菊清, 李春保, 周光宏, 等. 宰后成熟過程中冷卻牛肉、豬肉色澤和嫩度的變化[J]. 食品科學, 2008, 29(10): 136-139.
[49] 羅輝, 楊波, 李亞蕾, 等. 宰后成熟期間能量物質、pH值和肌原纖維小片化指數對秦川牛肉嫩度的影響及其機理[J]. 食品科學, 2022, 43(11): 171-179. DOI:10.7506/spkx1002-6630-20210526-318.
[50] 扶慶權, 張萬剛, 王海鷗, 等. 3 種包裝方式對宰后牛肉成熟過程中顏色影響的機制研究[J]. 食品科技, 2018, 43(7): 127-133. DOI:10.13684/j.cnki.spkj.2018.07.024.
[51] SCHULTE M D, HOCHMUTH K G, STEADHAM E M, et al. Early postmortem muscle proteome and metabolome of beef Longissimus thoracis muscle classified by pH at 6 hours postmortem[J]. Journal of Proteomics, 2022, 271: 104756. DOI:10.1016/j.jprot.2022.104756.
[52] WANG Chengcheng, MATARNEH S K, GERRARD D, et al. Modelling of energy metabolism and analysis of pH variations in postmortem muscle[J]. Meat Science, 2021, 182: 108634. DOI:10.1016/j.meatsci.2021.108634.
[53] WHEELER T L, PAPADOPOULOS L S, MILLER R K. Research guidelines for cookery, sensory evaluation and instrumeatal tenderness measurements of fresh meat[M]. Chicago, IL: American Meat Science Association and National Live Stock and Meat Board, 1995.
[54] ZUO Huixin, HAN Ling, YU Qunli, et al. Proteome changes on water-holding capacity of yak Longissimus lumborum during postmortem aging[J]. Meat Science, 2016, 121: 409-419. DOI:10.1016/j.meatsci.2016.07.010.
[55] VAN OECKEL M J, WARNANTS N, BOUCQU? C V. Pork tenderness estimation by taste panel, Warner-Bratzler shear force and on-line methods[J]. Meat Science, 1999, 53(4): 259-267. DOI:10.1016/S0309-1740(99)00067-4.
[56] LIU Rui, ZHANG Wangang. Chapter 4: Detection techniques of meat tenderness: state of the art[M]//BISWAS A K, MANDAL P K. Meat quality analysis. Salt Lake City: Academic Press, 2020: 53-65. DOI:10.1016/B978-0-12-819233-7.00004-5.
[57] SCHREUDERS F K G, SCHLANGEN M, KYRIAKOPOULOU K, et al.?Texture methods for evaluating meat and meat analogue structures: a review[J]. Food Control, 2021, 127: 108103. DOI:10.1016/j.foodcont.2021.108103.
[58] 李喬, 馬紀兵, 余群力, 等. NO-AMPK通路對牛肉宰后成熟過程中蛋白特性與肉品質的影響[J]. 核農學報, 2022, 36(7): 1413-1424. DOI:10.11869/j.issn.100-8551.2022.07.1413.
[59] HOLMAN B W B, HOPKINS D L. The use of conventional laboratory-based methods to predict consumer acceptance of beef and sheep meat: a review[J]. Meat Science, 2021, 181: 108586. DOI:10.1016/j.meatsci.2021.108586.
[60] HOLMAN B W B, COLLINS D, KILGANNON A K, et al. Using shear force, sarcomere length, particle size, collagen content, and protein solubility metrics to predict consumer acceptance of aged beef tenderness[J]. Journal of Texture Studies, 2020, 51(4): 559-566. DOI:10.1111/jtxs.12523.
[61] SILVA D R G, DE MOURA A P R, RAMOS A L S, et al. Comparison of Warner-Bratzler shear force values between round and square cross-section cores for assessment of beef Longissimus tenderness[J]. Meat Science, 2017, 125: 102-105. DOI:10.1016/j.meatsci.2016.11.017.
[62] 農業部畜禽產品質量監督檢驗測試中心, 北京國農工貿發展中心. 肉嫩度的測定 剪切力測定法: NY/T 1180—2006[S]. 北京: 中國農業出版社, 2006: 7-10.
[63] 魏直升, 王勇峰, 余群力, 等. 新疆褐牛不同部位牛肉在成熟過程中的品質變化[J]. 食品工業科技, 2020, 41(2): 64-70. DOI:10.13386/j.issn1002-0306.2020.02.011.
[64] DE HUIDOBRO F R, MIGUEL E, BL?ZQUEZ B, et al.?A comparison between two methods (Warner-Bratzler and texture profile analysis) for testing either raw meat or cooked meat[J]. Meat Science, 2005, 69(3): 527-536. DOI:10.1016/j.meatsci.2004.09.008.
[65] JONKERS N, VAN DOMMELEN J A W, GEERS M G D. Intrinsic mechanical properties of food in relation to texture parameters[J]. Mechanics of Time-Dependent Materials, 2022, 26(2): 323-346. DOI:10.1007/s11043-021-09490-4.
[66] RUSTAGI S. Food texture and its perception, acceptance and evaluation[J]. Biosciences Biotechnology Research Asia, 2020, 17(3): 651-658. DOI:10.13005/bbra/2869.
[67] DE NADAI BONIN M, DA LUZ E SILVA S, B?NGER L, et al. Predicting the shear value and intramuscular fat in meat from Nellore cattle using Vis-NIR spectroscopy[J]. Meat Science, 2020, 163: 108077. DOI:10.1016/j.meatsci.2020.108077.
[68] TEJERINA D, OLIV?N M, GARC?A-TORRES S, et al. Use of near-infrared spectroscopy to discriminate DFD beef and predict meat quality traits in autochthonous breeds[J]. Foods, 2022, 11(20): 3274. DOI:10.3390/foods11203274.
[69] BALAGE J M, DA LUZ E SILVA S, GOMIDE C A, et al. Predicting pork quality using Vis/NIR spectroscopy[J]. Meat Science, 2015, 108: 37-43. DOI:10.1016/j.meatsci.2015.04.018.
[70] HOPKINS D L, LITTLEFIELD P J, THOMPSON J M.?A research note on factors affecting the determination of myofibrillar fragmentation[J]. Meat Science, 2000, 56(1): 19-22. DOI:10.1016/S0309-1740(00)00012-7.
[71] ONOPIUK A, SZPICER A, POGORZELSKI G, et al. Analysis of the impact of exogenous preparations of cysteine proteases on tenderness of beef muscles Semimembranosus and Longissimus thoracis et lumborum[J]. Livestock Science, 2022, 258: 104866. DOI:10.1016/j.livsci.2022.104866.
[72] RAJAGOPAL K, OOMMEN G T. Myofibril fragmentation index as an immediate postmortem predictor of Buffalo meat tenderness[J]. Journal of Food Processing and Preservation, 2015, 39(6): 1166-1171. DOI:10.1111/jfpp.12331.
[73] AROEIRA C N, TORRES FILHO R A, FONTES P R, et al. Comparison of different methods for determining the extent of myofibrillar fragmentation of chilled and frozen/thawed beef across postmortem aging periods[J]. Meat Science, 2020, 160: 107955. DOI:10.1016/j.meatsci.2019.107955.
[74] SOJI Z. Effect of the muscle nanostructure changes during post-mortem aging on tenderness of different beef breeds[J]. Asian-Australasian Journal of Animal Sciences, 2021, 34(11): 1849-1858. DOI:10.5713/ajas.20.0488.
[75] 梁吉虹, 陳一萌, 侯嬌, 等. Sous Vide加工方法對牦牛肉品質的影響[J]. 肉類研究, 2020, 34(3): 27-33. DOI:10.7506/rlyj1001-8123-20200113-008.
[76] NISHIMURA T, FANG S, ITO T, et al. Structural weakening of intramuscular connective tissue during postmortem aging of pork[J]. Animal Science Journal, 2008, 79(6): 716-721. DOI:10.1111/j.1740-0929.2008.00585.x
[77] SOJI Z, CHULAYO A Y. Beef tenderness evaluation using early post-mortem muscle nanostructure[J]. Asian-Australasian Journal of Animal Sciences, 2021, 00: 1-11. DOI:10.5713/ajas.20.0154.
[78] 古扎努爾·艾斯卡爾, 巴吐爾·阿不力克木, 趙力男. 宰后不同成熟時間對馬肉背最長肌超微結構的影響[J]. 肉類研究, 2020, 34(12): 7-10. DOI:10.7506/rlyj1001-8123-20201111-263.
[79] 朱瑤迪, 申婷婷, 趙改名, 等. 基于高光譜圖像和激光共聚焦顯微鏡技術快速測定豬肉嫩度[J]. 中國食品學報, 2017, 17(11): 239-244. DOI:10.16429/j.1009-7848.2017.11.031.
[80] DURANTON F, SIMONIN H, CH?RET R, et al. Effect of high pressure and salt on pork meat quality and microstructure[J]. Journal of Food Science, 2012, 77(8): E188-E194. DOI:10.1111/j.1750-3841.2012.02816.x.
[81] PRIETO N, PAWLUCZYK O, DUGAN M E R, et al. A review of the principles and applications of near-infrared spectroscopy to characterize meat, fat, and meat products[J]. Applied Spectroscopy, 2017, 71(7): 1403-1426. DOI:10.1177/0003702817709299.
[82] QU Cheng, LI Yuzhu, DU Shanshan, et al. Raman spectroscopy for rapid fingerprint analysis of meat quality and security: principles, progress and prospects[J]. Food Research International, 2022, 161: 111805. DOI:10.1016/j.foodres.2022.111805.
[83] MA Ji, SUN Dawen, PU Hongbin, et al. Advanced techniques for hyperspectral imaging in the food industry: principles and recent applications[J]. Annual Review of Food Science and Technology, 2019, 10(1): 197-220. DOI:10.1146/annurev-food-032818-121155.
[84] HASSOUN A, SAHAR A, LAKHAL L, et al. Fluorescence spectroscopy as a rapid and non-destructive method for monitoring quality and authenticity of fish and meat products: impact of different preservation conditions[J]. LWT-Food Science and Technology, 2019, 103: 279-292. DOI:10.1016/j.lwt.2019.01.021.
[85] LI Mi, DANG Dan, LIU Lianqing, et al. Imaging and force recognition of single molecular behaviors using atomic force microscopy[J]. Sensors, 2017, 17(12): 200. DOI:10.3390/s17010200.
[86] SCHOEMAN L, WILLIAMS P, DU PLESSIS A, et al. X-ray micro-computed tomography (μCT) for non-destructive characterisation of food microstructure[J]. Trends in Food Science and Technology, 2016, 47: 10-24. DOI:10.1016/j.tifs.2015.10.016.
[87] VEISETH-KENT E, PEDERSEN M E, R?NNING S B, et al. Can postmortem proteolysis explain tenderness differences in various bovine muscles?[J]. Meat Science, 2018, 137: 114-122. DOI:10.1016/j.meatsci.2017.11.011.
[88] 章燕, 馮智田, 竇志勇, 等. 基于免疫學的微生物快速檢測技術研究與應用現狀[J]. 中國衛生監督雜志, 2020, 27(3): 253-256. DOI:10.3969/j.issn.1007-6131.2020.03.013.
[89] TOWBIN H, STAEHELIN T, GORDON J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications[J]. Proceedings of the National Academy of Sciences, 1979, 76(9): 4350-4354. DOI:10.1073/pnas.76.9.4350.
[90] 孫金龍, 師希雄, 黃峰, 等. 藏羊肉宰后成熟過程中熱休克蛋白27對肌原纖維蛋白及細胞凋亡酶的影響[J]. 食品科學, 2020, 41(3):?24-29. DOI:10.7506/spkx1002-6630-20181203-038.
[91] 楊明暢, 馬儷珍, 李來好, 等. 蛋白質免疫印跡技術在水產品中的應用[J]. 食品安全質量檢測學報, 2021, 12(20): 7914-7919. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.20.002.
[92] PILLAI-KASTOORI L, SCHUTZ-GESCHWENDER A R, HARFORD J A. A systematic approach to quantitative Western blot analysis[J]. Analytical Biochemistry, 2020, 593: 113608. DOI:10.1016/j.ab.2020.113608.
[93] MURPHY R M, LAMB G D. Important considerations for protein analyses using antibody based techniques: down-sizing Western blotting up-sizes outcomes[J]. The Journal of Physiology, 2013, 591(23): 5823-5831. DOI:10.1113/jphysiol.2013.263251.
[94] MALHEIROS J M, BRAGA C P, GROVE R A, et al. Influence of oxidative damage to proteins on meat tenderness using a proteomics approach[J]. Meat Science, 2019, 148: 64-71. DOI:10.1016/j.meatsci.2018.08.016.
[95] EST?VEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[96] CHEN Qianqian, HUANG Jichao, HUANG Feng, et al. Influence of oxidation on the susceptibility of purified desmin to degradation by μ-calpain, caspase-3 and -6[J]. Food Chemistry, 2014, 150: 220-226. DOI:10.1016/j.foodchem.2013.10.149.
[97] LEI Yongdong, DENG Xiaorong, ZHANG Zhiwei, et al. Effects of oxidation on the physicochemical properties and degradation of mutton myofibrillar proteins[J]. Journal of Food Science, 2022, 87(7): 2932-2942. DOI:10.1111/1750-3841.16166.
[98] CROSS H R, SCHANBACHER B D, CROUSE J D. Sex, age and breed related changes in bovine testosterone and intramuscular collagen[J]. Meat Science, 1984, 10(3): 187-195. DOI:10.1016/0309-1740(84)90021-4.
[99] GOLL D E, BRAY R W, HOEKSTRA W G. Age-associated changes in muscle composition. The isolation and properties of a collagenous residue from bovine muscle[J]. Journal of Food Science, 1963, 28(5): 503-509. DOI:10.1111/j.1365-2621.1963.tb00234.x.
[100] LI Xiying, HA Minh, WARNER R D, et al. Meta-analysis of the relationship between collagen characteristics and meat tenderness[J]. Meat Science, 2022, 185: 108717. DOI:10.1016/j.meatsci.2021.108717.
[101] TORRESCANO G, S?NCHEZ-ESCALANTE A, GIM?NEZ B, et al. Shear values of raw samples of 14 bovine muscles and their relation to muscle collagen characteristics[J]. Meat Science, 2003, 64(1): 85-91. DOI:10.1016/S0309-1740(02)00165-1.
[102] ZHENG Yanyan, ZHOU Changyu, WANG Chong, et al. Evaluating the effect of cooking temperature and time on collagen characteristics and the texture of hog maw[J]. Journal of Texture Studies, 2021, 52(2): 207-218. DOI:10.1111/jtxs.12580.
[103] 劉晶晶, 雷元華, 李海鵬, 等. 加熱溫度及時間對牛肉膠原蛋白特性及嫩度的影響[J]. 中國農業科學, 2018, 51(5): 977-990. DOI:10.3864/j.issn.0578-1752.2018.05.015.
[104] NAQVI Z B, THOMSON P C, HA M, et al. Effect of sous vide cooking and ageing on tenderness and water-holding capacity of low-value beef muscles from young and older animals[J]. Meat Science, 2021, 175: 108435. DOI:10.1016/j.meatsci.2021.108435.
收稿日期:2023-05-09
基金項目:江蘇現代農業產業單項技術開發項目(CX(22)3071)
第一作者簡介:狄雨晗(2002—)(ORCID: 0009-0003-3342-3392),女,本科生,研究方向為肉品加工與質量控制。
E-mail: 1533027262@qq.com
*通信作者簡介:張雅瑋(1986—)(ORCID: 0000-0001-7353-7771),女,副教授,博士,研究方向為肉品加工與質量控制。
E-mail: zhangyawei@njau.edu.cn

