基于網絡藥理學和分子對接技術揭示血府逐瘀口服液抗血栓的活性成分和作用機制
摘要:為揭示血府逐瘀口服液治療血栓類疾病的機理,挖掘血府逐瘀口服液中抗血栓有效成分。通過TCMSP數據庫檢索血府逐瘀口服液中的化學成分或成分靶點;利用STRING數據庫構建蛋白質-蛋白質相互作用(PPI)網絡得到核心靶點;通過Cytoscape構建“成分-靶點”網絡圖,并進行拓撲分析和對核心靶點進行GO和KEGG富集分析,預測血府逐瘀口服液抗血栓的作用機制;根據Degree值排名將關鍵的成分和作用靶點進行分子對接。通過網絡拓撲分析篩選得到81個核心靶點,如TNF、ALB、AKT1等;GO富集分析中生物過程(BP)共304條,分子功能(MF)共72條,細胞組成(CC)共41條,通路富集得到凝血級聯反應、TNF等80條信號通路;分子對接結果顯示,Sainfuran、Xambioona和7-Methoxy-2-methyl isoflavone與靶點蛋白ESR1、F2、IL-2、KDR、MET、MMP3均有較好的親和力。該研究為血府逐瘀口服液在抗血栓應用方面提供參考。
關鍵詞:血府逐瘀口服液;抗血栓藥物;血栓;網絡藥理學;分子對接;作用機制
中圖分類號:R285"" 文獻標志碼:A"" 文章編號:1002-4026(2024)04-0026-08
開放科學(資源服務)標志碼(OSID):
Study of the active components and mechanism of action of antithrombotic
Xuefuzhuyu oral liquid based on network pharmacology and
molecular docking technology
LIN Shenghua1a,XUE Chang2,MA honglin1a,FAN Wei1a,SHEN Chuanlin1a,CHEN Jiayu1a,SUN Botong1b,
DU Xingshuo1a, ZHAN Wen1a,LI Xiaobing1a, ZHANG Shanshan1a, JIN Meng1a, HE Qiuxia1a,1b
(1.a.Engineering Research Center of Zebrafish Model for Human Diseases and Drug Screening of Shandong Province, Biology Institute;
b.Science and Technology Service Platform, Qilu University of Technology (Shandong Academy of Sciences), Jinan 250014, China;
2.Department of Biological Sciences, Xi’an Jiaotong-Liverpool University, Suzhou 215028, China)
Abstract∶The aim of this study is to reveal the mechanism of Xuefuzhuyu oral liquid in treating thrombotic diseases and to explore its effective antithrombotic active ingredients . The Traditional Chinese Medicine Systems Pharmacology database was used to search for the active ingredients or related components of Xuefuzhuyu oral liquid. A protein-protein interaction network was constructed using the STRING database to obtain the core targets. A “component-target”network diagram was constructured using Cytoscape, which was used to perform topological,GO and KEGG enrichment analyses on core components to predict the antithrombotic mechanism action. Molecular docking was conducted on the key components and action targets according to the degree ranking. 81 core components, such as tumor necrosis factor (TNF), ALB, and AKT1 were obtained via network topology analysis screening.A total of 304 biological processes (BPs), 72 molecular functions, and 41 cell components were analyzed using GO enrichment analysis, and pathway enrichment yielded 80 signaling pathways, such as the coagulation cascade responseand TNF pathway.Molecular docking results showed that Sainfuran, Xambioona, and 7-methoxy-2-methyl isoflavone have good affinity with target proteins ESR1, F2, IL-2, KDR, MET, and MMP3. This study provides a reference for the application of Xuefuzhuyu oral liquid in antithrombotic therapies.
Key words∶Xuefuzhuyu oral liquid; antithromboticagent; thrombus; network pharmacology; molecular docking; mechanism of action
血栓及其導致的各類心腦血管疾病嚴重危害人體健康,其中靜脈血栓栓塞是導致死亡的重要因素[1]。血栓(thrombostic)是在靜脈或動脈血管中形成血凝塊從而限制了血液流動的一種病理過程。血管中血液的正常流動依賴血漿蛋白、凝血因子、炎癥因子、細胞因子及血管內皮等因素之間的動態平衡,若該穩態失衡,形成血栓的機率將顯著增加[2]。在醫學上,西醫血栓治療方法可以分為藥物治療和手術治療兩大類。維生素K拮抗劑華法林、肝素等應用于抗凝;尿激酶、替奈普酶(TNK-IPA)等用于溶栓;此外還有手術、機械清除術或置入靜脈濾器等方法清除血栓[3]。但是這些抗血栓療法受到較多禁忌癥的限制并存在并發癥的風險。中草藥作用溫和、副作用較少,因此對抗血栓相關中草藥與方劑的研究具有重要意義[4]。
血府逐瘀口服液采用清代王清任所創的經典活血化瘀方,由桃仁、紅花、柴胡、牛膝、赤芍、甘草、當歸、枳殼、桔梗、川芎、地黃十一味中藥材組成,具有活血化瘀、行氣止痛的功效,在臨床治療中對腦梗死、冠心病、心肌梗死等血栓類疾病具有顯著療效[5]。其中桃仁活血化淤的功效最強,為方中君藥,當歸、牛膝、赤芍、川芎、紅花五藥相合,共同加強桃仁活血化瘀的功效,為方中的臣藥。紅花具有抑制血栓素A2合成,促進前列環素合成,降低血漿纖溶酶原激活物抑制因子活性的作用[6];赤芍能有效延長血栓的形成時間,減輕血栓重量,抑制血液凝結[7];川芎具有活血化瘀的作用,其中川芎嗪可以抑制血小板凝集,降低血液黏稠[8];牛膝總苷可降低血小板黏附率,改變血瘀模型大鼠的血液流變特性,具有顯著的抗血栓作用[9]。
血府逐瘀口服液體現了中藥復方具有多成分、多靶點、協同作用的特點[10]。中藥復方盡管在治療復雜疾病方面具有顯著療效,但是其具體作用機制尚不明確。網絡藥理學從系統生物學理論出發,選取特定節點進行多靶點分析,強調對信號通路的多途徑調節[11],可以從整體的角度探究藥物與疾病治療之間的關聯,構建疾病-表型-基因-藥物多層次網絡[10]。本研究借助網絡藥理學從分子水平預測血府逐瘀口服液抗血栓的有效活性成分和靶點,并結合分子對接,分析其中的有效活性成分和靶點之間的最佳結合位點,為揭示血府逐瘀口服液治療血栓類疾病的機理提供有益探索。
1 方法
1.1 血府逐瘀口服液有效化學成分及作用靶點的獲取
利用中藥系統藥理數據庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)檢索血府逐瘀口服液中各藥材(桃仁、紅花、柴胡、牛膝、赤芍、甘草、當歸、枳殼、桔梗、川芎、地黃)的化學成分,再以口服生物利用度(oral bioavailability, OB)≥30%和類藥性(drug-likeness, DL)≥0.18為標準篩選有效成分及其作用靶點,并通過Pubchem數據庫檢索出活性成分對應的Canonical SMILES和化學結構式;分別導入Swiss target prediction和PharmMapper數據庫,獲取對應成分的作用靶點;利用Uniport數據庫將靶點轉化成人源物種標準基因名稱(Gene symbol),去重得到血府逐瘀口服液活性成分的作用靶點。
1.2 血栓作用靶點的收集
以“thrombosis”為關鍵詞分別在GeneCards數據庫、DisGeNET數據庫、大寫數據庫、OMIM數據庫中進行檢索,將結果集合去重獲得451個疾病相關靶點。
1.3 血府逐瘀口服液潛在基因作用靶點的篩選
將血府逐瘀口服液活性成分作用靶點和血栓作用靶點繪制維恩圖,交集即為血府逐瘀口服液和血栓的共同靶點,即藥物抗血栓的潛在基因作用靶點。
1.4 構建蛋白之間相互作用網絡圖
在STRING數據庫中輸入獲取的交集靶點基因,物種設定為“人類”,最小相互作用閾值調整為0.4,構建蛋白-蛋白相互作用(protein-protein interaction networks,PPI)網絡。將PPI網絡導入Cytoscape 3.9.1軟件中,對蛋白靶點網絡進行拓撲參數分析,計算節點度值(Degree),篩選出核心靶點。
1.5 GO功能富集分析和KEGG通路富集分析
在DAVID數據庫中輸入核心靶點,物種設置為“人類”,對其分別進行生物過程(biological process, BP)、分子功能(molecular function, MF)和細胞成分(cellular component, CC)的GO富集分析和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes, KEGG)生物通路富集分析。
1.6 成分-靶點網絡圖的構建與分析
將核心靶點、核心靶點映射出的活性成分、KEGG通路分析的前20條信號通路信息導入Cytoscape 3.9.1軟件中,構建成分-靶點的網絡圖并進拓撲分析。
1.7 分子對接
根據網絡藥理學技術分析中Degree值排名前6的靶點與排名前3的活性成分進行分子對接驗證。分別在Pubchem數據庫和PDB數據庫中獲取配體和受體的3D結構,利用PyMOL軟件將受體蛋白進行去水、去配體處理,將受體蛋白利用AutoDuck Tools軟件進行加氫、計算電荷、添加蛋白質類型等操作,最后分別利用Autogrid程序和Autodock程序先后進行兩次運算。分析結合能,將結合能≤-5 kJ/mol視為對接成功。
本文采用的所有數據庫和軟件及其網址和版本見OSID科學數據與內容附表1。
2 結果
2.1 血府逐瘀口服液活性成分及靶點獲取結果
在TCMSP數據庫,以OB≥30%、DL≥0.18作為標準篩選出活性成分共154個(見OSID科學數據與內容附表2),其中桃仁22個、紅花21個、當歸2個、川芎5個、地黃1個、赤芍14個、牛膝20個、柴胡17個、枳殼5個、桔梗4個、甘草70個。在Swiss Target Prediction數據庫和PharmMapper數據庫中獲得活性成分的靶點,剔除無作用靶點后共740個。
2.2 血府逐瘀口服液抗血栓核心靶點
以“thrombosis”為關鍵詞在GeneCards數據庫、DisGeNET數據庫、CTD數據庫、OMIM數據庫中進行檢索,將4種數據庫查詢到的相關疾病靶點結合,去重,最終獲得451個靶點。將血府逐瘀口服液活性成分和血栓的靶點收集并作維恩圖后獲得交集靶點84個。
在STRING數據庫中把獲取的共有靶點導入構建PPI網絡,之后將靶點文件導入Cytoscape 3.9.1軟件后,對PPI網絡進行拓撲分析。Degree數值代表某一節點與其他節點相互作用的個數,其數值越大,代表該節點在生物學進程的作用越重要。得到核心靶點共81個(OSID科學數據與內容附表3),核心靶點網絡圖(見OSID科學數據與內容附圖1)。其中Degree值排名前10的核心靶點為ALB、TNF、AKT1、MMP9、PLG、PTGS2、SERPINE1、STAT3、ICAM1、MMP2。
2.3 GO功能富集和KEGG通路富集結果分析
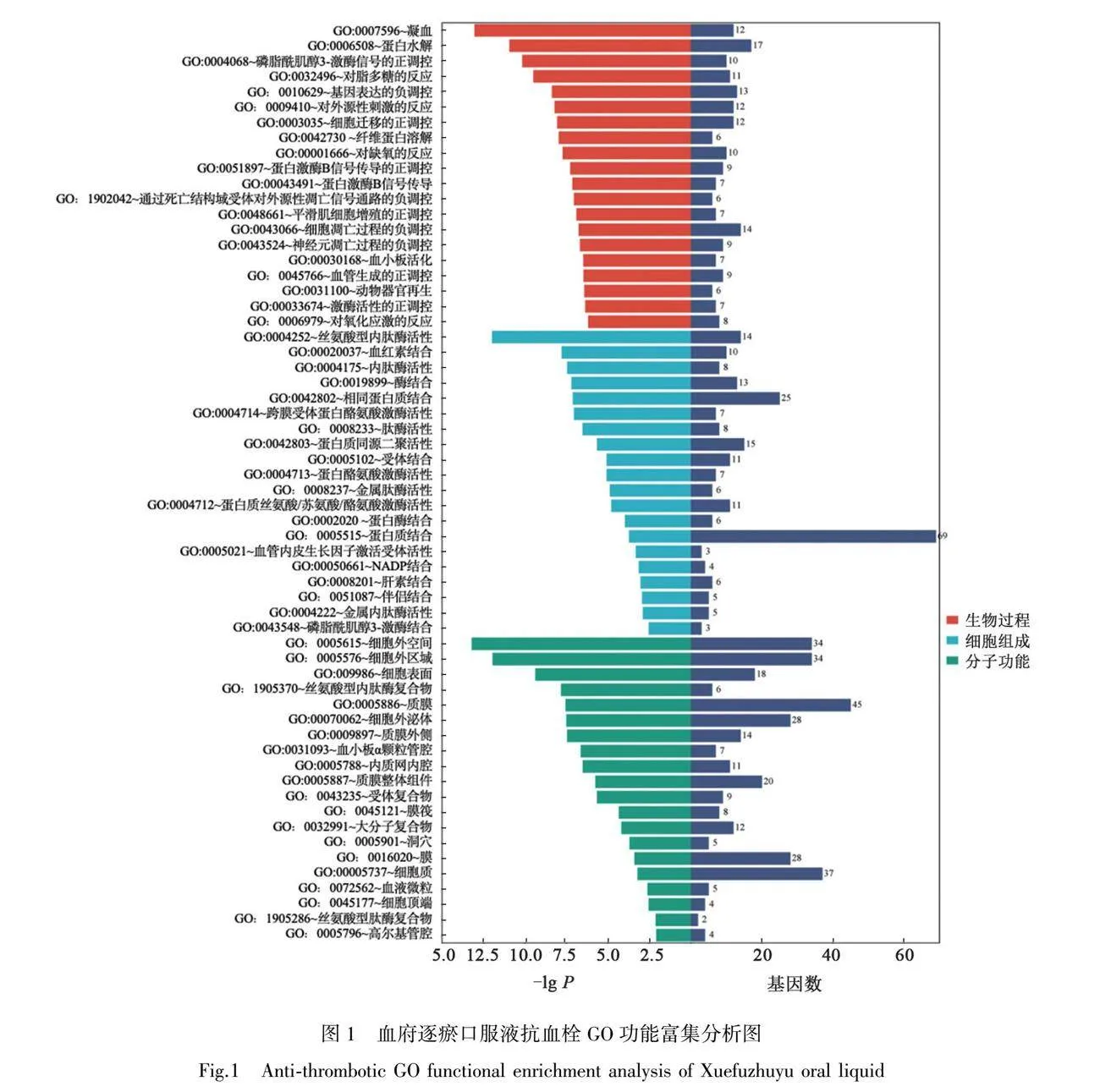
將核心靶點導入DAVID數據庫中,物種設置為人類,進行GO功能富集和KEGG通路富集分析。其中GO分析得到生物過程(biological process, BP)共304條,分子功能(molecular function, MF)共72條,細胞組成(cell component, CC)共41條;將結果根據P值的升序排列,分別將前20條目進行可視化分析,如圖1。其中涉及到的生物學進程有血液凝固(blood coagulation)、蛋白水解(proteolysis)、磷脂酰肌醇3-激酶信號傳導的正調控(positive regulation of phosphatidylinositol 3-kinase signaling)、脂多糖反應(response to lipopolysaccharide)、基因表達的負調控(negative regulation of gene expression)等過程;細胞組成主要涉及細胞外間隙(extracellular space)、胞外區域(extracellular region)、細胞表面(cell surface)、絲氨酸型內肽酶復合物(serine-type endopeptidase complex)、質膜(plasma membrane)等;分子功能主要包括絲氨酸型內肽酶活性(serinetype endopeptidase activity)、血紅素結合(heme binding)、內肽酶活性(endopeptidase activity)、酶結合(enzyme binding)、同一蛋白結合(identical protein binding)等。這充分說明了血府逐瘀口服液通過參與多種生物學進程來發揮細胞和分子功能,從而發揮抗血栓的活性。
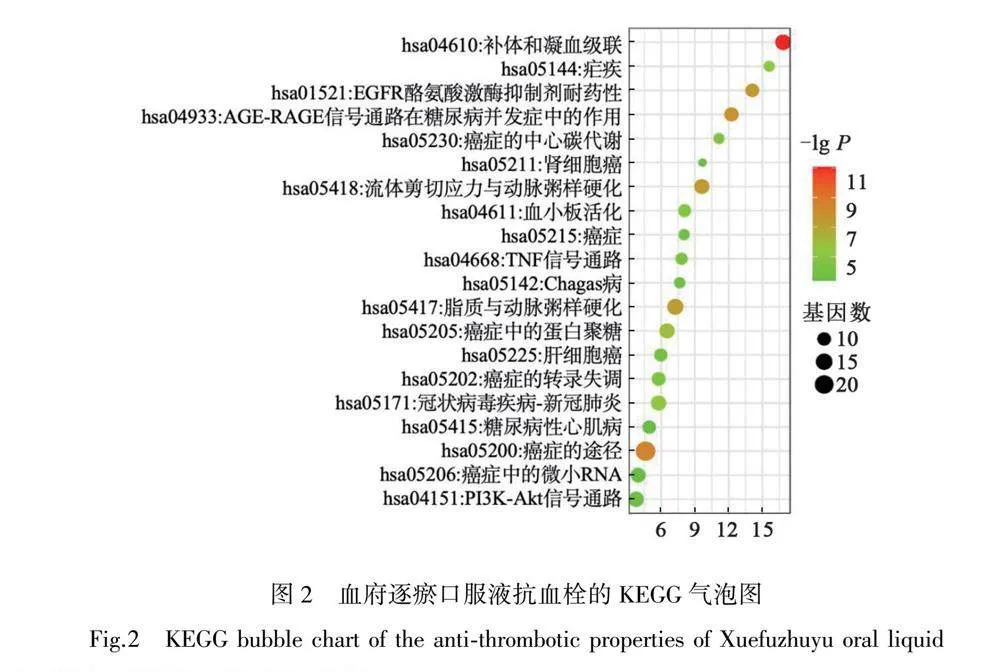
KEGG通路分析共獲得80條通路信號,其中可以看出血府逐瘀口服液抗血栓參與相互的信號通路主要有PI3K-Akt信號通路、TNF信號通路、AGE-RAGE信號通路以及血小板活化信號通路等,這充分說明了血府逐瘀口服液是通過參與多條信號通路來發揮抗血栓作用。將前20條信號通路進行可視化分析見圖2,并且對每一條信號通路中所包含的基因進行了統計(OSID科學數據與內容附表4)。
2.4 構建成分-靶點網絡圖及網絡圖分析
將血府逐瘀口服液中化學成分、靶點導入到Cytoscape 3.9.1軟件中,構建成分-靶點網絡圖(見OSID科學數據與內容附圖2),共包含274個節點,5 294條邊。根據Degree值排名分析得到血府逐瘀口服液在抗血栓方面的核心成分主要有Xambioona、7-Methoxy-2-methyl isoflavone、Sainfuran、Licoagroisoflavone、icos-5-enoic acid等26種(相關具體信息見OSID科學數據與內容附表5)。
2.5 分子對接結果
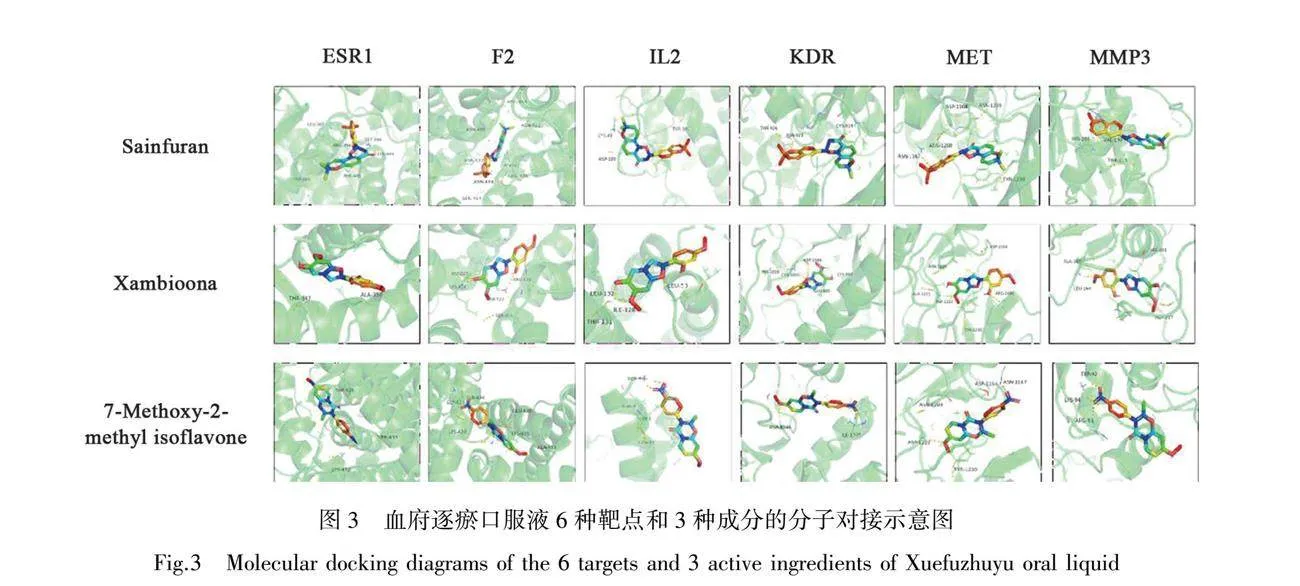
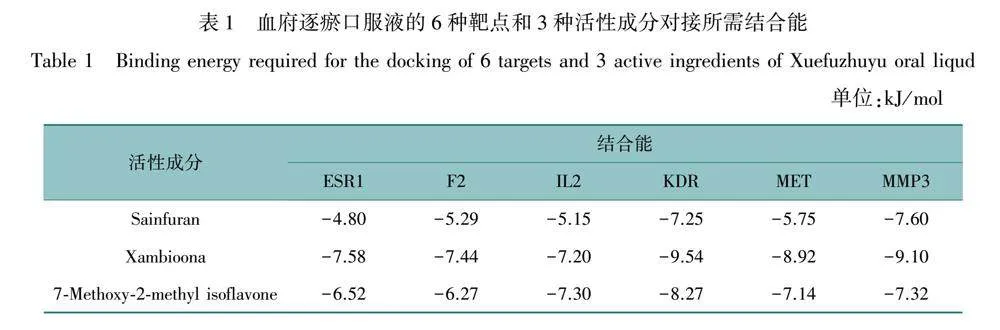
根據Degree值排名前6的靶點和排名前3的活性成分進行分子對接驗證,6種靶點和3種成分兩兩對接所需要的結合能見表1。根據表1可以發現只有Sainfuran與ESR1結合所需要的結合能gt;-5 kJ/mol,而其他的結合能均lt;-5 kJ/mol,說明對接成功。將配體與受體對接示意圖進行展示,見圖3。
3 討論
血府逐瘀口服液是活血化瘀代表方之一,近年臨床和藥理學研究證明該方及其制劑在治療血瘀癥及相關血管疾病上具有明顯療效[12]。本研究利用網絡藥理學技術系統分析了血府逐瘀口服液可能的作用機制。通過TCMSP、PharmMapper、GeneCards等數據庫篩選出血府逐瘀口服液活性成分154個,對應靶點740個,與疾病交集靶點84個。通過網絡拓撲分析可以得到血府逐瘀口服液治療血栓的核心成分有Xambioona、7-Methoxy-2-methyl isoflavone、Sainfuran、Licoagroisoflavone、Icos-5-enoic acid等共26種。
對藥物疾病共有靶點的PPI網絡進行拓撲分析后篩選出ALB、TNF、AKT1、MMP9、PLG、PTGS2、SERPINE1、STAT3、ICAM1、MMP2等血府逐瘀口服液抗血栓的潛在關鍵靶點。ALB(albumin)是一種廣泛存在于血漿中的循環蛋白,由肝細胞合成,在體內起到調節血漿滲透壓,轉運內源性和外源性配體的作用[13]。TNF是一種炎癥細胞因子,促進細胞增殖、分化、細胞因子產生及細胞凋亡或壞死,也可以通過與IL1β和IL6協同作用促進血管生成[14]。TNF-α可以誘導組織因子的表達,抑制血栓調節蛋白和內皮細胞蛋白C受體(endothelial cell protein C receptor)的表達,導致血液的異常凝集狀態[15]。AKT1屬于絲氨酸/蘇氨酸激酶AKT的一個亞型,調節代謝、增殖、細胞存活、細胞生長和血管生成等生物過程;在癌細胞中參與細胞的增殖和生長,促進腫瘤發生,抑制細胞凋亡[16]。MMP9是一種基質金屬蛋白,其參與正常生理過程中細胞外基質的降解,如血管生成、骨發育等;也可能參與多種人類惡性腫瘤及主動脈瘤等病理過程[17-21]。PLG是纖溶酶的無活性前體。纖溶酶是血漿中的一種重要酶,可以降解血栓。纖溶酶缺乏會導致血栓無法及時溶解,進而導致血栓形成[22]。PTGS是前列腺素生物合成的關鍵酶,PTGS2是PTGS兩種同工酶中的誘導型同工酶,負責炎癥,細胞有絲分裂等過程中涉及的前列腺素生物合成[23]。SERPINE1屬于絲氨酸蛋白酶抑制劑超家族成員,是組織纖溶酶原激活劑(tPA)的主要抑制劑,抑制纖維蛋白的溶解。高濃度的該基因產物與血栓形成傾向有關[24]。STAT3是一種轉錄因子,在許多細胞過程中起到關鍵作用[25]。
KEGG通路分析發現補體和凝血級聯反應(complement and coagulation cascades)、糖尿病并發癥的AGE-RAGE信號通路(AGE-RAGE signalling pathway in diabetic complications)、流體剪切應力和動脈粥樣硬化(fluid shear stress and atherosclerosis)、脂質和動脈粥樣硬化(lipid and atherosclerosis)等信號通路可能參與血府逐瘀口服液抗血栓的過程。凝血級聯反應的組分,如凝血酶、纖溶酶等可以影響補體途徑;而補體直接或間接地激活了凝血級聯反應,還可以通過促進內皮的生化形態變化調節血液的凝結傾向,并調節血小板的聚集特性[26]。AGE-RAGE通路被認為與炎癥,氧化應激等密切相關[27]。抑制RAGE可以抑制促炎細胞因子IL-6、IL-1β和TNF-α的釋放[28];而炎癥與凝血具有密切的關系[29]。流體剪切應力是流動血液對血管內皮施加的摩擦力;低剪切應力會上調促進動脈血管壁氧化和炎癥狀態的內皮細胞(EC)基因表達,從而導致動脈粥樣硬化[30]。低密度脂蛋白(LDL)水平升高是動脈粥樣硬化的主要導致因素[31]。低密度脂蛋白可以在血管壁內積累并進行氧化修飾,成為氧化低密度脂蛋白(oxLDL),從而導致內皮功能障礙[32]。
本研究將Degree值排名前6的靶點和排名前3的有效成分進行分子對接,除Sainfuran與ESR1外結合能均≤-5 kJ/mol,說明血府逐瘀口服液的有效成分與疾病相關靶點結合良好。其中F2基因編碼凝血因子II,在止血和血栓形成中具有重要作用[33]。KDR是內皮細胞中血管內皮生長因子(vascular endothelial growth factor, VEGF)的主要受體,通過對該基因特異性缺失小鼠的實驗表明血栓的消退依賴于KDR[34]。分子對接結果顯示血府逐瘀口服液中有效成分可以通過和血栓靶點穩定結合起到抗血栓的作用。
綜上所述,本研究通過網絡藥理學分析和分子對接的方法探究血府逐瘀口服液抗血栓的有效成分與作用機制。通過對核心作用靶點和生物通路分析,發現血府逐瘀口服液可能是通過參與凝血、炎癥反應、動脈粥樣硬化等多靶點,多通路的生物過程起到抗血栓作用,這為血府逐瘀口服液臨床應用中的療效提供了理論支持。斑馬魚作為一種發展迅速且具有吸引力的生物模型,其高通量能力和實驗操作性相結合的獨特優勢,使其在篩選藥物活性成分的研究中發揮著重要作用。利用FeCl3誘導斑馬魚血栓模型在中藥活性成分篩選中具有很強的適用性[35],這對血府逐瘀口服液抗血栓活性成分預測的進一步驗證提供了思路。
參考文獻:
[1]HAEMATOLOGY T L. The global burden of haematological diseases[J]. The Lancet Haematology, 2020, 7(12): e851.
[2]ASHOROBI D, AMEER MA, FERNANDEZ R. Thrombosis[M/OL]. Treasure Island (FL): StatPearls Publishing,2023.[2023-08-30]. https://www.ncbi.nlm.nih.gov/books/NBK538430/
[3]李曉強, 張福先, 王深明. 深靜脈血栓形成的診斷和治療指南(第三版)[J]. 中國血管外科雜志(電子版), 2017, 9(4): 250-257.
[4]李鶴, 郝曉元, 雷田香, 等. 中藥抗血栓的實驗研究進展[J]. 湖南中醫學院學報, 2006,26(3): 63-64. DOI: 10.3969/j.issn.1674-070X.2006.03.027.
[5]董文堯, 李先強. 血府逐瘀湯的現代研究及臨床應用[J]. 中西醫結合研究, 2011, 3(1): 34-35. DOI: 10.3870/j.issn.1674-4616.2011.01.014.
[6]袁淑娟, 張志偉, 高天紅, 等. 紅花注射液抗血栓作用機制研究[J]. 中國中藥雜志, 2011, 36(11): 1528-1529.
[7]劉俊英, 張穎, 閆爽. 赤芍的藥理作用[J]. 中國中醫藥咨訊, 2011(9): 375.
[8]王永忠, 童樹洪. 川芎的傳統用法與現代藥理研究[J]. 中國藥業, 2012, 21(7): 95-96. DOI: 10.3969/j.issn.1006-4931.2012.07.066.
[9]張文將, 鄧冰湘. 血府逐瘀湯抗動脈血栓形成及其作用機制的研究進展[J]. 湖南中醫藥大學學報, 2013, 33(4): 102-104. DOI: 10.3969/j.issn.1674-070X.2013.04.049.102.03.
[10]劉志華, 孫曉波. 網絡藥理學: 中醫藥現代化的新機遇[J]. 藥學學報, 2012, 47(6): 696-703. DOI: 10.16438/j.0513-4870.2012.06.001.
[11]張貴彪, 陳啟龍, 蘇式兵. 中藥網絡藥理學研究進展[J]. 中國中醫藥信息雜志, 2013, 20(8): 103-106. DOI: 10.3969/j.issn.1005-5304.2013.08.049.
[12]施偉麗, 張靜思, 胡雅瓊, 等. 血府逐瘀湯防治血管相關性疾病臨床應用及作用機制研究進展[J]. 中國中西醫結合雜志, 2013, 33(5):712-716.
[13]QUINLAN G J, MARTIN G S, EVANS T W. Albumin: Biochemical properties and therapeutic potential[J]. Hepatology, 2005, 41(6): 1211-1219. DOI: 10.1002/hep.20720.
[14]IDRISS H T, NAISMITH J H. TNF alpha and the TNF receptor superfamily: Structure-function relationship(s)[J]. Microscopy Research and Technique, 2000, 50(3): 184-195. DOI: 10.1002/1097-0029(20000801)50: 3lt;184: AID-JEMT2gt;3.0.CO;2-H.
[15]PIRCHER J, MERKLE M, WRNLE M, et al. Prothrombotic effects of tumor necrosis factor alpha in vivo are amplified by the absence of TNF-alpha receptor subtype 1 and require TNF-alpha receptor subtype 2[J]. Arthritis Research amp; Therapy, 2012, 14(5): R225. DOI: 10.1186/ar4064.
[16]LI L Z, RAO J L, LAN J J, et al. Association between the AKT1 single nucleotide polymorphism (rs2498786, rs2494752 and rs5811155) and microscopic polyangiitis risk in a Chinese population[J]. Molecular Genetics and Genomics, 2023, 298(3): 767-776. DOI: 10.1007/s00438-023-02012-6.
[17]AUGOFF K, HRYNIEWICZ-JANKOWSKA A, TABOLA R, et al. MMP9: A tough target for targeted therapy for cancer[J]. Cancers, 2022, 14(7): 1847. DOI: 10.3390/cancers14071847.
[18]FORSYTH P A, WONG H, LAING T D, et al. Gelatinase-A (MMP-2), gelatinase-B (MMP-9) and membrane type matrix metalloproteinase-1 (MT1-MMP) are involved in different aspects of the pathophysiology of malignant gliomas[J]. British Journal of Cancer, 1999, 79(11): 1828-1835. DOI: 10.1038/sj.bjc.6990291.
[19]VU T H, SHIPLEY J M, BERGERS G, et al. MMP-9/gelatinase B is a key regulator of growth plate angiogenesis and apoptosis of hypertrophic chondrocytes[J]. Cell, 1998, 93(3): 411-422. DOI: 10.1016/s0092-8674(00)81169-1.
[20]GROBLEWSKA M, SIEWKO M, MROCZKO B, et al. The role of matrix metalloproteinases (MMPs) and their inhibitors (TIMPs) in the development of esophageal cancer[J]. Folia Histochemica et Cytobiologica, 2012, 50(1): 12-19. DOI: 10.5603/fhc.2012.0002.
[21]LI M, YANG G, XIE B, et al.Changes in matrix metalloproteinase-9 levels during progression of atrial fibrillation[J].The Journal of International Medical Research, 2014, 42(1):224-30. DOI: 10.1177/0300060513488514.
[22]KATZ JM,TADIP. Physiology, Plasminogen Activation[M/OL]. Treasure Island (FL): StatPearls Publishing,2022.[2023-08-30]. https://www.ncbi.nlm.nih.gov/books/NBK539745/.
[23]MALIK S, KAMBOJ M, NARWAL A, et al. Immunohistochemical evaluation of cyclooxygenase-2 and mast cell density in periapical lesions[J]. International Endodontic Journal, 2023,56(8):980-990.
[24]WEI W F, ZHOU H L, CHEN P Y, et al. Cancer-associated fibroblast-derived PAI-1 promotes lymphatic metastasis via the induction of EndoMT in lymphatic endothelial cells[J]. Journal of experimental amp; clinical cancer research : CR, 2023, 42(1):160. DOI: 10.1186/s13046-023-02714-0.
[25]YUAN Z L, GUAN Y J, WANG L J, et al. Central role of the threonine residue within the p+1 loop of receptor tyrosine kinase in STAT3 constitutive phosphorylation in metastatic cancer cells[J]. Molecular and Cellular Biology, 2004, 24(21): 9390-9400. DOI: 10.1128/MCB.24.21.9390-9400.2004.
[26]OIKONOMOPOULOU K, RICKLIN D, WARD P A, et al. Interactions between coagulation and complement—their role in inflammation[J]. Seminars in Immunopathology, 2012, 34(1): 151-165. DOI: 10.1007/s00281-011-0280-x.
[27]TBON-VELASCO J C, CUEVAS E, TORRES-RAMOS M A. Receptor for AGEs (RAGE) as mediator of NF-kB pathway activation in neuroinflammation and oxidative stress[J]. CNS amp;Neurological Disorders Drug Targets, 2014, 13(9): 1615-1626. DOI: 10.2174/1871527313666140806144831.
[28]ZHANG Y X, LIU J L, JIA W, et al. AGEs/RAGE blockade downregulates Endothenin-1 (ET-1), mitigating Human Umbilical Vein Endothelial Cells (HUVEC) injury in deep vein thrombosis (DVT)[J]. Bioengineered, 2021, 12(1): 1360-1368. DOI: 10.1080/21655979.2021.1917980.
[29]BORGEL D, BIANCHINI E, LASNE D, et al. Inflammation in deep vein thrombosis: a therapeutic target?[J]. Hematology, 2019, 24(1): 742-750. DOI: 10.1080/16078454.2019.1687144.
[30]NIGRO P, ABE J I, BERK B C. Flow shear stress and atherosclerosis: a matter of site specificity[J].Antioxidants amp; Redox Signaling, 2011, 15(5): 1405-1414. DOI: 10.1089/ars.2010.3679.
[31]CHOY P C, SIOW Y L, MYMIN D, et al. Lipids and atherosclerosis[J]. Biochemistry and Cell Biology, 2004, 82(1): 212-224. DOI: 10.1139/o03-085.
[32]HOPKINS P N. Molecular biology of atherosclerosis[J]. Physiological Reviews, 2013, 93(3): 1317-1542. DOI: 10.1152/physrev.00004.2012.
[33]IANNUCCI J, GRAMMAS P. Thrombin, a key driver of pathological inflammation in the brain[J]. Cells, 2023, 12(9): 1222. DOI: 10.3390/cells12091222.
[34]ALIAS S, REDWANB, PANZENBOECKA, et al. Defective angiogenesis delays thrombus resolution: A potential pathogenetic mechanism underlying chronic thromboembolic pulmonary hypertension[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2014, 34(4): 810-819. DOI: 10.1161/ATVBAHA.113.302991.
[35]莫彩蓮, 李杰, 王加珍, 等. 斑馬魚血栓模型在中藥活性成分篩選中的適用性[J]. 山東科學, 2021, 34(4):52-59. DOI: 10.3976/j.issn.1002-4026.2021.04.009.

