全身化療聯合DC-CIK過繼免疫治療中晚期胃癌的臨床研究
李井泉梁杰雄
全身化療聯合DC-CIK過繼免疫治療中晚期胃癌的臨床研究
李井泉梁杰雄
【摘要】目的研究全身化療聯合DC-CIK過繼免疫對中晚期胃癌的治療效果。方法中晚期胃癌患者66例,隨機分為生物治療組(n=34)和常規治療組(n=32)。生物治療組Ⅱ、Ⅲ期患者行手術治療,術后給以全身化療聯合DC-CIK過繼免疫治療,Ⅳ期患者直接給以全身化療聯合DC-CIK過繼免疫治療;常規治療組Ⅱ、Ⅲ期患者行手術治療,術后給以全身化療,Ⅳ期患者直接給以全身化療。以臨床受益反應[包括視覺模擬評分法(VAS)、鎮痛藥物、全身狀況評分(KPS)和體重以及生存期為觀察指標。結果治療前2組VAS評分、KPS及體重之間比較差異無統計學意義(P﹥0.05) ;治療后2組疼痛減輕,全身狀況改善,體重增加,在臨床受益反應各指標及臨床獲益率方面比較差異無統計學意義(P﹥0.05) ;生物治療組1年生存率為85.3%,常規治療組1年生存率為71.2%,2組比較差異有統計學意義(P﹤0.05)。結論全身化療聯合DC-CIK過繼免疫治療能夠改善患者的生活質量,延長患者的生存時間,可以作為中晚期胃癌的綜合治療手段。
【關鍵詞】過繼免疫;胃腫瘤;治療效果;臨床受益反應;綜合治療
作者單位: 100029北京市,首都醫科大學附屬北京安貞醫院普通外科
隨著經濟和社會的不斷發展,腫瘤已經成為威脅人類健康的最主要疾病之一,其中以消化道惡性腫瘤尤為突出。據估計,胃癌在全球范圍內已經成為發病率占第4位的惡性腫瘤[1]。大部分胃癌患者在確診時已屬于進展期,能夠施行根治性切除的患者少于50%[2]。全身化療是中晚期胃癌的主要輔助治療手段,近年來,隨著新的化療藥物、新的化療方案的應用,以手術為主的胃腸道惡性腫瘤的綜合治療效果有了一定程度的提高,但中晚期胃癌的生存期仍然有限。綜合文獻報道,進展期胃癌5年生存率隨著腫瘤期別的升高而降低[3,4]。因此,采用新的治療手段和方法應用于中晚期胃癌的綜合治療,最大限度地提高患者的生存率非常必要。本課題研究目的是了解全身化療聯合DC-CIK過繼免疫對中晚期胃癌的治療效果,通過評估臨床受益反應以及生存狀況,為DC-CIK細胞生物免疫治療在中晚期胃癌的臨床應用提供理論和實驗依據。
1 資料與方法
1.1一般資料2011年2月至2013年10月入選的66例中晚期胃癌患者作為研究對象,所有患者經病理學檢查證實,腫瘤分期按照國際抗癌聯盟(UICC2009 版)標準進行。隨機分為生物治療組(n=34)和常規治療組(n=32)。生物治療組中,男18例,女16例;年齡38~72歲,平均年齡(62±3)歲;病程1.5~3個月,平均(1.4±0.5)個月;全身狀況評分(KPS)均>70; 16例患者合并基礎疾病,其中高血壓9例,2型糖尿病3例,冠心病4例;其中Ⅱ期5例,Ⅲ期25例,Ⅳ期4例,Ⅳ期4例患者均發生肝轉移。常規治療組中,男17例,女15例;年齡41~69歲,平均年齡(60±4) 歲;病程2~3個月,平均(1.6±0.4)個月; KPS均>70; 14例患者合并基礎疾病,其中高血壓7例,2型糖尿病5例,同時合并高血壓和冠心病2例;其中Ⅱ期3例,Ⅲ期26例,Ⅳ期3例,Ⅳ期3例患者中2例發生肝轉移,1例同時發生肝和肺轉移。入組所有患者治療前均經院倫理委員會批準,患者及家屬均簽署知情同意書。2組患者的一般資料見表1。

表1 2組患者一般資料比較 例
1.2入選與排除標準
1.2.1入選標準:①性別不限,年齡>18歲;②KPS≥70;③細胞學或組織病理學檢查確診;④預期壽命大于6個月;⑤血紅蛋白≥12 g/dl,白細胞≥4.0×109/L,血小板≥100×109/L;⑥無心、肝、肺、腎等重要臟器功能障礙或衰竭,能夠耐受手術或其他治療。
1.2.2排除標準:①6個月內行放化療;②自體免疫系統疾病;③其他部位原發性惡性腫瘤;④孕婦以及哺乳期女性;⑤無病理學診斷;⑥因各種原因不能完成治療方案。
1.3治療方法
1.3.1生物治療組:Ⅱ、Ⅲ期患者行手術切除,術后1月給以全身化療及DC-CIK過繼免疫治療;Ⅳ期患者給以全身化療及DC-CIK過繼免疫治療。①化療方案:所有患者均采用CapeOx方案(奧沙利鉑:江蘇恒瑞藥業股份有限公司,批號: 13010112;卡培他濱:上海羅氏,批號: SH0922-SH0928)。②化療方案實施方法:奧沙利鉑130 mg/m2輸注2 h (d1) ;卡培他濱1 000 mg/m2分2次口服(d1~d14),每3周重復,共6次。DC-CIK過繼免疫治療實施方案:化療前2 d使用COBE血細胞分離機采集患者自身的外周血單個核細胞(PBMC),采血量約50 ml,用0.9%氯化鈉溶液洗滌4次,使細胞數量達到(1~3)×108個/ml,然后使用RPMI1640培養基(加拿大維森特公司)調整PBMC細胞濃度至2.5×106~3.0×106個/ml。將細胞接種于6孔培養板,置37℃、5% CO2培養箱孵育,依次加入重組人IFN-g、CD3單克隆抗體、重組人IL-2刺激CIK細胞的生長和增殖,在培養的第7天,收獲CIK細胞。加入含重組人GM-CSF和重組人IL-4的無血清培養液,37℃,5% CO2培養箱中培養,誘導單核細胞向DC細胞分化;每3天半量換液1次,并補足細胞因子。CIK培養至第7天,將細胞合并至1瓶,將收獲的mDC加入CIK細胞懸液中,DC細胞和CIK細胞按1∶10的個數比共培養,無血清培養液中添加重組人IL-2(300 U/ml) ;每3天半量換液1次,并補加重組人IL-2(300 U/ml)。在第7天收集細胞,細胞數量應達到1×1010個以上。③DC-CIK質量控制:每次治療前24 h和治療前2 h,對DC-CIK細胞取樣,臺盼藍染色檢測活細胞數目;流式細胞儀檢測細胞表面CD3、CD8、CD56等分子的表達;以DC-CIK細胞為效應細胞使用乳酸脫氫酶(LDH)試劑盒檢測效應細胞對靶細胞的殺傷率;取少量培養物進行細菌、真菌培養,并檢測支原體、衣原體及內毒素。待檢測結果合格后收集9~13 d誘導擴增后獲得的DC-CIK細胞,0.9%氯化鈉溶液洗滌3次后配成100 ml液體靜脈回輸,每天輸1次,每次回輸細胞(5.0±0.5)×108個/次,連續5次為1個療程。
1.3.2常規治療組:Ⅱ、Ⅲ期患者行手術切除,術后1個月給以全身化療;Ⅳ期患者給以全身化療。所有患者均采用CapeOx方案,實施方法同生物治療組。
1.4觀察指標(1)臨床受益反應(CBR) :根據患者視覺模擬評分法(VAS評分)、鎮痛藥物、KPS評分以及體質量變化,評價患者綜合治療后臨床受益情況。①疼痛評分:采用VAS(0~10分,0代表無疼痛,10代表疼痛難以忍受)進行疼痛評分,計算鎮痛藥物的消耗量,由2位指定醫師分別評價,每周1次。止痛有效: VAS評分降低50%以上和(或)鎮痛藥物用量減少50%以上,至少持續4周;止痛無效:疼痛程度加重,止痛劑用量增加,穩定:疼痛程度及止痛劑用量無變化。②全身狀況評分:采用KPS方法進行全身狀況評分(0~100分,0代表死亡,100代表無疾病的癥狀)。有效: KPS改善至少20分以上,持續4周;穩定:化療前后無變化;無效: KPS比化療前減少20分以上。③CBR評估: VAS評分、鎮痛藥物用量、KPS中至少1項有效,其他2項穩定者為有效;其中1項無效,即為無效; 3項全部穩定者為穩定,體重增加超過7%,且持續4周,也視為有效。(2)生存期觀察:隨訪時間為1年。1.5統計學分析應用SAS 8.2統計軟件,計量資料以±s表示,采用t檢驗;計數資料比較采用χ2檢驗,P﹤0.05為差異有統計學意義。
2 結果
2.1治療情況生物治療組5例Ⅱ期患者及25例Ⅲ期患者接受外科手術治療,術后1個月給以全身化療聯合DC-CIK過繼免疫治療,4例Ⅳ期患者接受全身化療聯合DC-CIK過繼免疫治療,生物治療組在行生物治療過程中共發生副反應13例,其中發熱9例(26.5%),其他包括乏力、惡心、局部疼痛等4例(11.8%),經對癥治療后均緩解。常規治療組3例Ⅱ期患者及26例Ⅲ期患者接受外科手術治療,外科手術治療后1月給以全身化療,3例Ⅳ期患者給以全身化療。
2.22組CBR各項指標比較(1) VAS評分:生物治療組和常規治療組在治療前后均未使用止痛劑。生物治療組術前有8例出現疼痛,包括Ⅲ期患者4例,Ⅳ期患者4例(23.5%),其中腹部疼痛6例,腰背部疼痛2 例;常規治療組術前有10例出現疼痛,包括Ⅲ期患者7例,Ⅳ期患者3例(31.4%),其中腹部疼痛8例,腰背部疼痛2例。治療前2組VAS評分比較,差異無統計學意義(P﹥0.05)。治療后2組VAS評分均呈降低趨勢,治療后1年2組VAS評分比較,差異無統計學意義(P﹥0.05)。(2) KPS:治療前2組KPS比較,差異無統計學意義(P﹥0.05) ;治療后2組KPS均呈增加趨勢,治療后1年2組KPS比較,差異無統計學意義(P﹥0.05)。(3)體重變化:治療前2組體重比較,差異無統計學意義(P>0.05) ;治療后2組體重均呈增加趨勢,術后1年2組體重比較,差異無統計學意義(P﹥0.05)。見表2。
2.3臨床獲益率生物治療組和常規治療治療組在臨床獲益率方面比較,差異無統計學意義(P>0.05)。見表3。
表2 2組CBR各項指標比較 ±s
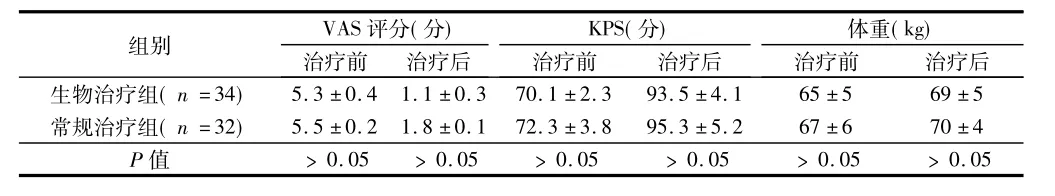
表2 2組CBR各項指標比較 ±s
注:治療前為術前觀察結果,治療后為術后1年觀察結果
組別 VAS評分(分)治療前 治療后KPS(分)治療前 治療后體重(kg)治療前 治療后生物治療組(n=34)5.3±0.4 1.1±0.3 70.1±2.3 93.5±4.1 65±5 69±5常規治療組(n=32) 5.5±0.2 1.8±0.1 72.3±3.8 95.3±5.2 67±6 70±4 P值 ﹥0.05 ﹥0.05 ﹥0.05 ﹥0.05 ﹥0.05 ﹥0.05
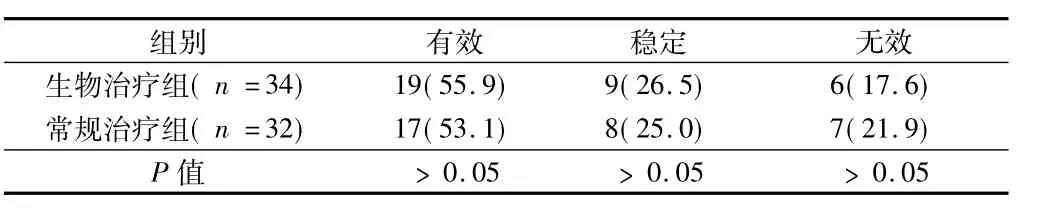
表3 2組臨床獲益率比較 例(%)
2.4生存情況隨訪時間為1年,生物治療組死亡5例,其中Ⅲ期患者2例,Ⅳ期患者3例,1年生存率為85.3%;常規治療組死亡9例,其中Ⅲ期患者6例,Ⅳ期患者3例,1年生存率為71.2%。2組患者死因均為腫瘤復發、轉移及腫瘤惡病質導致的多臟器功能衰竭。2組1年生存率比較,差異有統計學意義(P﹤0.05)。見表4。
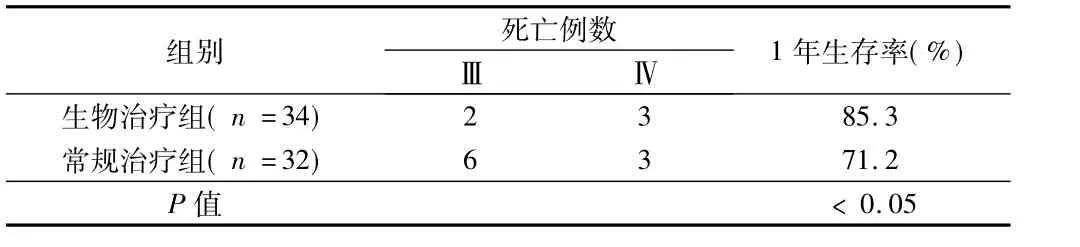
表4 2組病例生存情況
3 討論
隨著腫瘤學、免疫學以及分子生物學等相關學科的迅速發展和交叉滲透,腫瘤免疫治療的研究突飛猛進,以免疫學原理為基礎、免疫學技術為方法而建立起來的腫瘤免疫治療,已經從實驗室研究逐漸向有效、安全的臨床應用過渡[5]。生物免疫治療已經成為腫瘤綜合治療的第四種模式,并受到了越來越多的關注。
腫瘤生物免疫治療是利用各種生物治療制劑及手段,以增強人體的免疫機能,達到控制和消滅腫瘤的目的。過繼性細胞免疫治療是腫瘤免疫治療的一種手段,通過輸注自身或同種特異性或非特異性抗腫瘤免疫效應細胞,直接殺傷腫瘤細胞或糾正機體低下的細胞免疫功能來達到治療腫瘤的目的。它不僅可以糾正細胞免疫功能低下,促進宿主抗腫瘤免疫功能,并且可直接發揮抗腫瘤作用。目前根據輸注細胞的抗原特異性將過繼性免疫細胞治療分為以下兩大類:非特異性過繼性細胞治療,包括淋巴因子活化的殺傷細胞(LAK),細胞因子誘導的殺傷細胞(CIK),自然殺傷細胞;特異性過繼性細胞治療,主要是細胞毒性T細胞(CTL) ;根據輸注細胞的來源可以分為自體淋巴細胞治療和異體造血干細胞治療等。樹突狀細胞(dendritic cell,DC)是人體內功能最強大的專職抗原提呈細胞,其細胞膜表面高表達主要組織相容性復合物(major histocompatibility complex,MHC)Ⅱ類分子,能夠攝取、加工及提呈抗原,DC可誘導抗原特異性細胞毒性CTL反應,啟動效應性T細胞遷移至腫瘤部位[6]。CIK是用細胞因子誘導外周血或臍帶血單核細胞而得到的一群異質細胞(NK樣T細胞),可通過多種機制直接或間接殺傷腫瘤細胞,同時具備T細胞殺瘤活性高、NK細胞殺瘤譜廣等優勢[7]。體外研究表明,DC 和CIK細胞共同培養可提高細胞的增殖速度、殺傷活性及特異性,DC-CIK共培養的抗腫瘤效應明顯高于單純CIK細胞或DC[8]。目前,國內外對DC-CIK細胞生物免疫在腎癌及淋巴造血系統腫瘤治療方面進行了廣泛的研究,但DC-CIK細胞生物免疫治療在中晚期胃癌的臨床研究報道較少。
DC是目前所知人體內抗原遞呈功能最強大的抗原遞呈細胞,是初次免疫應答的始動者。除了誘導抗原特異性細胞毒性T淋巴細胞,還可以直接或間接方式影響B細胞的增殖,活化體液的免疫反應,有效抵制腫瘤細胞的逃逸[9]。有研究發現DC能夠與NK細胞相互促進,從而增強對腫瘤細胞的殺傷能力[10]。由DC激活的細胞免疫應答在機體抗腫瘤中起著主導作用。DC的數量和功能與腫瘤的發生、發展及預后密切相關。CIK是用細胞因子在體外誘導外周血或臍帶血單個核細胞而得到的一群異質細胞(NK樣T細胞),該細胞兼具T淋巴細胞的抗瘤活性和自然殺傷細胞(NK)的非MHC限制性殺瘤等優點,可通過多種機制直接、間接殺傷腫瘤細胞[7]。CIK細胞主要以CD+3CD8+、CD3+CD56+為效應細胞,是目前臨床過繼免疫治療中最為有效的效應細胞,其對腫瘤的微轉移及殘留病灶的清除方面具有顯著的療效[11]。DC、CIK細胞是抗腫瘤免疫中兩個重要的組成部分,DC識別腫瘤抗原、激活免疫系統的作用與CIK高效殺傷腫瘤的作用聯合應用具有協同作用,可產生更強大且更完善的抗腫瘤免疫效應。DC與CIK細胞共培養使得DC和CIK之間相互作用,可促進CIK的體外增殖和成熟,增強CIK的細胞毒活性,同時CIK也能促進DC的成熟,兩者相互作用[6]。共培養可引起DC和CIK細胞表面分子表達和細胞因子分泌的變化,共培養DC和CIK細胞可在體外擴增出大量的特異性的CD3+CD56+細胞,并具有殺瘤活性強、殺瘤譜廣泛、非MHC限制性的特點,具有較強的體內外殺瘤活性[12]。Marten等[13]研究發現CIK可以使DC高表達CD80、CD86和MHC-,促使DC分泌大量IL-2,DC可以促進CIK高表達CD28和CD40。Schmidt等[14]研究發現DC-CIK可降低CIK細胞群中的免疫抑制T細胞(Treg)而增強抗腫瘤活性。
有學者對DC-CIK細胞生物免疫治療聯合全身化療對進展期胃癌的治療效果進行了研究,全身化療采用TP方案(紫杉醇),結果顯示研究組1年累計生存率為62.2%,而對照組為46.7%[15]。蔡俊霞等[6]研究了DC-CIK細胞生物免疫治療對晚期胃癌的近期療效,全身化療采用OF方案(奧沙利鉑+氟尿嘧啶),結果表明與對照組比較,DC-CIK細胞生物免疫治療聯合全身化療后疼痛改善、KPS顯著提高;研究組對腫瘤的控制率為78.6%,而對照組為53.6%。仁愛軍[16]觀察了術后全身化療聯合DC-CIK生物免疫治療對胃癌患者的臨床應用效果,化療方案為FOLFOX(奧沙利鉑+氟尿嘧啶+亞葉酸),結果顯示研究組患者治療后臨床療效優于對照組,研究組生存質量評分明顯高于對照組。本課題以中晚期胃癌為研究對象,以臨床受益反應(包括疼痛、止痛藥物使用、全身狀況以及體質量)、臨床獲益率以及生存期為觀察指標。結果表明全身化療聯合DC-CIK過繼免疫治療和全身化療均能夠改善患者的生存狀況,生物治療組和常規治療組在治療后疼痛及全身狀況改善,體重呈增加趨勢;本課題隨訪時間為1年,結果表明全身化療聯合DC-CIK過繼免疫治療的1年生存率為85.3%,全身化療的1年生存率為71.2%,研究結果與上述文獻報道相一致,提示DC-CIK細胞生物免疫治療聯合全身化療對中晚期胃癌具有確切的治療效果,能夠提高中晚期胃癌患者的生存率,改善中晚期胃癌的生存狀況,具有很好的臨床應用前景。本研究結果顯示在DC-CIK過繼免疫治療過程中出現的主要副作用是發熱(發生率41.2%),其余為惡心、乏力以及注射部位疼痛等(發生率17.6%),經對癥治療后均緩解。這一結果與文獻報道[6,15]相一致,表明DC-CIK過繼免疫治療是安全的。
隨著抗腫瘤免疫研究的進一步深入,腫瘤過繼免疫治療不斷取得進展。在DC細胞研究方面,有實驗表明,經不同細胞因子分別誘導出DC和CIK細胞,熱休克方法處理胃癌MKN-28細胞株并制備腫瘤抗原用于負載DC,與CIK細胞共培養,結果發現效靶比為20∶1時,負載MKN-28抗原的DC-CIK(Ag-DC-CIK)組對MKN-28的殺傷活性遠大于未負載MKN-28抗原的DC-CIK組和單純CIK組,說明以熱休克凋亡腫瘤細胞抗原負載的DC能促進CIK細胞增殖分化,并提高其對胃癌細胞的殺傷活性[17]。有實驗結果表明將腫瘤細胞與DC相融合所形成的腫瘤細胞/DC疫苗能夠表達源于這兩種細胞的特征性抗原,能夠有效地增強腫瘤抗原呈遞給宿主T細胞識別的能力,可產生明顯刺激T細胞增殖和CTL對腫瘤的特異性殺傷作用,從而打破腫瘤的免疫耐受[18]。龐沖等[19]采用腎癌干細胞(KSC)和肺癌干細胞(LSC)制備腫瘤抗原(CSC),健康產婦臍帶血體外誘導擴增制備DC和CIK細胞,將CSC抗原負載DC,與CIK細胞共培養,結果提示CSC抗原負載DC活化CIK(CSC-DC-CIK)對同源腫瘤細胞有更好的殺傷作用。唐家平等[20]探討了胃癌干細胞抗原負載DC聯合CIK對胃癌細胞的影響,結果發現經胃癌干細胞抗原刺激的DC,DC表面成熟標志CD83和CD86表達明顯增加,CD83和CD86表達率為80.4%,高于DC組、DC-CIK組和胃癌細胞抗原組;四甲基偶氮唑鹽(MTT)法檢測不同組別對胃癌細胞的殺傷作用,發現胃癌干細胞抗原對胃癌細胞的殺傷率高于胃癌細胞抗原組、DC-CIK組以及DC組,作者認為胃癌干細胞作為抗原刺激DC,可增強DC的免疫表達,促進細胞增殖,提高對胃癌細胞的殺傷作用。
本研究觀察了全身化療聯合DC-CIK過繼免疫治療對中晚期胃癌的近期療效,未能對這種治療方法在中晚期胃癌的遠期療效方面進行分析,是本研究的不足之處。本研究結果顯示全身化療聯合DC-CIK過繼免疫治療能夠提高對中晚期胃癌患者的近期治療效果,能夠提高中晚期胃癌患者的生存率,改善中晚期胃癌的生存狀況,值得在臨床上推廣使用。腫瘤干細胞抗原負載的DC和CIK共培養的抗瘤作用及其分子機制是目前的研究熱點,今后應在這方面進行深入研究。相信隨著腫瘤分子生物學、腫瘤免疫學以及基因工程的發展,腫瘤的免疫治療也將會取得更大的進步,在惡性腫瘤的綜合治療中能夠發揮更大的作用,具有很好的應用前景。
參考文獻
1Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence,mortality,and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world.J Clin Oncol,2006,24: 2137-2150.
2Aiani JA,Mayer RJ,Ota DM,et al.Preoperative and postoperative combination chemotherapy for potentially resectable gastric carcinoma.J Natl Cancer Inst,1993,85: 1839-1844.
3Rahbari NN,Bork U,Motschall E,et al.Molecular detection of tumor cells in regional lymph nodes is associated with disease recurrence and poor survival in node-negative colorectal cancer.A systematic review and meta-analysis.J Clin Oncol,2012,30: 60-70.
4Lo DS,Pollett A,Siu LL,et al.Prognostic significance of mesenteric tumor nodules in patients with stage III colorectal cancer.Cancer,2008,112: 50-54.
5張立煌,王青青.現代腫瘤免疫治療的現狀和展望.浙江大學學報(醫學版),2010,39: 339-344.
6蔡俊霞,吳錦昌,王彬,等.DC-CIK聯合化療治療晚期胃癌的近期療效觀察.南京醫科大學學報(自然科學版),2014,34: 36-40.
7李龍,毛偉征.CIK細胞治療胃癌的研究進展.臨床普外科電子雜志,2014,2: 63-67.
8張慧敏,高習華,劉清池.DC-CIK治療血液腫瘤的研究進展.河北醫藥,2014,36: 3167-3169.
9Snover DC.Update on the serrated pathway to colorectal carcinoma.Hum Pathol,2011,42: 1-10.
10Wehner R,Dietze k,Bachmann M,et al.The bidirectional crosstalk between human dendritic cells and natural killer cells.J Innate Immun,2011,3: 258-263.
11Chan JK,Hamilton CA,Cheung MK,et al.Enhanced killing of primary ovarian cancer by retargeting autologous cytokine-induced killer cells with bispecific antibodies: a preclinical study.Clin Cancer Res,2006,12: 1859-1867.
12葛薇,李長虹,張偉,等.樹突細胞與細胞因子誘導的殺傷細胞共培養增強其體內外抗腫瘤活性.中華血液學雜志,2004,25: 277-280.
13Marten A,Ziske C,Schottker B,et al.Interactions between dendritic cells and cytokine-induced killer cells lead to an activation of both populations.J Immunother,2001,24: 502-510.
14Schmidt J,Klempp C,Markus W,et al.Release of ic3b from apoptotic tumor cells induces tolerance by binding to immature dendritic cells in vitro and in vivo.Cancer Immunol Immunother,2006,55: 31-38.
15單海霞,黃廣清.DC-CIK聯合化療治療進展期胃癌45例的臨床療效評價.胃腸病學和肝病學雜志,2014,12: 1416-1419.
16任愛軍.術后化療聯合DC-CIK生物治療胃癌的療效觀察.河北醫學,2014,20: 972-975.
17張成磊,陳耀平,楊寶珍,等.熱休克胃癌細胞負載DC-CIK細胞殺傷癌細胞活性的研究.檢驗醫學,2012,27: 849-853.
18Zhang M,Berndt BE,Chen JJ,et al.Expression of a soluble TGF-beta receptor by tumor cells enhances dendritic cell/tumor fusion vaccine efficacy.J Immunol,2008,181: 3690-3697.
19龐沖,張騰月,王長利.腫瘤干細胞來源的DC-CIK對同源腫瘤細胞的殺傷作用.天津醫藥,2014,42: 972-976.
20唐家平,李晉,李錦毅.胃癌干細胞抗原負載的DC-CIK對胃癌細胞的殺傷活性.腫瘤防治研究,2013,40: 917-920.
(收稿日期:2014-10-16)
doi:10.3969/j.issn.1002-7386.2015.10.018
【文章編號】1002-7386(2015) 10-1498-05
【文獻標識碼】A
【中圖分類號】R 735.2

