大鼠骨髓基質(zhì)干細胞的體外培養(yǎng)及誘導(dǎo)分化
徐威 貝朝涌 粟謀 陳寧 蔣林彬
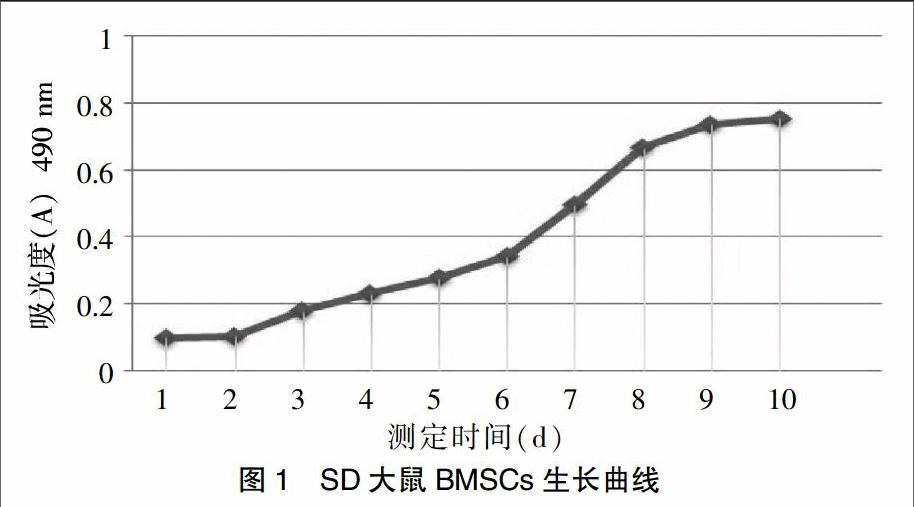
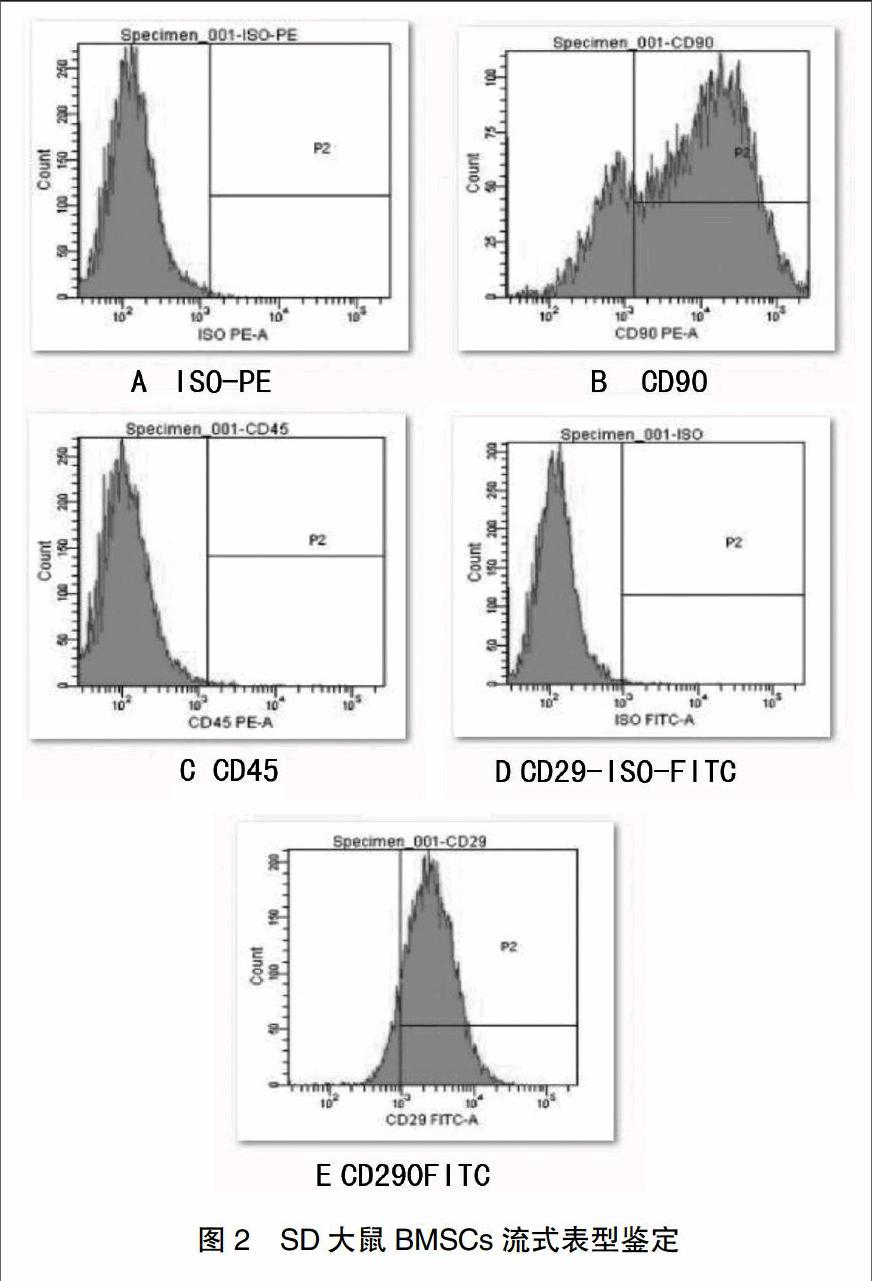
[摘要] 目的 觀察全骨髓貼壁培養(yǎng)法培養(yǎng)骨髓基質(zhì)干細胞的效果。 方法 將4周齡健康SD大鼠脫頸處死后,無菌條件下取出股骨和脛骨,收集骨髓腔細胞懸液,L-DMEM培養(yǎng)基培養(yǎng),通過全骨髓貼壁培養(yǎng)法將細胞純化傳代,觀察其生長特性,繪制生長曲線。流式細胞儀檢測細胞表面標記物CD29、CD45、CD90并作同型對照,細胞分別向成骨、成脂方向誘導(dǎo)分化,觀察誘導(dǎo)結(jié)果。 結(jié)果 經(jīng)全骨髓貼壁培養(yǎng)法培養(yǎng)的SD大鼠BMSCs呈集落狀貼壁生長,鏡下可見細胞成簇生長,類似魚群狀、菊花瓣狀或漩渦狀。BMSCs增殖速度快,細胞形態(tài)穩(wěn)定,生長狀態(tài)較好。生長曲線顯示BMSCs符合正常細胞生長特征且生長活躍。流式細胞儀鑒定CD29和CD90呈陽性表達,CD45呈陰性表達。BMSCs能向成骨、成脂方向誘導(dǎo)分化。 結(jié)論 全骨髓貼壁培養(yǎng)法簡單易行,可獲得純度高,活性好,性狀均一的骨髓基質(zhì)干細胞。
[關(guān)鍵詞] 骨髓基質(zhì)干細胞;分離純化;培養(yǎng);分化;鑒定
[中圖分類號] R414.4 [文獻標識碼] A [文章編號] 1673-9701(2015)32-0030-05
[Abstract] Objective To observe the effect of BMSCs through the method of whole bone marrow adherent culture. Methods After 4-weeks-old healthy SD rats were killed by cervical dislocation, the femur bone and tibia bone were taken out under sterile conditions. Marrow cell suspensions were collected then cultured in L-DMEM medium. The method of the whole bone marrow adherent culture was used to passage purified. The growth characteristic was observed and the growth curve was drawn. CD29, CD45, CD90 of the cell surface markers were detected by flow cytometry and made an isotype control. The cells could be induced to differentiate into osteogenic and adipogenic direction respectively and the results were observed. Results Cultured by the method of the bone marrow adherent, the BMSCs of SD rat showed colony adherent growth and other sharp like cell clusters, similar fish,daisy-like petals or whirlpool under microscope. BMSCs had high rate of proliferation, stabilization of morphology and good growth condition. BMSCs showed the growth characteristics of normal cells and actively growing in the growth curve. The expression of CD29 and CD90 were identified positive by flow cytometry. The expression of CD45 showed negative. BMSCs could be induced to differentiate into osteogenic and adipogenic direction, respectively. Conclusion The method of whole bone marrow adherent culture is simple and can get bone marrow stromal cells of high purity, activity, and homogeneous traits.
[Key words] Bone marrow stromal cells; Isolated and purified; Culture; Differentiation; Identification
1976年Friedenstein等[1-4]從骨髓中分離出骨髓基質(zhì)干細胞(bone marrow stromal cells,BMSCs),并發(fā)現(xiàn)該細胞能在體外大量增殖,貼壁呈集落樣生長,并且具有定向分化的能力。因其取材簡便,克服了部分倫理道德和免疫排斥等問題[5,6],因此受到人們的廣泛關(guān)注。由于BMSCs無特異性的表面抗原表型,因此對BMSCs進行分離、提純、鑒定存在一定的難度。目前,主要有全骨髓貼壁培養(yǎng)法、流式細胞儀分選法、密度梯度離心法和免疫磁珠分選法獲得BMSCs。盡管目前有很多種方法能從骨髓中分離獲取BMSCs,但是仍沒有一個最佳的培養(yǎng)方案[7-9]。……

