免疫細胞化學和形態學分析對良惡性胸腹水鑒別診斷的作用
免疫細胞化學和形態學分析對良惡性胸腹水鑒別診斷的作用
王志祥趙秀平1禹立芳2劉桂清3
(河北北方學院解剖教研室,河北張家口075000)
摘要〔〕目的探討免疫細胞化學和形態學分析在胸腹水細胞學鑒別診斷中的意義。 方法選取河北北方學院附屬第一醫院消化內科,呼吸內科的良、惡性胸腹水患者各30例,應用免疫細胞化學SP法檢測癌胚抗原(CEA)、上皮膜抗原(EMA)、波形蛋白的表達,同時應用計算機圖像分析系統定量測定其脫落細胞的核面積、質面積、核質比、細胞周長、平均直徑、圓度和形狀因子。 結果①惡性胸腹水中腺癌細胞(B組)CEA表達均陽性,EMA部分陽性,波形蛋白均陰性;增生性間皮細胞(A組)EMA和波形蛋白部分陽性,CEA均陰性。CEA單獨診斷的敏感性、特異性、陽性預測值、陰性預測值均最好,聯合檢測EMA+波形蛋白組合的敏感性和特異性較好。②良惡性標本的細胞形態學測量結果顯示:良性組標本的面積、周長等效直徑、長徑、短徑與惡性標本間存在明顯差異,良性組明顯低于惡性組(P<0.05);變異系數在兩組間比較顯示良性組標本的面積、周長等效直徑、長徑、短徑與惡性標本間存在明顯差異,良性組明顯低于惡性組(P<0.05)。 結論①免疫細胞化學在良惡性胸腹水鑒別診斷中有重要作用,CEA單獨診斷以及EMA+波形蛋白聯合檢測均可獲得較好的敏感性、特異性;②形態學定量分析可為鑒別診斷提供參考, 二者綜合分析是提高胸腹水細胞學陽性診斷率的有效途徑之一。
關鍵詞〔〕免疫細胞化學;形態學分析; 腹水; 間皮細胞; 胸腔積液
中圖分類號〔〕R322.4+92〔文獻標識碼〕A〔
1張家口市食品化妝品監督所2張家口市橋東區惠民醫院
3中國人民解放軍251醫院
第一作者:王志祥(1971-),男,碩士,講師,主要從事解剖學教學和消化系統疾病研究。
傳統方法通過對胸腔和腹腔積液進行脫落細胞學檢查以判定疾病的性質,但由于退變的腺癌細胞和增生性間皮細胞外形不易鑒別以及炎癥干擾、細胞退變等因素影響脫落細胞學的診斷,因此臨床實踐中良惡性胸腹水的鑒別仍是困擾臨床的難題。腫瘤細胞在生長過程中分泌多種細胞因子,參與其血管新生和浸潤轉移,已有研究在探究敏感的腫瘤標記物對早期惡性胸腹水做出診斷,而本實驗聯合應用免疫細胞化學結合細胞形態學定量分析,探討二者在胸腹水診斷和鑒別診斷中的意義。
1材料和方法
1.1臨床資料收集2011年1月至2012年1月在河北北方學院附屬第一醫院消化內科、呼吸內科住院患者共60例,其中良性組(A組)30例,包括18例結核性胸水,胸部CT檢查、PPD實驗以及痰中結核桿菌陽性診斷;12例肝硬化腹水,腹部B超診斷、肝功谷草轉氨酶升高、乙肝系列表面抗原陽性,男15例,女15例,年齡18~71〔平均(45.4±3.8)〕歲;惡性組(B組)30例,其中15例血性胸水,支氣管鏡或胸膜活檢病理證實為肺腺癌;15例腹水,胃鏡活檢或腹腔鏡活檢診斷為胃癌或卵巢癌,男21例,女9例,年齡39~79〔平均(59.7±4.5)〕歲,兩組患者的年齡,性別比例無明顯差別(P>0.05),存在可比性。
1.2實驗方法患者入院確診后即刻抽取新鮮胸腹水,沉淀5 min后,留取沉淀部分約10 ml,在自動涂片離心機(日本櫻花精密機械有限公司產品)離心10 min (2 100 r/min),棄上清液,將沉淀在載玻片上的細胞均勻涂在常規HE染色的玻片,每例一張,在抹有APES載玻片上涂片,每例3張,稍干后,一張常規涂片放入950 ml/L乙醇中固定15 min,HE染色,置于40倍鏡下觀察,選擇細胞密集重疊較少的區域采圖, 使用CMIAS真彩色病理圖像分析系統采集細胞涂片的顯微圖像, 然后選擇細胞分布較均勻、細胞邊界清晰的視野采集4~10幅400倍圖片,保證有核細胞200個以上,對有核細胞進行自動分割,輔以手工分割,對分割出的單個細胞進行各種形態學參數自動測量,采集的細胞形態學參數如下: ①面積; ②周長; ③等效直徑;④長徑;⑤短徑;⑥長短徑比;⑦形狀因子;⑧圓形度;⑨異形指數。 良性與惡性標本間細胞形態學對其所示細胞在 (北京航天大學圖像中心與空軍總醫院圖像開發組產品,CMIAS型,WINDOW98軟件)下測細胞核、質的面積、核質比例、細胞周長、平均直徑、圓度、形狀因子,分割,編輯,統計,獲得脫落細胞形態學原始數據, 對重疊細胞、紅細胞或淋巴細胞予以棄除。 在同一制片、同種染色及光照條件下,每例測定分析細胞50個,校正因子1.1, 抹有APES的涂片稍干后即放入乙醚乙醇液(1∶1)中固定15 min,水洗, 固定后的涂片先用蒸餾水沖洗,再用PBS沖洗3次后,滴加A液(50 ml/L正常羊血清)適量,在室溫、濕盒內各封閉10 min,37℃孵育1 h,PBS沖洗,每次5 min,再依次滴加BC液(二抗及SP液),室溫放置30 min。免疫細胞化學染色采用SP法,三種鼠抗人單克隆抗體均購自北京中山生物技術公司,其工作濃度分別為癌胚抗原(CEA,1∶350),上皮膜抗原(EMA,1∶150),波形蛋白(1∶40),試劑公司提供的已知陽性胸腹水涂片作為陽性對照,以 PBS代替一抗作陰性對照,CEA、波形蛋白的陽性物質位于細胞質,而EMA得陽性物質位于細胞膜。結果按照每張涂片的陽性細胞比例及著色深淺計分進行判定分析, 陽性細胞所占比例判斷,無著色0分,1/3以下著色為1分,1/3~2/3為2分,2/3以上為3分, 陽性強度,無著色0分,淺黃色為1分,棕黃色為2分,棕褐色為3分。 2項相乘0分為-,1~3分為+,4~6分為,7~9分為;將-視為陰性、+視為弱陽性、視為陽性、視為強陽性。
1.3統計學處理采用SPSS11.0軟件進行χ2及t檢驗。
2結果
2.1不同組間細胞形態和免疫細胞化學結果觀察A組涂片中以增生性間皮細胞和淋巴細胞為主,間皮細胞單個散在或成片排列,大小略不一致,細胞核呈圓或卵圓形、多居中,核膜清楚,染色質勻細,有小核仁,胞質豐富,淡伊紅色; B組涂片,癌細胞呈團、腺樣、乳頭樣或散在,細胞大小不一,互相擁擠,核大,大小形狀不一致,核膜厚,染色質粗且分布不均勻,核仁明顯,胞質較少,內可見空泡,可有病理性核分裂像。 免疫細胞化學染色結果A,B兩組有差別,惡性胸腹水中腺癌細胞(B組)CEA表達均陽性,EMA部分陽性(24例),波形蛋白均陰性;增生性間皮細胞(A組)EMA(12例)和波形蛋白(15例)部分陽性,CEA均陰性。見圖1。

圖1 不同組細胞CEA、EMA、波形蛋白表達(DAB,×200)
2.2單獨檢測及聯合檢測的敏感性、特異性、陰陽性預測值對比分析CEA的敏感性和特異性均最好,波形蛋白特異性較好,EMA敏感性和特異性居中,聯合檢測組以EMA+ 波形蛋白組合的敏感性和特異性較好。見表1。
表1三種免疫細胞化學指標檢測的敏感性、特異性、陰(陽)性預測值的對比分析
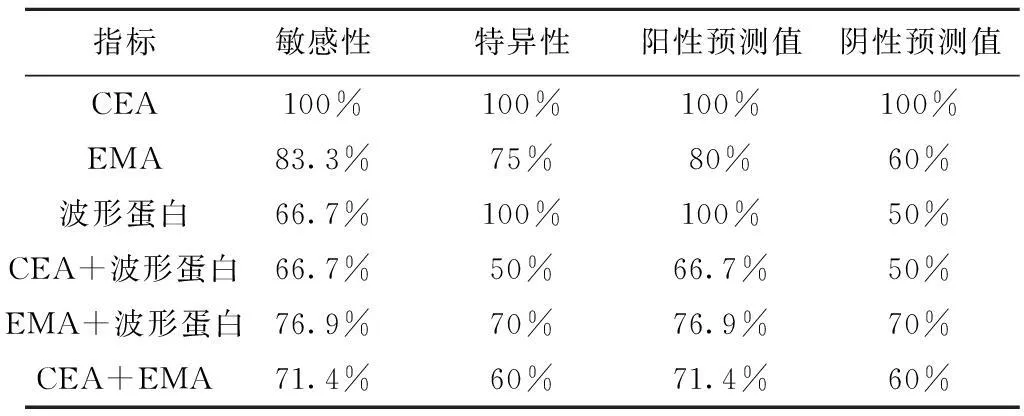
指標敏感性特異性陽性預測值陰性預測值CEAEMA波形蛋白CEA+波形蛋白EMA+波形蛋白CEA+EMA100%83.3%66.7%66.7%76.9%71.4%100%75%100%50%70%60%100%80%100%66.7%76.9%71.4%100%60%50%50%70%60%
2.3不同組別間細胞形態學測定結果及變異系數的比較良性組標本的面積、周長等效直徑、長徑、短徑與惡性標本間存在明顯差異,A組明顯低于B組(P<0.05);變異系數在兩組間比較顯示良性組標本的面積、周長等效直徑、長徑、短徑與惡性標本間存在明顯差異,A組明顯低于B組(P<0.05)。見表2,表3。
表2良惡性胸腹水標本脫落細胞形態學參數測定結果比較(n=30)
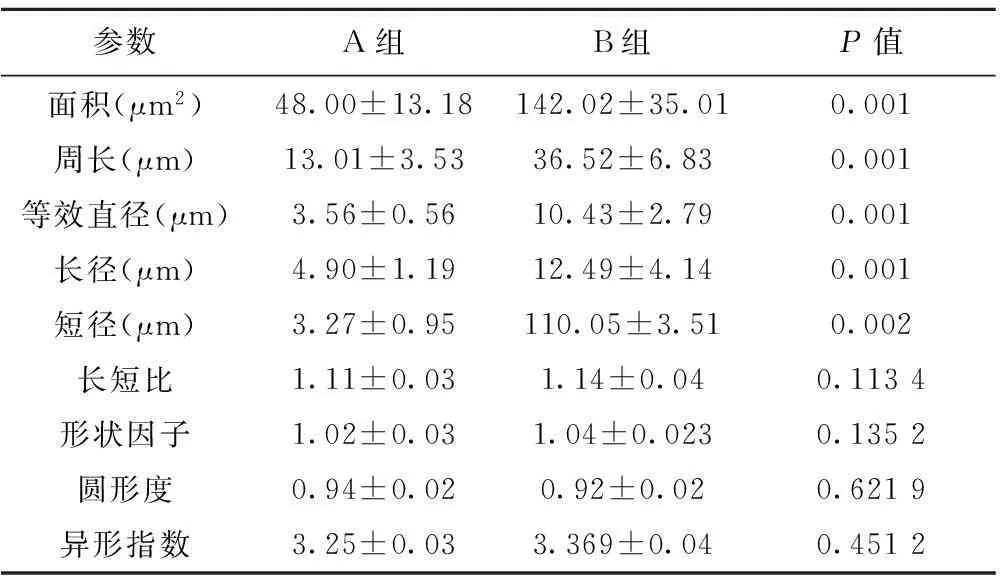
參數A組B組P值面積(μm2)周長(μm)等效直徑(μm)長徑(μm)短徑(μm)長短比形狀因子圓形度異形指數48.00±13.1813.01±3.533.56±0.564.90±1.193.27±0.951.11±0.031.02±0.030.94±0.023.25±0.03142.02±35.0136.52±6.8310.43±2.7912.49±4.14110.05±3.511.14±0.041.04±0.0230.92±0.023.369±0.040.0010.0010.0010.0010.0020.11340.13520.62190.4512
表3良惡性胸腹水標本脫落細胞形態學參數變異系數比較

參數A組B組P值面積(μm2)周長(μm)等效直徑(μm)長徑(μm)短徑(μm)長短比形狀因子圓形度異形指數0.41±0.170.29±0.140.38±0.140.24±0.040.318±0.090.11±0.060.74±0.030.05±0.010.05±0.011.988±0.510.77±0.250.974±0.240.74±0.220.873±0.210.13±0.130.78±0.0240.08±0.030.06±0.040.0010.0010.0010.0010.0010.17620.27250.25540.3562
3討論
炎癥刺激和惡性腫瘤的播散都會導致胸腹膜腔的滲出增加,臨床診斷中多依靠脫落細胞學的形態判別和生化指標的升高,如蛋白濃度、李凡他實驗等,但是由于增生的間皮細胞形態變化多樣,且滲出液中的理化環境對細胞的形態產生嚴重的影響,使很多樣本無法做出及時的判別,而且滲出液中的生化指標也會因炎癥刺激的持續、惡性腫瘤細胞的廣泛壞死等因素而產生誤判。目前的研究也在試圖尋找特異的針對抗體以區分胸腹水的性質,但是目前仍沒有一種抗體對哪種腫瘤是絕對特異性的〔1,2〕。因此多種抗體的聯合篩查必然是增加檢出率的科學手段。
CEA是一組酸性糖蛋白,廣泛存在于各種上皮源性腫瘤,尤其是各種腺癌細胞中表達陽性,體腔間皮細胞中不含CEA,因而是鑒別腺癌和增生性間皮細胞的重要生物學標記物〔3,4〕。 EMA在腺癌中呈陽性表達,間皮細胞呈弱陽性,可配合其他指標鑒別診斷。 波形蛋白是間葉源性腫瘤標記物,絕大多數上皮源性腫瘤為陰性表達,間皮細胞為陽性, 因而可區分腺癌與增生性間皮細胞〔3~5〕。 本實驗選用的這一組特異性抗體進行免疫細胞化學表達,在胸腹水中腺癌細胞和增生性間皮細胞鑒別診斷方面有重要作用。本研究顯示CEA的敏感性和特異性均最好,說明脫落細胞CEA抗原的陽性表達是診斷惡性腫瘤的客觀標準;同時部分良性腹水出現EMA的異常表達和波形蛋白的表達缺失,惡性腹水中EMA的表達缺失和波形蛋白的異常表達。這種情況在多種實體瘤中存在,已有的研究顯示多種上皮來源的腫瘤在演進的過程中,上皮膜的黏附分子出現低表達,同時細胞形態梭形變,并表達間葉組織表型,即上皮間質轉換〔6~8〕。推測本實驗的可能原因是部分腫瘤細胞在分化過程中失去上皮細胞的免疫表型,同時獲得間葉組織的免疫表型,完成上皮-間質轉換,使腫瘤呈現出更強的侵襲性惡性程度增加,導致包括腹水在內的不良體征。因此如果單獨應用一種抗體進行篩選,可能出現假陰性或假陽性,而多種抗體聯合應用可能在腹水鑒別診斷中有價值。本實驗通過對照病理診斷顯示:波形蛋白對良、惡性腹水鑒別價值特異性較好,EMA敏感性和特異性居中,而聯合檢測組以EMA+波形蛋白組合的敏感性和特異性較好。因此,免疫細胞化學用于良、惡性胸腹水的鑒別診斷,具有與組織學同等的價值,同時聯合檢測提高了陽性診斷率。
傳統細胞學診斷主要依據細胞的大小、形態、結構、細胞的產物(如黏液)等,惡性細胞有細胞核的改變(如核增大、深染、核漿比失調,染色質分布不均勻等),細胞互相擁擠等, 有一定的主觀性。 信息技術的發展為細胞學診斷的數字化客觀評價提供了可能。國外學者〔9,10〕用計算機圖像分析系統對胸腹腔滲出液的細胞學涂片分析,發現惡性組的核長軸長度和核面積兩個參數與良性組有顯著差異; 國內研究也發現脫落細胞的面積、周長、最大和最小直徑、形狀因子、核質比等6項形態學參數在82例良性與惡性胸/腹水組間差異有顯著性意義,但相關研究多是在剔除胸/腹水中的淋巴細胞而得出的結論, 存在人為選擇細胞進行分析的主觀因素。而本研究對所采集的圖像視野內所有有核細胞進行形態學定量測定,更為客觀地反映了標本脫落細胞的形態學特點;另外,多數研究涉及胞核的形態學參數, 盡管后者可有一定的診斷價值, 但本研究發現, 軟件的核分割效果比細胞分割差, 常需要輔以手工分割, 實際應用和準確性都有所限制。 因此,本研究僅以自動分割效果良好的細胞形態學參數進行分析,在實踐中也方便和實用。隨著計算機輔助診斷技術和數據挖掘技術的臨床應用不斷深入,定量診斷和自動化診斷成為診斷學的重要發展趨勢, 也為胸/腹水的鑒別診斷開辟了新的途徑。本研究結果與文獻研究報告的一致,說明細胞形態學的觀察和實際測量存在一致性,細胞形態學定量分析在鑒別良惡性胸腹水中有一定的作用,快速、可行,且客觀性強;同時為形態學定量分析提供科學的實驗依據。 兩組胸腹水中細胞的圓度無顯著差異,可能與圖像預處理(如分割等),灰度等原因有關。由于高分化腺癌與增生性間皮細胞的形態學參數閾值缺乏統一標準,尚待進一步研究。因此,圖像分析對良惡性胸腹水的鑒別僅提供參考,仍需結合光鏡下細胞的形態特點和免疫細胞化學結果。
總之,免疫細胞化學在良惡性胸腹水鑒別診斷中有重要價值,形態學定量分析可提供參考,二者綜合分析對鑒別腺癌和增生性間皮細胞具有重要作用,是提高胸腹水陽性診斷率的有效途徑之一。
4參考文獻
1Metzgeroth G,Kuhn C,Schultheis B,etal. Diagnostic accuracy of cytology and immunocytology in carcinomatous effusions〔J〕.Cytopathology,2008;19(2):205-11.
2Zhang KH,Cao F,Fu QB. Detection of mRNAs of GA733 genes by RTPCR in exfoliated cells of pleural and peritoneal effusions and its clinical values〔J〕.Intern Med,2007;46(18):1489-94.
3Dinu M,Ciurea RN,Stefan M,etal. The role of immunohistochemistry in the diagnosis of neoplastic pleural effusions〔J〕. Rom J Morphol Embryol,2012;53(3):817-20.
4Kusama M.Doxifluridine,medroxyprogesterone acetate and cyclophosphamide(DMpC)combination therapy found effective for case of chest wall recurrent breast cancer with bone and pleural metastases〔J〕. Gan To Kagaku Ryoho,2012 ;39(8):123912-41.
5Bildirici U,Celikyurt U,Acar E,etal. The value of serum tumour markers in the prediction of aetiology and follow up of patients with pericardial effusion〔J〕. Cardiovasc J Afr,2012 ;23(3):143-6.
6Suzuki H,Hirashima T,Kobayashi M,etal. Cytokeratin 19 fragment/carcinoembryonic antigen ratio in pleural effusion is a useful marker for detecting malignant pleural mesothelioma〔J〕. Anticancer Res,2010;30(10):4343-46.
7Korczynski P,Krenke R,Safianowska A,etal. Diagnostic utility of pleural fluid and serum markers in differentiation between malignant and non-malignant pleural effusions〔J〕. Eur J Med Res,2009;14(4):128-33.
8Hackbarth JS,Murata K,Reilly WM,etal.Performance of CEA and CA19-9 in identifying pleural effusions caused by specific malignancies〔J〕. Clin Biochem,2010;43(13-14):1051-5.
9Terracciano D,Mazzarella C,Cicalese M,etal. Diagnostic value of carbohydrate antigens in supernatants and sediments of pleural effusions〔J〕. Oncol Lett,2010;1(3):465-71.
10Hamamoto J,Notsute D,Tokunaga K,etal. Diagnostic usefulness of endobronchial ultrasound-guided transbronchial needle aspiration in a case with malignant pleural mesothelioma〔J〕.Intern Med,2010;49(5):423-6.
〔2013-06-17修回〕
(編輯趙慧玲/曹夢園)

