營養缺乏自噬因子1對人腦膠質瘤U251細胞增殖侵襲能力的影響
作者單位:315000 寧波,寧波明州醫院神經外科(江漢清);510630 廣州,中山大學附屬第三醫院(羅侖,梁朝峰)
營養缺乏自噬因子1對人腦膠質瘤U251細胞增殖侵襲能力的影響
江漢清羅侖梁朝峰
【摘要】目的探討營養缺乏自噬因子1對人腦膠質瘤U251細胞增殖侵襲能力的影響。 方法 復蘇培養人腦膠質瘤U251細胞,建立轉染小干擾RNA(siRNA)的NAF1組(si-NAF1組)、陰性對照組(si-NC組)、未轉染siRNA對照組(control組),采用CCK-8實驗檢測細胞增殖能力、平板克隆形成實驗檢測細胞克隆形成能力、細胞劃痕實驗檢測各組細胞遷移能力、Transwell法觀察各組細胞侵襲能力變化。結果與control組比較,NAF1-siRNA干預U251細胞后,si-NAF1組NAF1的mRNA和蛋白表達水平均明顯降低(P均<0.05),其增殖細胞核抗原(PCNA)、基質金屬蛋白酶-9(MMP-9)蛋白表達水平降低,細胞增殖能力下降,克隆形成能力明顯減弱,遷移能力明顯降低,穿過Transwell膜的細胞數量明顯減少(P均<0.05)。si-NC組與control組各項結果比較差異無統計學意義(P>0.05)。結論轉染siRNA后NAF1表達下降,進而下調PCNA水平,抑制人腦膠質瘤U251細胞的增殖能力;同時MMP-9蛋白表達水平下降,抑制U251細胞的遷移和侵襲能力。
【關鍵詞】腦膠質瘤;RNA干擾;細胞增殖;腫瘤侵襲
DOI:10.3969/g.issn.0253-9802.2015.02.004
通訊作者,梁朝峰,E-mail:lcfjeff@163.com
收稿日期:(2014-10-09)
Influence of nutrient-deprivation autophagy factor-1 on the proliferation and invasion of human glioma cell line U251JiangHanqing,LuoLun,LiangChaofeng.DepartmentofNeurosurgery,NingboMingzhouHospital,Ningbo315000,China
Correspondingauthor,LiangChaofeng,E-mail:lcfjeff@163.com
Abstract【】ObjectiveTo investigate the effect of nutrient-deprivation autophagy factor-1 (NAF1) upon the proliferation and invasion of human glioma cell line U251. MethodsResuscitation of human glioma cell line U251 was conducted. The cultured U251 cells were divided into the si-NAF1, si-NC and control groups. CCK-8 assay was performed to assess the proliferation of U251 cells. Plate cloning formation assay was utilized to evaluate the formation of cell cloning. Wound healing assay was conducted to investigate the migration of U251 cells. Changes in the migration of U251 cells were determined by Transwell invasion assay. ResultsThe expression of NAF1 in U251 cells transfected with NAF1-siRNA at both protein and RNA levels was significantly down-regulated compared with those in si-NC and control groups (both P<0.05). The protein expression of proliferating cell nuclear antigen (PCNA) and matrix metalloprotein-9 (MMP-9) was significantly down-regulated. The proliferation, formation of cell cloning and migration of U251 cells in the si-NAF1 group were obviously suppressed, and the count of U215 cells trespassing the Transwell membrane was significantly decreased compared with those in the control group (all P<0.05). There was no statistically significant difference between Si-NC group and the control group in above indexes(P>0.05). ConclusionsAfter transfection with siRNA, the expression of NAF1 was decreased, thereby down-regulating the expression of PCNA and inhibiting the proliferation of U251 cells. Down-regulated expression level of MMP-9 protein suppressed the proliferation and migration of U251 cells.
【Key words】Glioma; RNA interference; Cell proliferation; Neoplasm invasion
腦膠質瘤是最常見的中樞神經系統惡性腫瘤[1]。腦膠質瘤的手術、放射治療、化學治療等治療方法在不斷改進,但其療效仍然未得到明顯提高,患者預后較差,中位生存期僅13個月左右[2-3]。闡明腦膠質瘤生存過程中導致增殖和侵襲的機制,有利于發現新的治療策略[4]。因此,尋找和研究在腦膠質瘤的生物學過程中的關鍵分子具有重要的科學意義和臨床應用價值。營養缺乏自噬因子1(NAF1)基因定位于人4號染色體長臂,是一種新發現的、與細胞能量代謝和增殖凋亡相關的蛋白[5]。近年研究表明,其表達與乳腺癌等多種惡性腫瘤的增殖、侵襲密切相關[6]。已證實其可能通過核因子-κB、Wnt等信號通路影響多種細胞和功能蛋白的表達[7]。該基因有望成為包括人腦膠質瘤在內的多種腫瘤治療靶點[8]。目前,NAF1對人腦膠質瘤細胞增殖、侵襲的作用及其影響機制尚不明確[9]。為此,本研究采用針對NAF1的小干擾RNA(NAF1-siRNA)轉染人腦膠質瘤U251細胞,觀察其對NAF1基因的沉默作用,并進一步探討其對人腦膠質瘤細胞增殖和侵襲能力的影響,現報告如下。
材料與方法
一、實驗材料
人腦膠質瘤細胞株U251由中山大學附屬第三醫院神經外科實驗室凍存。
二、主要試劑和儀器
主要試劑有DMEM高糖培養基,胎牛血清(FBS)、胰酶、磷酸鹽緩沖液(PBS)、Trizol液、脂質體2000( LipofectamineTM2000)購自美國Invitrogen公司;CCK(cell counting kit)-8試劑盒購自日本同仁公司;RT-PCR引物采用Primer 3軟件設計,由Invitrogen公司合成。實時熒光定量PCR試劑盒購自日本Takara公司。兔抗人NAF1抗體、β-actin抗體購自美國BD公司。辣根過氧化物酶標記的山羊抗兔IgG二抗、蛋白免疫印跡顯色試劑盒、插入小干擾RNA的NAF1(NAF1-siRNA)、不表達NAF1的陰性對照siRNA(NC-siRNA)購自廣州安邦生物科技有限公司。主要儀器包括細胞培養箱(美國Kendro公司)、倒置顯微鏡(日本Olympus公司)、酶標儀(美國Molecular Devices公司)、Labcycler48 PCR儀(德國 SensoQuest公司)和Mini-PROTEAN3 蛋白免疫印跡電泳系統(美國 Bio-Rad公司)。
三、實驗方法
1. 細胞培養和siRNA轉染
復蘇培養人腦膠質瘤細胞株U251。以含有10%胎牛血清的DMEM高糖培養基作為培養基,常規培養。細胞融合度達60%時,采用轉染試劑(脂質體2000)和NAF1-siRNA、NC-siRNA,按照試劑盒說明書,分別作為si-NAF1、si-NC組轉染培養48 h。同時設立未轉染空白對照組(control組)。每組設3個復孔,重復3次實驗后取平均值。
2. NAF1 mRNA表達水平檢測
Trizol法提取各組U251細胞的總RNA,逆轉錄合成模板DNA。采用熒光實時定量PCR法檢測NAF1 mRNA表達水平。引物序列:NAF1上游5’-ATCATCATGTTCAATGCTTTTCT-3’,下游5’-TCAA-TGGCATCAGGGCTTCAC-3’,長度173 bp;內參照GAPDH上游5’-CAACGAATTTGGCTACAGCA-3’,下游5’-AGGGGTCTACATGGCAACTG-3’,長度432 bp。PCR反應條件:92℃ 30 s,92℃ 6 s,61℃ 35 s,共50個循環,循環延伸末端收集熒光信號,2-ΔΔCt法分析結果[10]。
3. NAF1 、增殖細胞核抗原、基質金屬蛋白酶-9的蛋白表達強度檢測
U251細胞轉染后48 h,收集細胞,提取蛋白,使用蛋白免疫印跡法分析NAF1、增殖細胞核抗原(PCNA)、基質金屬蛋白酶-9(MMP-9)和內參照GAPDH的蛋白表達強度[11]。
4. U251細胞增殖能力檢測
采用CCK-8法檢測細胞增殖能力。取對數生長期U251細胞,3×103/孔接種于96孔板,每組設3個復孔。培養12 h后分組轉染。細胞轉染后設24、48、72 h時間點,更換無血清培養基,按照試劑盒說明書加入12 μl CCK-8試劑[12]。37 ℃溫箱孵育2 h。用酶標儀測定450 nm處吸光度值。
5. U251細胞克隆形成能力檢測
采用平板克隆形成實驗檢測細胞克隆形成能力。取24、48、72 h時間點的各組U251細胞制備單細胞懸液,調整細胞密度,分別取500個細胞接種于6孔板中,慢速晃動培養10 min,使細胞分散均勻。于培養箱中靜置培養10 d,棄去培養液,多聚甲醛固定后1%結晶紫染色[13]。光鏡下計數細胞克隆數,設定細胞數大于20個為1個克隆,并計算克隆形成率,計算公式為:克隆形成率= (克隆形成數/接種細胞總數)×100%。
6. U251細胞遷移能力檢測
分組轉染U251細胞后分別接種于6孔板。培養至約60%融合度時進行劃痕。PBS沖洗3次去除漂浮細胞[14]。加入無血清培養基繼續培養12 h后拍照,以細胞遷移距離代表細胞的遷移能力。
7. U251細胞侵襲能力檢測
Transwell小室上室加入40 μl稀釋后的Matrigel基質膠,37℃孵育2 h凝固。分組轉染后的細胞接種入小室上室。下室加入400 μl含血清完全培養基。常規培養24 h后取出小室,去除未過膜細胞后甲醇固定。1%結晶紫染色,顯微鏡下拍照,以穿過小孔的細胞數量表示細胞的侵襲能力。
四、統計學處理
結果
一、 siRNA干擾對U251細胞NAF1 mRNA表達的影響
si-NAF1組NAF1 mRNA表達水平為control組的3.5%,為3組中最低(F=38.72,P<0.05),即干擾效率達到96.5%,si-NAF1組與control組比較差異有統計學意義(t=20.38,P<0.05);而si-NC組與control組比較差異無統計學意義(t=0.36,P>0.05),說明NAF1-siRNA的基因沉默效果明顯,見圖1。

圖1 3組U251細胞NAF1 mRNA表達水平的比較
二、siRNA干擾對NAF1、PCNA、MMP-9蛋白表達的影響
與control組比較,si-NAF1組NAF1、PCNA、MMP-9蛋白的表達強度均明顯降低(t分別為32.75、26.88、21.42,P均<0.05),而si-NC組與control組之間的NAF1、PCNA、MMP-9蛋白表達強度比較差異無統計學意義(P均>0.05),見圖2。
三、siRNA干擾對細胞生長曲線的影響
si-NAF1組U251細胞在24、48、72 h時吸光度值均明顯著低于control組 (t值分別為18.65、23.60、35.92,P均<0.05);且細胞增殖能力的差異隨著時間的變化逐漸明顯。而各時間點si-NC組與control組比較差異無統計學意義(P均>0.05),見圖3。

圖23組U251細胞中NAF1、PCNA、MMP-9蛋白表達強度的比較
A:蛋白免疫印跡照片;B:定量分析結果,與control組比較,*P<0.05
四、siRNA干擾對細胞克隆形成能力的影響
各時間點si-NAF1組細胞的平板克隆形成率明顯低于si-NC組與control組(F=45.77,P<0.05),而對照組與si-NC組比較差異無統計學意義(t=0.341,P>0.05),見圖4。
五、siRNA干擾對細胞遷移能力的影響
劃痕12h后,control組和si-NC組的遷移能力未受到明顯抑制,細胞表現出相似的遷移能力。si-NAF1組細胞在劃痕12h時遷移明顯受限;與control組比較,si-NAF1組的遷移距離縮短,見圖5。

圖3 3組 U251細胞生長曲線的比較
六、siRNA對細胞侵襲能力的影響
培養24h后,si-NAF1組呈藍紫色的穿膜細胞數明顯少于對照組,而si-NC組與control組之間的差異不明顯,見圖6。
討論
NAF1蛋白是結合毒性鐵硫簇的NEET家族成員,與細胞的能量代謝有關[6]。近年研究發現,NAF-1可與凋亡相關蛋白Bcl-2/Bcl-XL結合配體發揮作用,調節細胞的自噬和凋亡,并在體內通過調節細胞營養和氧化應激從而影響細胞的生存[15]。
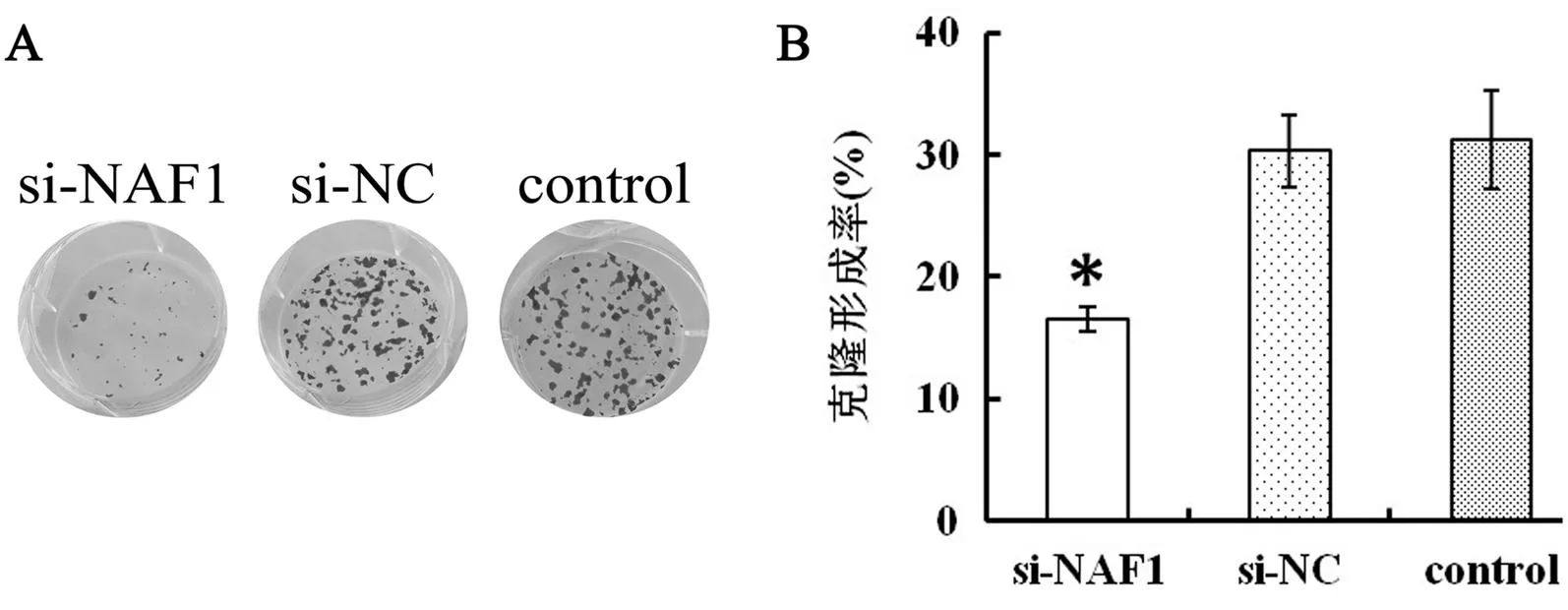
圖43組U251細胞克隆形成能力的比較
A:平板克隆試驗照片;B:定量分析結果,與control組比較,*P<0.05
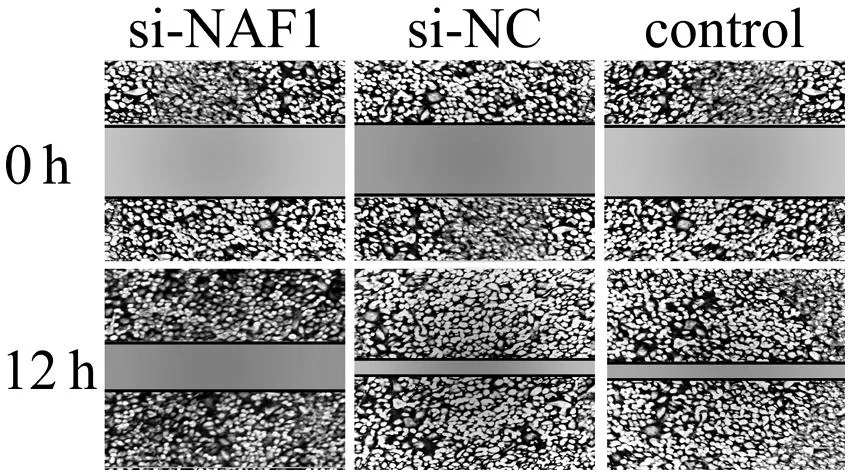
圖5 3組 U251細胞在劃痕12 h后的細胞遷移能力比較
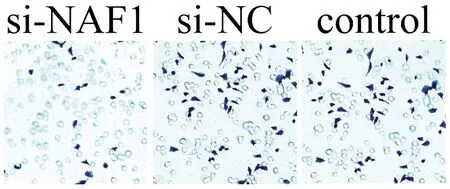
圖6 3組 U251細胞培養24 h后的侵襲能力比較
本研究通過RNA干擾技術,將合成的NAF1-siRNA轉染至人腦膠質瘤U251細胞[16]。結果顯示,siRNA通過沉默NAF1基因的表達,減弱NAF1蛋白表達。研究進一步利用CCK-8試驗和平板克隆形成試驗檢測了沉默NAF1表達后U251細胞的增殖能力。結果表明,細胞在轉染NAF1-siRNA后出現明顯的生長抑制,克隆形成能力也明顯減弱。研究繼而利用細胞劃痕實驗檢測了沉默NAF1表達后U251細胞的遷移能力。結果顯示,轉染NAF1-siRNA后的U251細胞在劃痕12h后,遷移能力受到明顯抑制。研究結果表明,NAF1-siRNA可能通過降低NAF1的表達抑制了人腦膠質瘤細胞的遷移能力。細胞侵襲能力顯示,轉染NAF1-siRNA后,通過凝膠的細胞數量明顯減少,提示腫瘤的侵襲能力隨著NAF1蛋白表達的降低,驗證了NAF1蛋白與U251細胞侵襲能力的相關性。
本研究進一步對U251細胞增殖、侵襲能力變化的可能分子機制進行了研究。結果發現,NAF1-siRNA的抗增殖和侵襲作用可能分別通過下調PCNA、MMP-9蛋白的表達而實現的。PCNA是真核細胞復制復合體的重要組成部分,可以通過調控細胞周期的相關蛋白影響細胞周期,進而影響細胞的增殖能力[17]。既往報道也認為PCNA含量的變化與膠質瘤細胞的增殖能力呈正相關[18]。在本研究中,PCNA表達的抑制可能是人腦膠質瘤細胞增殖能力下降的原因。此外,MMP-9參與了調控細胞外基質的降解和基底膜的破壞等腫瘤侵襲與轉移過程[19]。腫瘤細胞可通過表達和分泌MMP-9等機制金屬蛋白酶,導致基底膜的降解。如果MMP-9表達量降低,人腦膠質瘤細胞的遷移和侵襲能力就會受到明顯抑制[20]。說明NAF1-siRNA對人腦膠質瘤細胞的遷移能力產生了明顯的減弱作用。
U251細胞為典型的人腦膠質瘤細胞株,在抑制其表達NAF1蛋白后,可能通過影響PCNA蛋白的表達,并降低MMP-9蛋白表達,抑制其增殖和侵襲能力。NAF1在膠質細胞瘤中可能發揮了致癌因子的作用,BAF1的靶向性基因治療有望成為提高人腦膠質瘤治療效果、改善預后的有效方法之一。
參考文獻
[1]PottsMB,SmithJS,MolinaroAM,etal.Naturalhistoryandsurgicalmanagementofincidentallydiscoveredlow-gradegliomas:Clinicalarticle.JNeurosurg, 2012, 116:365-372.
[2]SanaiN,BergerMS.Extentofresectioninfluencesoutcomesforpatientswithgliomas.RevNeurol, 2011, 167:648-654.
[3]WestphalM,LamszusK.Theneurobiologyofgliomas:fromcellbiologytothedevelopmentoftherapeuticapproaches.NatRevNeurosci, 2011, 12:495-508.
[4]HuseJT,HollandEC.Targetingbraincancer:advancesinthemolecularpathologyofmalignantgliomaandmedulloblastoma.NatRevCancer, 2010, 10:319-331.
[5]JonesMA,AmrS,FerebeeA,etal.GeneticstudiesinDrosophilaandhumanssupportamodelfortheconcertedfunctionofCISD2,PPT1andCLN3indisease.BiolOpen, 2014,3:342-352.
[6]SohnY,TamirS,SongL,etal.NAF-1andmitoNEETarecentraltohumanbreastcancerproliferationbymaintainingmitochondrialhomeostasisandpromotingtumorgrowth.ProcNatlAcadSciUSA, 2013, 110:14676-14681.
[7]TamirS,ZurisJA,AgranatL,etal.Nutrient-DeprivationAutophagyFactor-1 (NAF-1):BiochemicalPropertiesofaNovelCellularTargetforAnti-DiabeticDrugs.PloSOne, 2013, 8:e61202.
[8]ChaiJC,ParkS,SeoH,etal.Identificationofcancer-specificbiomarkersbyusingmicroarraygeneexpressionprofiling.BiochipJ, 2013, 7:57-62.
[9]JiaH,SaitoK,AwW,etal.Transcriptionalprofilinginratsandanexvivoanalysisimplicatenovelbeneficialfunctionofeggshellmembraneinliverfibrosis.JFunctFoods, 2013, 5:1611-1619.
[10]GuoY,ChenW,WangW,etal.Simultaneousdiagnosisandgenetherapyofimmuno-rejectioninratallogeneichearttransplantationmodelusingaT-cell-targetedtheranosticnanosystem.ACSNano, 2012, 6:10646-10657.
[11]GuoY,LiangX,LuM,etal.Mammaliantargetofrapamycinasanoveltargetinthetreatmentofhepatocellularcarcinoma..Hepatogastroenterology, 2009, 57:913-918.
[12]YeX,GuoY,ZhangQ,etal.βKlothosuppressestumorgrowthinhepatocellularcarcinomabyregulatingAkt/GSK-3β/CyclinD1signalingpathway.PloSOne, 2013, 8:e55615.
[13]WangC,GuoY,WangJ,etal.TheSuppressiveRoleofSOX7inHepatocarcinogenesis.PloSOne, 2014, 9:e97433.
[14]WangJ,OuJ,GuoY,etal.TBLR1isanovelprognosticmarkerandpromotesepithelial-mesenchymaltransitionincervicalcancer.BrJCancer, 2014, 111:112-124.
[15]ChangNC,NguyenM,BourdonJ,etal.Bcl-2-associatedautophagyregulatorNaf-1requiredformaintenanceofskeletalmuscle.HumMolGenet, 2012, 21:2277-2287.
[16]SpenglerRM,OakleyCK,DavidsonBL.FunctionalmicroRNAsandtargetsitesarecreatedbylineage-specifictransposition.HumMolGenet, 2014,23:1783-1793.
[17]StrzalkaW,ZiemienowiczA.Proliferatingcellnuclearantigen(PCNA):akeyfactorinDNAreplicationandcellcycleregulation.AnnBot, 2011, 107:1127-1140.
[18]ChenZ,LiuP,LiC,etal.Deregulatedexpressionoftheclockgenesingliomas.TechnolCancerResTreat, 2013, 12:91-97.
[19]QuailDF,JoyceJA.Microenvironmentalregulationoftumorprogressionandmetastasis.NatMed, 2013, 19:1423-1437.
[20]JinJ,CaiL,LiuZ,etal.miRNA-218inhibitsosteosarcomacellmigrationandinvasionbydown-regulatingofTIAM1,MMP2andMMP9.AsianPacJCancerPrev, 2013, 14:3681-3684.
(本文編輯:林燕薇)
臨床研究論著

