姜黃素對骨肉瘤細胞增殖和凋亡的影響
原向偉+黃秀芳
[摘要] 目的 研究姜黃素對骨肉瘤細胞增殖和凋亡的影響,并探討其機制。 方法 采用姜黃素單體處理人骨肉瘤U2OS細胞,通過臺盼藍拒染法檢測細胞增殖活力,采用流式細胞術和DNA Ladder檢測凋亡,通過Westernblot法檢測p53和caspase-3的表達。 結果 4、8、16、32、64μmol/L姜黃素處理U2OS細胞48h,生長抑制率為:(9.21±3.11)%、(16.85±3.95)%、(29.57±5.33)%、(52.30±6.07)%和(79.16±6.78)%。姜黃素(16μmol/L)在24、48和72h均可誘導U2OS細胞凋亡,凋亡率為:(18.8±3.05)%、(29.6±5.22)%和(57.3±6.62)%,姜黃素(16μmol/L)作用72h后,DNA電泳顯示梯形條帶改變。并且姜黃素作用48h可明顯上調p53的表達和caspase-3的活化。 結論 姜黃素可抑制骨肉瘤U2OS細胞增殖,并通過p53-caspase-3通路誘導凋亡。
[關鍵詞] 骨肉瘤;姜黃素;細胞增殖;凋亡
[中圖分類號] R738.1 [文獻標識碼] A [文章編號] 2095-0616(2017)13-30-04
[Abstract] Objective To evaluate the effect of curcumin on proliferation and apoptosis in osteosarcoma cells and study its mechanisms. Methods Human osteosarcoma U2OS cells were treated with curcumin monomer.Trypan blue exclusion test was performed to evaluate the cell proliferation.Flow cytometry analysis and DNA Ladder assay were performed to examine the cell apoptosis.Westernblot assay was used to detect the expression of p53 and caspase-3. Results After treatment with curcumin (4,8,16,32,64μmol/L) for 48h,the inhibition rates of U2OS cells were (9.21±3.11)%,(16.85±3.95)%,(29.57±5.33)%,(52.30±6.07)%and(79.16±6.78)%.Curcumin (16μmol/L) induced apoptosis in U2OS cells at 24,48,72h.The apoptotic rates were (18.8±3.05)%,(29.6±5.22)% and(57.3±6.62)%.DNA electrophoresis showed ladder change after treatment with curcumin(16μmol/L) for 72h.The expression of p53 and caspase-3 activation were increased after curcumin treatment for 48h. Conclusion Curcumin decreases proliferation and induces apoptosis through p53-caspase-3 pathway in osteosarcoma U2OS cells.
[Key words] Osteosarcoma;Curcumin;Proliferation;Apoptosis
骨肉瘤是人類最常見的骨組織原發惡性腫瘤,常發于青少年,惡性度極高,目前常用治療方法為新輔助化療和手術治療,但療效差,預后不佳[1-2],因此尋找治療骨肉瘤的新方法具有重要意義。中藥抗腫瘤已有上千年的歷史,隨著中藥現代化進程,針對具有抗腫瘤效應的部分中草藥,提取其有效成分并進行深入研究,已成為腫瘤治療的研究新方向[3]。姜黃素(curcumin)是提取自中藥姜黃的一種單體植物多酚,具有多種藥理作用,包括抗腫瘤、抗炎、抗凝、降血脂等[4-5],其可以抑制肺癌、胃癌、膀胱癌等多種腫瘤細胞的生長[6-8],提示了姜黃素在腫瘤治療中的應用價值。本研究探討姜黃素對人骨肉瘤細胞增殖和凋亡的影響,以期為拓展骨肉瘤的治療新方法提供依據。
1 材料與方法
1.1 細胞培養
人類骨肉瘤U2OS細胞來自中山大學病理教研室,培養液為含10%胎牛血清(購自GIBCO公司)、100μg/mL鏈霉素和100U/mL青霉素的DMEM(購自GIBCO公司),培養于5%CO2培養箱(37℃)。均使用對數生長期的細胞作為實驗細胞。
1.2 藥物處理
姜黃素單體(購自Sigma公司)溶于DMSO,儲存于-20℃備用,采用細胞培養液稀釋為工作濃度。
1.3 臺盼藍拒染法檢測細胞增殖
收集各種細胞,采用0.4%臺盼藍(Sigma公司產品)進行染色,死細胞染為藍色,活細胞不染色,隨機選擇10個高倍視野(400×),記錄活細胞數目。計算公式為細胞生長抑制率=[(對照組活細胞數-實驗組活細胞數)/對照組活細胞數]×100%。實驗重復三次取均值作為統計資料。
1.4 流式細胞術檢測U2OS細胞凋亡
收集各組細胞,PBS清洗離心;70%乙醇固定過夜;細胞經10μmol/L的碘化丙啶(PI,Sigma公司產品)染色5min,4℃避光30min;上流式細胞儀(BD FACS Calibur,美國)用488nm激發光檢測細胞DNA含量,LYSIS軟件分析凋亡率。實驗重復三次取均值作為統計資料。
1.5 DNA Ladder法檢測細胞凋亡
收集細胞,PBS清洗后加入0.8mL的DNAzol(Invitrogen公司產品),室溫放置數分鐘,4℃離心15min,將上清移入EP管,加入0.4mL無水乙醇混合,4℃離心10min,棄上清后加入75%乙醇洗2次,待乙醇揮發干凈后加入適量TE溶解基因組DNA,取適量DNA在含有EB的1.8%瓊脂糖凝膠上電泳3小時,紫外線激發下觀察梯形條帶,并使用凝膠成像系統采集圖像。
1.6 Westernblot法檢測p53和caspase-3的表達
收集各組細胞,清洗離心后加入裂解液提取蛋白,采用BCA法定量,配膠加樣,進行SDS-PAGE電泳,電轉蛋白至PVDF膜,采用含5%脫脂奶粉的Tris-HCl緩沖鹽溶液(TBST)4℃封閉過夜;p53和caspase-3抗體(均購自Santacruz公司)1∶1000稀釋后室溫封膜2h,TBST清洗,加入二抗4℃過夜,再次TBST清洗,最后ECL發光,顯影,定影,收集圖像。
1.7 統計學分析
采用SPSS15.0軟件進行統計分析,計量資料以()表示,采用t檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1 姜黃素對骨肉瘤U2OS細胞增殖的影響
4、8、16、32、64μmol/L姜黃素處理U2OS細胞48h后,與對照組相比,U2OS細胞的增殖受到抑制,各組細胞生長抑制率如表1所示,隨著姜黃素濃度的增加,生長抑制率隨之增加,表現出明顯劑量依賴性特征,與對照組比較,差異有統計學意義(P<0.05)。
2.2 姜黃素可誘導U2OS細胞凋亡
我們采用姜黃素16μmol/L處理U2OS細胞24、48、72h后,流式細胞術顯示細胞凋亡率隨之增加,表現出明顯時間依賴性特征,與對照組比較,差異具有統計學意義(P<0.05)。見表2。
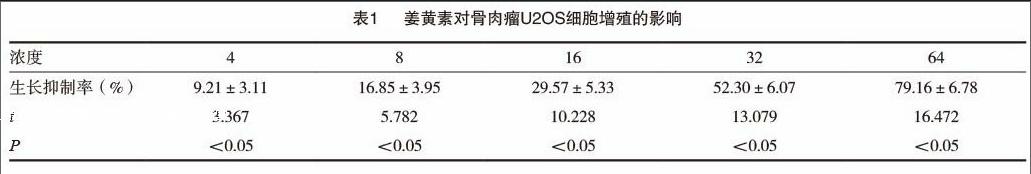
2.3 姜黃素誘導U2OS細胞產生DNA Ladder變化
細胞凋亡時,基因組DNA會在核小體單位之間的連接處斷裂,電泳后可形成梯形電泳條帶(DNA Ladder),是凋亡的特征性表現,也是鑒定凋亡的經典指標[9]。我們采用姜黃素(16μmol/L)處理U2OS細胞24、48、72h后,抽提細胞基因組DNA進行瓊脂糖電泳,結果顯示,與空白對照及其他各處理時間組相比,姜黃素(16μmol/L)處理72h的U20S細胞出現明顯的梯形條帶(圖1),從形態學證明凋亡的發生。
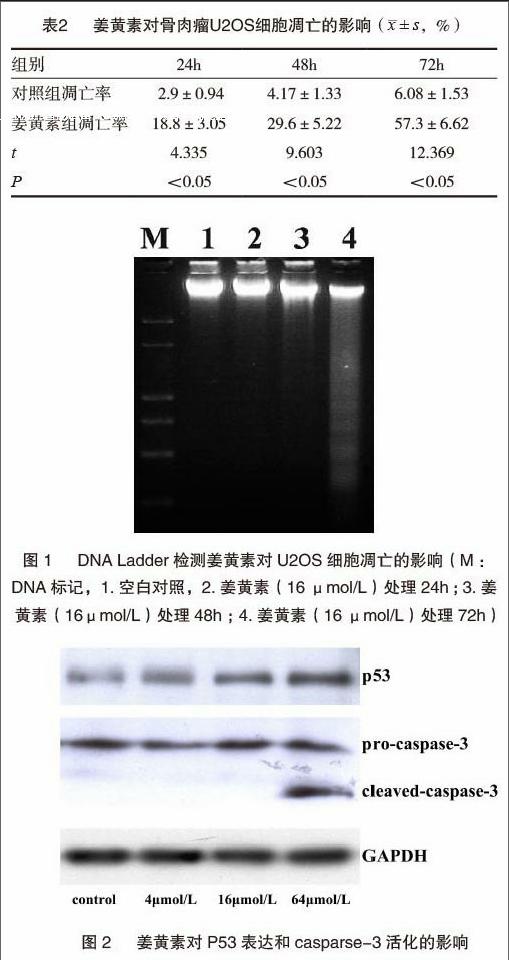
2.4 姜黃素上調p53的表達和caspase-3的活化
不同濃度的姜黃素(4μmol/L、16μmol/L、64μmol/L)處理U2OS細胞48h后,如圖2所示,Westernblot結果顯示抑癌基因p53蛋白水平的表達隨濃度的增加逐漸升高,在64μmol/L組,caspase-3出現明顯活化,裂解出17KD的活性caspase-3片段。
3 討論
近千年來,作為極具中國特色的醫學理論,中醫藥已經在治療人類疾病方面積累了豐富經驗,作為中醫藥的重要組成部分,以自然界植物為主要來源的中藥也獲得世界范圍內的認可,并獲得更為廣闊的市場和前景[10-11]。目前,關于中藥抗腫瘤的現代化研究已有不少報道,發現其抗腫瘤機制涉及凋亡、細胞周期調控、抑制轉移、誘導分化等多個方面[12-14]。然而,在中草藥提取物抗骨肉瘤方面罕有報道,并且相關研究選藥較為局限,缺乏作用機制研究。
骨肉瘤是青少年最常見的骨組織原發惡性腫瘤,早期肺轉移率高,傳統手術+化療對于部分不敏感患者療效差,導致致死致殘率高,預后不佳[15],因此開發新的抗骨肉瘤藥物有著不言而喻的重要意義。我們采用中藥姜黃的提取物姜黃素處理骨肉瘤U2OS細胞,發現其對U2OS細胞的增殖存在明顯的抑制作用,并且抑制效應具有明顯的劑量依賴關系。
CAD(caspase activated DNAase)是細胞中一種能切割染色質的核酸酶,可被caspase-3激活[16],CAD可識別DNA序列中的特定位點,將細胞基因組DNA在核小體單位之間的連接處剪斷,從而形成180~200bp或其整數倍大小的寡核昔酸片段,經瓊脂糖凝膠電泳會出現梯形電泳條帶,是凋亡的特征性表現,因而成為鑒定凋亡的經典指標[9]。我們采用流式細胞術和基因組DNA電泳梯形條帶實驗,從兩方面證實姜黃素具有誘導U2OS細胞凋亡的作用,并且呈明顯的時間依賴關系。
p53是經典的抑癌基因[17],以p53為中心的凋亡通路包括Bax、Bcl-2、p21、Noxa等下游基因以及執行基因組剪切的caspase(半胱氨酸天門冬氨酸蛋白酶)家族和PARP等效應因子,是細胞內重要的凋亡通路[18-19]。我們發現姜黃素可明顯增加p53的表達,從而活化p53凋亡通路。caspase家族中caspase-3是重要的效應成員,在正常情況下,caspase-3以無活性的酶原形式存在,經過p53通路對凋亡信號的轉導而發生活化,裂解出17KD的活化片段,進一步激活其底物PARP,剪切基因組DNA,完成凋亡。
此外據文獻報道姜黃素還具有其他抗腫瘤機制,如姜黃素可通過誘導細胞周期停滯和抑制AKT/mTOR信號通路的活化而抑制人類黑色素瘤細胞的增殖和侵襲[20];姜黃素可下調Wnt/β-catenin通路,從而抑制膠質瘤細胞增殖,并促進其凋亡[21];姜黃素與5-氟脲嘧定聯合作用于鼻咽癌細胞,可抑制Bcl-2的表達,并增強Bax的表達,從而改變Bcl-2/Bax比率,并通過抑制NF-κB活性而誘導凋亡,最終抑制鼻咽癌CNE-2Z細胞的生長[22];姜黃素可抑制Akt的磷酸化同時增強p38MAPK磷酸化,從而在順鉑耐藥的卵巢癌細胞中促進G2/M期細胞周期停滯和凋亡[23]。進一步研究姜黃素在抗骨肉瘤中的分子機制可為開發姜黃素治療骨肉瘤提供依據。
[參考文獻]
[1] Botter SM,Neri D,Fuchs B.Recent advances in osteosarcoma[J].Curr Opin Pharmacol,2014,16C(1):15-23.
[2] Daw NC,Billups CA,Rodriguez-Galindo C,et al. Metastatic osteosarcoma[J].Cancer,2006,106(2):403-412.
[3] 李子強,白曉光,楊志衡,等.姜黃素類化合物與生物活性研究進展[J].中國醫藥工業雜志,2015,46(3):305-311.
[4] 麥鎮江.姜黃素的藥理作用研究進展[J].中藥材,2004,27(9):698-700.
[5] 許東暉,王勝,金晶,等.姜黃素的藥理作用研究進展[J].中草藥,2005,36(11):1737-1740.
[6] Panda AK,Chakraborty D,Sarkar I,et al.New insights into therapeutic activity and anticancer properties of curcumin[J].J Exp Pharmacol,2017,31(9):31-45.
[7] Liu G,Xiang T,Wu QF,et al.Curcumin suppresses the proliferation of gastric cancer cells by downregulating H19[J].Oncol Lett,2016,12(6):5156-5162.
[8] Chen H,Chen L,Wang L,et al.Synergistic effect of fenretinide and curcumin for treatment of non-small cell lung cancer[J].Cancer Biol Ther,2016,17(10):1-8.
[9] Gavrieli Y,Sherman Y,Ben-Sasson S.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J].J Cell Biol,1992,267(19):493-501.
[10] 趙欣,白偉,房濤,等.中藥抗腫瘤機制的研究進展[J].廣東醫學,2014,35(3):466-469.
[11] 王晉,尹軍強,沈靖南,等.32種中草藥提取物體外抗骨肉瘤作用的篩選[J].南方醫科大學學報,2006,26(9):1293-1296.
[12] 林錦璇,王鵬龍,褚福浩,等.新型姜黃素衍生物的合成及其抗癌活性研究[J].中國實驗方劑學雜志,2014,20(7):113-117.
[13] Park BH,Lim JE,Jeon HG,et al.Curcumin potentiates antitumor activity of cisplatin in bladder cancer cell lines via ROS-mediated activation of ERK1/2[J].Oncotarget,2016,7(39):63870-63886.
[14] 倪曉辰,陳硯凝,武新慧,等.去甲氧基姜黃素對人膀胱癌T24細胞增殖及凋亡的影響研究[J].中國全科醫學,2014,17(20):2353-2356.
[15] Bacci G,Lari S.Current treatment of high grade osteosarcoma of the extremity:review[J].J Chemother,2001,13(3):235-243.
[16] Li B,Liu H,Gong F,et al.Molecular epidemiologic correlation analysis between caspase3 gene polymorphism and gastric cancer susceptibility[J].Cell Biochem Biophys,2014,70(3):1647-1653.
[17] Levine AJ,Momand J,Finlay CA.The p53 tumour suppressor gene[J].Nature,1991,351(6326):453-456.
[18] Harris SL,Levine AJ.The p53 pathway:positive and negative feedback loops[J].Oncogene,2005,24(17):2899-2908.
[19] Cory S,Adams JM.The Bcl2 family:regulators of the cellular life-or-death switch[J].Nat Rev Cancer,2002,2(9):647-656.
[20] 韓曉東,周優優,鄭斯文,等.姜黃素對人黑色素瘤細胞株A375和C8161細胞AKT/Mtor信號通路的影響[J].中華皮膚科雜志,2015,48(6):382-386.
[21] 馬光濤,張燕,李晨龍,等.姜黃素通過Wnt/β-catenin信號通路調控膠質瘤細胞增殖和凋亡的實驗眼[J].中華神經外科雜志,2015,31(6):625-630.
[22] 吳強,莊坤,袁慧鈞,等.姜黃素與5氟脲嘧定聯合應用抗鼻咽癌的實驗研究[J].哈爾濱醫科大學學報,2015,48(5):368-372.
[23] Nathan MW,Karuppaiyah S,Vijay KK.Curcumin Induces G2/M Arrest and Apoptosis in Cisplatin-Resistant Human Ovarian Cancer Cells by Modulating Akt and p38MAPK[J].Cancer Biol Ther,2007,6(2):178-184.
(收稿日期:2017-04-26)

