我國(guó)醫(yī)療器械進(jìn)口中存在的問(wèn)題及監(jiān)管制度的優(yōu)化
劉洋 李曉
摘 要:自加入世界貿(mào)易組織以來(lái),我國(guó)醫(yī)療器械進(jìn)口貿(mào)易額呈現(xiàn)穩(wěn)定增長(zhǎng)態(tài)勢(shì),進(jìn)口醫(yī)療器械的品種在擴(kuò)大,部分醫(yī)療器械進(jìn)口對(duì)國(guó)內(nèi)醫(yī)療器械產(chǎn)品的創(chuàng)新起到了促進(jìn)作用。當(dāng)然,我國(guó)醫(yī)療器械進(jìn)口也存在一些問(wèn)題,本文進(jìn)行詳細(xì)的分析,并提出建立境外醫(yī)療器械企業(yè)生產(chǎn)現(xiàn)場(chǎng)檢查制度,完善醫(yī)療器械進(jìn)口代理人監(jiān)管制度、強(qiáng)化海關(guān)口岸查驗(yàn)職責(zé),推動(dòng)與藥監(jiān)部門的合作,細(xì)化大型醫(yī)用設(shè)備配置許可制度,提高醫(yī)用診療設(shè)備的使用效率來(lái)提升我國(guó)對(duì)進(jìn)口醫(yī)療器械安全有效使用的監(jiān)管水平。
關(guān)鍵詞: 醫(yī)療器械進(jìn)口;存在問(wèn)題;監(jiān)管制度; 優(yōu)化路徑
一、我國(guó)醫(yī)療器械進(jìn)口發(fā)展的現(xiàn)狀
(一)醫(yī)療儀器及器械進(jìn)口規(guī)模穩(wěn)步增長(zhǎng)
自我國(guó)加入世界貿(mào)易組織(WTO)以來(lái),醫(yī)療器械進(jìn)口規(guī)模不斷增長(zhǎng)。2017年,我國(guó)醫(yī)療器械進(jìn)口額204億美元,是2002年的10.7倍,年均增長(zhǎng)率為17.1%。其中,醫(yī)用敷料進(jìn)口額3.68億美元,醫(yī)用耗材29.3億美元,醫(yī)院診斷與治療設(shè)備146.3億美元,保健康復(fù)用品16.5億美元以及口腔器材77.8美元,與2016年相比分別增長(zhǎng)了9.2%、11.3%、9.6%、12.0%和1167%。從醫(yī)療器械進(jìn)口重點(diǎn)產(chǎn)品統(tǒng)計(jì)數(shù)據(jù)看,2017年我國(guó)醫(yī)療儀器及器械進(jìn)口額97億美元是2002年的8倍,年均增長(zhǎng)率為14.9%(見表1)。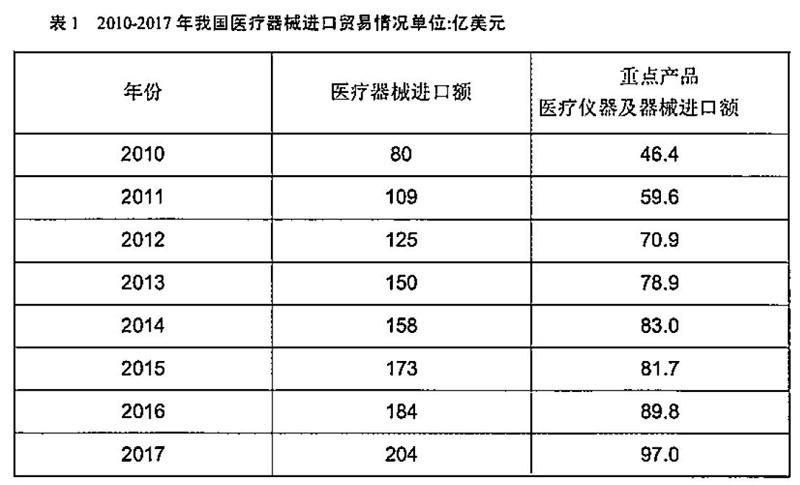
(二)醫(yī)療器械進(jìn)口的范圍不斷擴(kuò)展,主要以中高端醫(yī)療器械為主
近十年來(lái),我國(guó)醫(yī)療器械進(jìn)口的范圍不斷擴(kuò)展,主要進(jìn)口中高端醫(yī)院診斷與治療設(shè)備。由于國(guó)產(chǎn)醫(yī)療器械不論是產(chǎn)能還是研發(fā)遠(yuǎn)遠(yuǎn)不能滿足市場(chǎng)需求,中高端醫(yī)療器械產(chǎn)品嚴(yán)重仍依賴進(jìn)口。三甲醫(yī)院的中高端醫(yī)療器械大多來(lái)自美國(guó)、日本、德國(guó)的進(jìn)口產(chǎn)品。2008年,我國(guó)醫(yī)療器械進(jìn)口排名前十的產(chǎn)品為X射線機(jī)、超聲、X射線斷層掃描、核磁共振成像裝置、內(nèi)窺鏡、監(jiān)護(hù)儀、眼科設(shè)備、腎臟透析設(shè)備、麻醉設(shè)備與心電圖記錄儀。2015年,有43個(gè)品種的醫(yī)療器械產(chǎn)品進(jìn)口額超過(guò)1億美元的,同比增加了8個(gè)品種。其中,通用診療設(shè)備、彩色超聲波診斷儀、彌補(bǔ)生理缺陷的康復(fù)用具、X射線斷層檢查儀、內(nèi)窺鏡、核磁共振成像裝置等為主要進(jìn)口產(chǎn)品。2016年,醫(yī)用導(dǎo)管、插管、理化分析儀器、使用光學(xué)射線(紫外線、可見光、紅外線)分光儀、分光光度計(jì)及攝譜儀、診斷類試劑、彩色超聲波診斷儀、檢鏡切片機(jī)、X射線斷層檢查儀、醫(yī)療或獸醫(yī)用X射線應(yīng)用設(shè)備以及彌補(bǔ)生理缺陷的康復(fù)器具等醫(yī)療器械依賴進(jìn)口。與2008年相比,我國(guó)進(jìn)口醫(yī)療器械的產(chǎn)品范圍擴(kuò)大,品種與進(jìn)口金額增加。
(三)部分醫(yī)療器械進(jìn)口促進(jìn)了國(guó)內(nèi)中高端醫(yī)療器械的創(chuàng)新
近幾年來(lái),我國(guó)高端醫(yī)療器械產(chǎn)業(yè)發(fā)展較快,尤其是影像診斷設(shè)備逐步實(shí)現(xiàn)進(jìn)口替代甚至走向出口,超聲、監(jiān)護(hù)等設(shè)備在國(guó)際市場(chǎng)的影響力也逐漸顯現(xiàn)。2016年我國(guó)彩色超聲波診斷儀進(jìn)口9.4億美元,出口5.3億美元;X射線斷層檢查儀,進(jìn)口6.83億美元,出口4.19億美元。隨著創(chuàng)新醫(yī)療器械政策的推出,企業(yè)研發(fā)投入力度的加大,在影像設(shè)備領(lǐng)域,國(guó)產(chǎn)數(shù)字化醫(yī)用X射線機(jī)(含平板DR)設(shè)備的技術(shù)水平得到快速發(fā)展,萬(wàn)東、聯(lián)影、東軟的產(chǎn)品逐漸占領(lǐng)國(guó)內(nèi)DR市場(chǎng),進(jìn)入優(yōu)秀國(guó)產(chǎn)醫(yī)療設(shè)備目錄,逐漸被三甲醫(yī)院采購(gòu)。尤其萬(wàn)東醫(yī)療實(shí)現(xiàn)全影像鏈核心部件自主研發(fā),有望成為放射影像領(lǐng)域成長(zhǎng)快、規(guī)模大的產(chǎn)品線。2017年國(guó)內(nèi)影像類設(shè)備(CT)市場(chǎng)占有率,通用電氣32%、西門子26.2%、飛利浦22%、佳能10.7%、東軟醫(yī)療7.4%、聯(lián)影1.1%,其他0.5%。通過(guò)醫(yī)療器械中高端產(chǎn)品的進(jìn)口,促進(jìn)了國(guó)內(nèi)醫(yī)療器械的創(chuàng)新發(fā)展。未來(lái),體外診斷試劑、心血管及外科器械、血透以及醫(yī)學(xué)影像等領(lǐng)域進(jìn)口替代的空間巨大。
(四)醫(yī)療器械進(jìn)口合格率高,來(lái)源地以德國(guó)、美國(guó)與日本等國(guó)家為主
2013-2017年期間進(jìn)口產(chǎn)品合格率保持在84%以上(表2),并且進(jìn)口醫(yī)療器械的合格率高于國(guó)產(chǎn)醫(yī)療器械合格率,說(shuō)明進(jìn)口醫(yī)療器械的技術(shù)質(zhì)量水平確實(shí)較高;另一方面也可能由于外資產(chǎn)品抽檢的批次較少原因造成的。我國(guó)醫(yī)療器械進(jìn)口來(lái)源地以美國(guó)、德國(guó)、英國(guó)、瑞士、法國(guó)、荷蘭與日本、新加坡等國(guó)家為主。2016年我國(guó)醫(yī)療器械主要進(jìn)口的來(lái)源地分別為歐洲、北美洲與亞洲,占比分別為37%、33%與24.5%,主要進(jìn)口國(guó)為德國(guó)、美國(guó)與日本,占比共達(dá)到60%。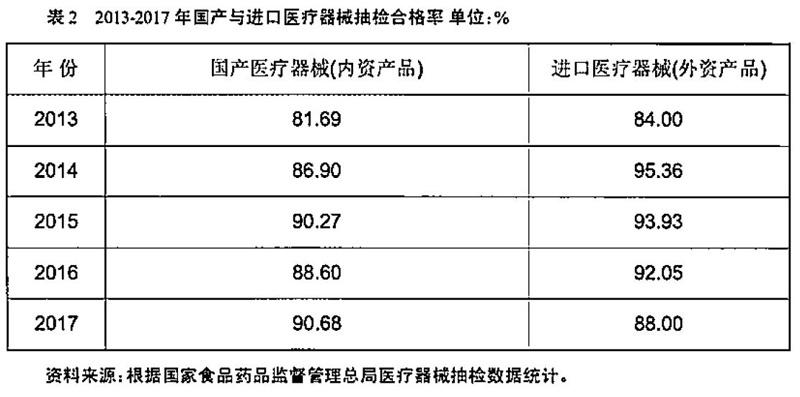
二、醫(yī)療器械進(jìn)口中存在的主要問(wèn)題
近年來(lái),我國(guó)醫(yī)療器械的進(jìn)口量呈現(xiàn)持續(xù)增長(zhǎng)態(tài)勢(shì),確保醫(yī)療器械產(chǎn)品的質(zhì)量安全,防止不合格產(chǎn)品投入使用,加強(qiáng)對(duì)醫(yī)療器械的檢驗(yàn)監(jiān)管成為各級(jí)監(jiān)管部門重要職責(zé)所在。我國(guó)醫(yī)療器械進(jìn)口中存在一些問(wèn)題,主要包括未提供醫(yī)療器械備案憑證、注冊(cè)證、中文標(biāo)簽與說(shuō)明書不合格、進(jìn)口舊的醫(yī)療器械以及花費(fèi)大量外匯進(jìn)口,醫(yī)療器械卻大量閑置,未發(fā)揮作用等。
(一)無(wú)進(jìn)口醫(yī)療器械備案憑證或注冊(cè)證
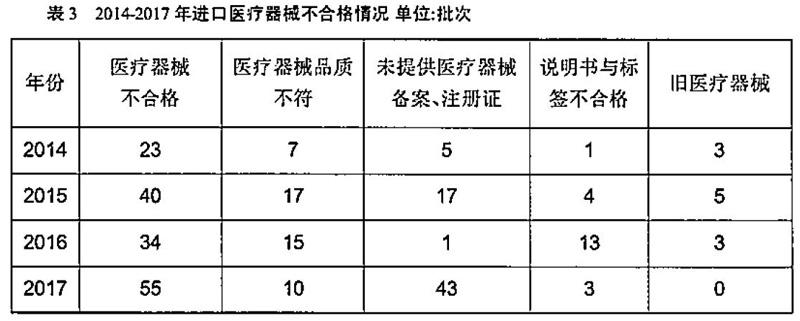
我國(guó)進(jìn)口醫(yī)療器械以中高端產(chǎn)品為主,質(zhì)量水平相對(duì)較高,質(zhì)量狀況較為穩(wěn)定。然而,進(jìn)口醫(yī)療器械不合格批次中,品質(zhì)不符、有缺陷的醫(yī)療器械批次較高。未獲得進(jìn)口醫(yī)療器械備案或注冊(cè)證書是進(jìn)口醫(yī)療器械領(lǐng)域存在較為突出的問(wèn)題。檢驗(yàn)監(jiān)管過(guò)程中發(fā)現(xiàn)冒用、盜用、濫用醫(yī)療器械注冊(cè)證或備案憑證。利用海關(guān)監(jiān)管的盲區(qū)或者產(chǎn)品復(fù)雜不易判別的特點(diǎn),將醫(yī)療器械作為非醫(yī)療器械器械報(bào)關(guān)入境。2014-2017年,未提供醫(yī)療器械注冊(cè)證書或備案憑證分別為5批次、17批次、1批次、43批次(表3)。2017年進(jìn)口工業(yè)產(chǎn)品不合格為627批次,其中,醫(yī)療器械產(chǎn)品共55批次(占比8.8%),43批次產(chǎn)品無(wú)醫(yī)療器械注冊(cè)證或備案憑證、貨證不符或者生產(chǎn)日期不在醫(yī)療器械注冊(cè)證有效期內(nèi)。尤其以2017年8月份的批次居多,共有來(lái)自28個(gè)國(guó)家和地區(qū)的88個(gè)批次的進(jìn)口工業(yè)品存在問(wèn)題,醫(yī)療設(shè)備29批次所占比重為31.8%。此外,還存在主機(jī)是經(jīng)過(guò)進(jìn)口注冊(cè)的合法醫(yī)療器械,而配套的耗材或軟件未經(jīng)注冊(cè)或者假冒、重復(fù)使用的。
(二)進(jìn)口醫(yī)療器械使用說(shuō)明書、中文標(biāo)簽不符合要求
進(jìn)口醫(yī)療器械產(chǎn)品的使用說(shuō)明書和中文標(biāo)簽在《醫(yī)療器械監(jiān)督管理?xiàng)l例》與其配套規(guī)章有明確要求。產(chǎn)品的使用說(shuō)明書及中文標(biāo)簽是經(jīng)醫(yī)療器械注冊(cè)/備案部門審查的受控文件,其中包含了產(chǎn)品注冊(cè)信息和產(chǎn)品技術(shù)要求,是境外醫(yī)療器械生產(chǎn)企業(yè)對(duì)中國(guó)市場(chǎng)銷售產(chǎn)品的一種產(chǎn)品安全承諾。境外企業(yè)應(yīng)當(dāng)在產(chǎn)品最小銷售單元中提供經(jīng)注冊(cè)/備案的說(shuō)明書及中文標(biāo)簽。2014年-2017年醫(yī)療器械說(shuō)明書或標(biāo)簽不合格項(xiàng)分別為1項(xiàng)、4項(xiàng),13項(xiàng)和3項(xiàng)(表3)。2017年上海地區(qū)進(jìn)口醫(yī)療器械33704批,不合格8863批,退運(yùn)及銷毀106批。其中,主要原因是中文標(biāo)簽和說(shuō)明書不符合要求。
(三)仍存在少量舊的醫(yī)療器械進(jìn)口
《貨物進(jìn)出口管理?xiàng)l例》與《機(jī)電產(chǎn)品進(jìn)口管理辦法》中明令禁止舊的、二手翻新醫(yī)療設(shè)備進(jìn)境。舊醫(yī)療器械在使用中存在巨大的安全風(fēng)險(xiǎn)隱患,一方面舊的醫(yī)療器械難以保證其準(zhǔn)確性與安全性,容易給患者造成傷害,甚至有可能引起醫(yī)源性污染;另一方面會(huì)危及操作人員,造成對(duì)人群傳播疾病。一些企業(yè)或個(gè)人經(jīng)受不住進(jìn)口舊的醫(yī)療器械高額非法利益的誘惑,不惜鋌而走險(xiǎn),將舊的醫(yī)療器械偽報(bào)為新的醫(yī)療器械進(jìn)口。2014年至2017年,口岸檢出的“舊品屬于禁止進(jìn)口舊醫(yī)療器械”分別為3批次、5批次、3批次與0批次(見表2)。2015年4月飛利浦金科威(深圳)實(shí)業(yè)有限公司采取“以舊報(bào)新”的方式進(jìn)口除顫極板(墨西哥)、監(jiān)護(hù)儀用打印記錄模組(加拿大)、除顫極板(奧地利)被責(zé)令退運(yùn)。海關(guān)總署緝私局在2016年11月開展打擊走私舊的醫(yī)療設(shè)備“1018”專案行動(dòng)中,查緝走私舊的醫(yī)療設(shè)備400余臺(tái),案值約3.8億元人民幣,搗毀涉嫌走私舊的醫(yī)療設(shè)備團(tuán)伙19個(gè)。
(四)花費(fèi)巨額外匯進(jìn)口的,醫(yī)療器械,卻被使用單位大量閑置
我國(guó)醫(yī)療機(jī)構(gòu)每年花費(fèi)巨額外匯進(jìn)口大量醫(yī)療設(shè)備,卻大量閑置,未能很好發(fā)揮作用。2016年,北京審計(jì)局審計(jì)發(fā)現(xiàn)5家市屬公立醫(yī)院設(shè)備閑置6.61億元,3年沒(méi)有使用。“十一五”期間,中央財(cái)政安排200余億元用于醫(yī)療設(shè)備購(gòu)置,醫(yī)療設(shè)備的引進(jìn),換來(lái)的卻是大量設(shè)備的閑置,基層醫(yī)院的醫(yī)療器械使用率不足40%。對(duì)于大型醫(yī)療設(shè)備關(guān)鍵看它的使用效率和效益,例如,在北京一臺(tái)CT機(jī)一天要為70到80人次服務(wù);然而在陜西、河南、山東等省的縣級(jí)醫(yī)院,一所醫(yī)院一天下來(lái)最多只會(huì)有7到15位病患來(lái)照CT,使用效率明顯不足。進(jìn)口設(shè)備的售后與維修均由出口企業(yè)國(guó)內(nèi)代理商負(fù)責(zé),一旦由于某些原因?qū)е戮S修延時(shí),耗材供應(yīng)中斷,設(shè)備的使用將面臨癱瘓,從而無(wú)法使用。
此外,進(jìn)口醫(yī)療器械價(jià)格偏高,存在個(gè)別醫(yī)院(進(jìn)口商)與國(guó)外勾結(jié)騙匯套匯的可能。《2013中國(guó)醫(yī)療器械行業(yè)發(fā)展?fàn)顩r藍(lán)皮書》指出,我國(guó)進(jìn)口中高端醫(yī)療器械價(jià)格普遍高于歐美日等原產(chǎn)國(guó)50%-100%,如TOMO放射治療系統(tǒng)等設(shè)備,在歐美日等國(guó)家多為250萬(wàn)美元,我國(guó)進(jìn)口多在500萬(wàn)美元以上。多付出去的外匯可能是返還給進(jìn)口商或醫(yī)療機(jī)構(gòu)的傭金或者代理費(fèi)。
三、醫(yī)療器械進(jìn)口中監(jiān)管制度優(yōu)化途徑
(一)強(qiáng)化境外醫(yī)療器械企業(yè)生產(chǎn)現(xiàn)場(chǎng)檢查制度建設(shè)
進(jìn)口醫(yī)療器械的境外生產(chǎn)企業(yè)應(yīng)當(dāng)按照根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》與相關(guān)配套規(guī)章建立與產(chǎn)品研制、生產(chǎn)有關(guān)的質(zhì)量管理體系。醫(yī)療器械境外生產(chǎn)現(xiàn)場(chǎng)檢查可以督促國(guó)外生產(chǎn)企業(yè)遵守中國(guó)醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范等相關(guān)法規(guī),將產(chǎn)品注冊(cè)、廠房與設(shè)施、質(zhì)量控制、工藝流程、采購(gòu)、文件管理等方面缺陷與問(wèn)題事先處理好,控制了進(jìn)口醫(yī)療器械的使用風(fēng)險(xiǎn)。醫(yī)療器械境外檢查制度還有待進(jìn)一步完善,醫(yī)療器械境外體系檢查工作頻次依然偏低。加強(qiáng)檢查員隊(duì)伍建設(shè)的同時(shí),可以探索利用社會(huì)資源,如第三方認(rèn)證機(jī)構(gòu)進(jìn)行境外體系檢查的監(jiān)管模式。
(二)完善醫(yī)療器械進(jìn)口代理人監(jiān)管制度
進(jìn)口醫(yī)療器械境內(nèi)代理人作為進(jìn)口產(chǎn)品在中國(guó)境內(nèi)的“責(zé)任人”,應(yīng)當(dāng)與境外生產(chǎn)企業(yè)一并對(duì)產(chǎn)品的安全有效性負(fù)責(zé)。進(jìn)口醫(yī)療器械代理人除辦理醫(yī)療器械注冊(cè)或者備案事宜外,還應(yīng)當(dāng)承擔(dān)相應(yīng)食品藥品監(jiān)督管理部門、境外生產(chǎn)企業(yè)的聯(lián)絡(luò);向境外生產(chǎn)企業(yè)如實(shí)、準(zhǔn)確傳達(dá)相關(guān)的法規(guī)和技術(shù)要求等責(zé)任。建立科學(xué)完整的“代理人”管理制度,落實(shí)代理人工作責(zé)任,定期對(duì)進(jìn)口代理商進(jìn)行專項(xiàng)飛行檢查,明確進(jìn)口醫(yī)療器械代理人積極參與境外醫(yī)療器械企業(yè)現(xiàn)場(chǎng)檢查,做好溝通與協(xié)調(diào)工作。
(三)強(qiáng)化海關(guān)職責(zé),推動(dòng)與藥監(jiān)部門的合作
海關(guān)的出入境檢驗(yàn)檢疫部門嚴(yán)格實(shí)施進(jìn)口醫(yī)療器械到貨現(xiàn)場(chǎng)檢驗(yàn)制度,強(qiáng)化對(duì)進(jìn)口醫(yī)療器械檢驗(yàn)監(jiān)管,防止境內(nèi)外不法商人通過(guò)以舊充新、以舊翻新等手段向國(guó)內(nèi)轉(zhuǎn)移舊的醫(yī)療器械。一旦發(fā)現(xiàn),嚴(yán)格依法依規(guī)實(shí)施退運(yùn)或銷毀處理。構(gòu)建海關(guān)與食品藥品監(jiān)督管理部門之間的數(shù)據(jù)共享渠道,保證產(chǎn)品注冊(cè)、產(chǎn)品進(jìn)出境信息的及時(shí)無(wú)縫銜接。借鑒美國(guó)食品藥品管理局的經(jīng)驗(yàn),探索運(yùn)用唯一醫(yī)療器械識(shí)別系統(tǒng)(Unique device identification,UDI),解決醫(yī)療器械產(chǎn)品注冊(cè)、海關(guān)商品編碼、商檢技術(shù)標(biāo)準(zhǔn)與集中采購(gòu)的價(jià)格等問(wèn)題,建立產(chǎn)品質(zhì)量安全信息追溯體系。
(四)細(xì)化大型醫(yī)用設(shè)備配置許可制度,提高醫(yī)用診療設(shè)備的使用效率
針對(duì)進(jìn)口醫(yī)療器械閑置、未能有效發(fā)揮作用問(wèn)題,2017年新修訂的《醫(yī)療器械監(jiān)督管理?xiàng)l例》規(guī)定,醫(yī)療機(jī)構(gòu)配置大型醫(yī)用設(shè)備須經(jīng)省級(jí)以上衛(wèi)生部門批準(zhǔn),并取得許可證,醫(yī)療機(jī)構(gòu)未經(jīng)許可擅自配置使用大型設(shè)備需接受相應(yīng)的處罰。對(duì)大型醫(yī)用設(shè)備配置實(shí)行許可證制度,可以制止醫(yī)療機(jī)構(gòu)盲目追求高端設(shè)備、競(jìng)相拼設(shè)備,防止醫(yī)療機(jī)構(gòu)從“以藥養(yǎng)醫(yī)”走向“以械補(bǔ)醫(yī)”;同時(shí),可以減少不必要的中高端醫(yī)療器械的盲目進(jìn)口,促進(jìn)現(xiàn)有醫(yī)用設(shè)備的合理配置和有效使用,從而控制衛(wèi)生費(fèi)用過(guò)快增長(zhǎng)。當(dāng)然,《大型醫(yī)用設(shè)備配置許可管理目錄》中甲類、乙類目錄需要?jiǎng)討B(tài)調(diào)整,防治抑制了醫(yī)療機(jī)構(gòu)自主采購(gòu)醫(yī)療設(shè)備的合理要求。
(五)打擊團(tuán)伙走私活動(dòng),防止有重大安全隱患的醫(yī)療器械進(jìn)入國(guó)內(nèi)市場(chǎng)
進(jìn)口醫(yī)療器械一般價(jià)格高,利潤(rùn)空間巨大,存在巨大的經(jīng)濟(jì)利益,一些不法分子不惜鋌而走險(xiǎn)采取虛報(bào)、偽報(bào)方式將醫(yī)療器械整機(jī)、整批或散件走私入境,或?qū)⑨t(yī)療器械作為非醫(yī)療器械報(bào)關(guān)入境以及雇傭“水客”攜帶醫(yī)療器械入境,逃避繳納進(jìn)口關(guān)稅以及進(jìn)口許可證監(jiān)管,不僅破壞了正常的進(jìn)口秩序,而且使得醫(yī)療器械安全性與有效性難以保障。《醫(yī)療器械監(jiān)督管理?xiàng)l例》修正案(草案征求意見稿)明確提出,醫(yī)療器械經(jīng)營(yíng)企業(yè)不得經(jīng)營(yíng)已使用的醫(yī)療器械,并明確了法律責(zé)任。海關(guān)緝私部門應(yīng)當(dāng)與出入境檢驗(yàn)檢疫部門一起對(duì)進(jìn)口醫(yī)療器械產(chǎn)品進(jìn)行風(fēng)險(xiǎn)等級(jí)評(píng)價(jià),對(duì)高風(fēng)險(xiǎn)的進(jìn)口醫(yī)療器械實(shí)施動(dòng)態(tài)目錄管理。進(jìn)口高風(fēng)險(xiǎn)價(jià)格高的醫(yī)療器械實(shí)施境外裝運(yùn)前、口岸入境、目的地到貨檢驗(yàn)以及后續(xù)監(jiān)督管理,防止有重大安全隱患的醫(yī)療器械進(jìn)入國(guó)內(nèi)市場(chǎng)。在海關(guān)緝私局內(nèi)部,形成一盤棋思想,積極開展打擊走私翻新醫(yī)療設(shè)備的打擊活動(dòng),通過(guò)查處大案,抓獲犯罪嫌疑人,對(duì)走私不法分子起到威懾作用。
參考文獻(xiàn):
[1]《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國(guó)務(wù)院令第680號(hào)).
[2]《醫(yī)療器械注冊(cè)管理辦法》(國(guó)家食品藥品監(jiān)督管理總局令第4號(hào)).
[3]國(guó)家食品藥品監(jiān)督管理總局 《藥品醫(yī)療器械境外檢查管理規(guī)定(征求意見稿)》。http://www.sda.gov.cn/WS01/CL0050/220710.html .
[4]北京市食品藥品監(jiān)督管理局,《北京市進(jìn)口醫(yī)療器械代理人管理規(guī)定(試行)》.
[5]蔡天智、蘇暢,我國(guó)醫(yī)療器械對(duì)外貿(mào)易現(xiàn)狀與發(fā)展報(bào)告,載于王寶亭、耿鴻武,中國(guó)醫(yī)療器械行業(yè)發(fā)展報(bào)告(2017)[D].北京,2017年10月,P184-186.
[6]陳靜,進(jìn)口醫(yī)療器械批次金額持續(xù)增長(zhǎng),不合格檢出率近三成 2018年01月19日,中新網(wǎng)上海.
[7]劉硯青. 無(wú)奈的浪費(fèi):基層醫(yī)院醫(yī)療設(shè)備為何過(guò)半閑置[J]. 中國(guó)經(jīng)濟(jì)周刊, 2013(25):75-77.
[8]李雨思,進(jìn)口醫(yī)療器械價(jià)格高昂潛藏風(fēng)險(xiǎn),中國(guó)經(jīng)濟(jì)網(wǎng),2013年11月26日.
[9]6種進(jìn)口醫(yī)療器械違法案件表現(xiàn)方式,醫(yī)藥經(jīng)濟(jì)報(bào),2012年6月5日.
 對(duì)外經(jīng)貿(mào)實(shí)務(wù)2018年5期
對(duì)外經(jīng)貿(mào)實(shí)務(wù)2018年5期
- 對(duì)外經(jīng)貿(mào)實(shí)務(wù)的其它文章
- 原油期貨的中國(guó)創(chuàng)造與市場(chǎng)完善
- 我國(guó)跨境電商保稅備貨物流模式發(fā)展面臨的困境與改善途徑
- 中國(guó)智慧旅游城市建設(shè)的基本狀況與國(guó)際經(jīng)驗(yàn)借鑒
- 當(dāng)前我國(guó)高等教育留學(xué)服務(wù)貿(mào)易發(fā)展的新動(dòng)向、新問(wèn)題
- 中國(guó)企業(yè)投資“一帶一路”沿線國(guó)家面臨的政治風(fēng)險(xiǎn)與防范策略
- 由一則案例看速賣通平臺(tái)商標(biāo)侵權(quán)風(fēng)險(xiǎn)之防范
