系統思維在高三電化學復習中的實踐與思考
丁雯
摘要:系統思維是一種重要的解決問題的思維,整體性是其核心思想。作者著眼于闡述系統思維在高三電化學復習課堂中的實踐應用,并根據實踐過程出現的問題提出了自己的思考。
關鍵詞:系統思維;高三電化學;實踐;思考
文章編號:1008-0546(2018)10-0040-03 中圖分類號:G633.8 文獻標識碼:B
高三化學復習的一個鮮明特點就是要幫助學生逐步完善自己的知識結構,形成系統的知識體系,在解決問題的時候能從整體出發,排除無用文字干擾,看到問題的實質,提取有用信息來幫助思考并解決問題。而系統思維可以有效幫助實現這一復習目的。
一、系統思維及其主要觀點
系統思維起源于系統論。它是1945年美籍奧地利人、理論生物學家L.Von.Bertalanffy在1945年創立的。系統論中認為,系統思維是把認識對象作為系統來識物想事。它的主要觀點有:①從整體上認識和解決問題;②深入內容細致分析問題;③重點解決關鍵問題;④向下要關注到更小的系統;向上要看到更大的系統;⑤跳出系統看系統。系統思維的核心思想就是整體性。
二、電化學內容的教材分析
高中化學電化學部分內容出現不止一次,第一次出現在高一必修2的第二專題——化學反應與能量轉化,初步給出原電池和電解池的概念,對學生的要求是從宏觀能量轉化的角度理解化學能和電能之間的轉化,通過對原電池和電解實驗現象的觀察,認識生產生活中一些有關電化學的應用實例。此處并不要求學生認識原電池及電解池的原理,只要求學生知道原電池和電解池的反應實質上是氧化還原反應,對電極反應方程式的書寫要求并不高,更不涉及原電池電解池的設計。第二次出現在選修4化學反應原理中,這一次的呈現和第一次相比,編者特別注意在必修2的基礎上進行深化和提高,如鹽橋裝置的出現可以幫助原電池提高效率,燃料電池原理的剖析,電解原理的應用示例都配上示意圖幫助學生理解,并且各種情況的電極反應方程式也不斷出現。高二選修部分的能力重點在于學生在理解原電池和電解池原理的基礎上,能寫出相應的電極反應式,并能根據有關原理去設計原電池和電解池。在最近幾年的高考中,電化學都是以新的信息包裝成陌生新穎的原電池和電解池呈現出來,學生只有在理解電化學能量轉化的基礎上,根據原電池或者電解池的反應原理,才能正確分析出兩極的電極反應,并結合化學方程式的書寫規則正確寫出電極反應式和總反應式來解決問題。
三、學生學情分析
在高三電化學復習之時,學生已經復習過氧化還原反應以及元素化合物知識,對于陌生物質的化學方程式的書寫也有了基礎。一部分之前電化學掌握不理想的同學會混淆原電池和電解池的電極反應,對電化學中的得失電子的方向,離子的流向不會判斷,對考題中出現的陌生電化學裝置難以找到分析的突破口。
四、教學思路分析
筆者認為在高三一輪復習中電化學內容可以分成三步:
第一步,從系統思維的角度幫助學生找出電化學和氧化還原反應之間的聯系,從“電路中電荷移動形成回路”的這一學生熟悉的物理知識人手,幫助學生先明確原電池和電解池上的電極得失電子的方向,有助于學生更好地從總體上去把握問題的本質,這是電化學知識體系建構中最關鍵的一步。
第二步,在掌握各電極電子得失方向和離子流向的基礎上,根據之前復習的氧化還原反應和離子方程式書寫的規則,將電子得失方向用化學用語——電極反應式正確地表達出來,這也是近幾年高考中第20題的常考形式。
第三步,從化學學科核心素養上來說,化學學科還要追求科學態度和社會責任,將理論聯系實際,用學到的化學知識去解決生活中遇見的問題,幫助學生養成用節約資源、保護環境的可持續發展意識和思想去解決能源問題,認識開發新的電源。
下面就以第一步為例,談談系統思維在高三電化學復習中的應用。
五、系統思維在電化學復習中的應用實例
1.從整體上認識和解決問題
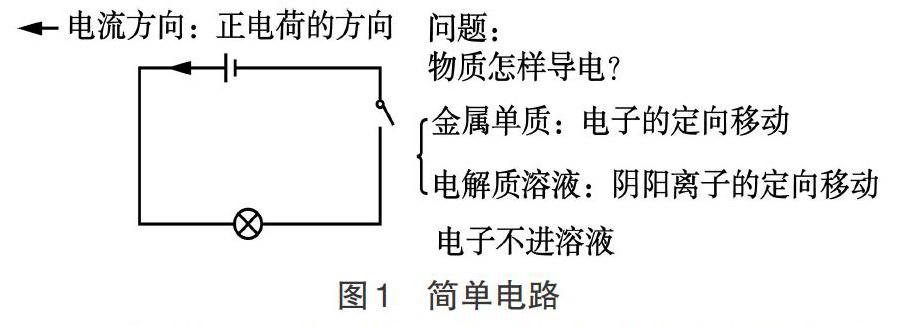
【例1】教師以最簡單的物理電路圖(如圖1)入手,從物質導電性入手,分析金屬導電的原因是電子的定向移動,電解質溶液和熔融電解質是靠陰陽離子的定向移動.明確電子不能進入濃液。
本課引入時,將電化學中的原電池和電解池的內容看作一個系統,但是,如果將學生的已有知識看作一個更大的系統,我們可以跳出這個電化學的子系統,用學生已經掌握的其他子系統知識比如物理上的電化學基礎知識作為引入。對學生來說,死記硬背一個新的知識點總是不如從已經掌握的知識作為新課的引入來得更方便和有效,這也符合認知規律。此處的提問一方面幫助學生掃清帶電微粒的移動這一容易混淆的概念障礙,另一方面就是為了讓學生從已知的知識進入新知識,使復習更加有效。從整體上來看,電化學中的原電池和電解池也就是電路中的電源和用電器,一個是提供能量,即化學能轉化為電能,一個是利用電能,即電能轉化為化學能。這樣一種思維方式,不僅有利于學生從整體上來看電化學知識,有效突破學習難點,而且能更好地理解物理和化學等科學知識的整體性。
2.深入內部細致分析問題
【例2】教師提問1:根據原電池的定義,原電池相當于上述電路圖中的哪個電子元件?比如可以以電池Cu-Zn/H2SO4(aq)為例來分析。
學生回答:原電池是直流電源。
教師提問2:根據電流方向及與之相反的負電荷的方向寫出Cu-Zn/H2SO4(aq)電池兩極的電極反應式。
學生練習。
學生總結:根據負電荷的回路情況,電子是從電源的負極出來,經過外電路,回到電源正極,電源內電路中,陰離子是從正極移向負極,這樣負電荷可以構成一個回路。
此處以具體的Cu-Zn/H2SO4(aq)原電池為模型,幫助學生理清楚原電池電路中的電子得失方向和離子移動方向,即電荷的移動情況。有些學生靠死記硬背的方法,只能記住少數電池的電子轉移情況,下次換個形式出現就又會混淆了,用這個原電池不回避學生靠低效的學習方法記住的內容,而是換一個角度來解讀他們記下的內容,幫助學生理解結論,同時細致深入地分析透徹這一原電池,那么接下來更復雜的電池情況,學生遷移起來將會更加順利。
3.重點解決關鍵問題
【例3】教師提問3:根據電路形成通路看看電源要能輸出電能需要滿足什么條件?
學生回答:1.自發的氧化還原反應(要有電子的得失)
2.兩電極的活潑性要不同(要能形成電勢差)
3.要形成閉合回路
應用延伸:同樣的電池裝置,電極材料的不同和電解質溶液的不同,電極反應就會不同,甚至正負極都會改變。
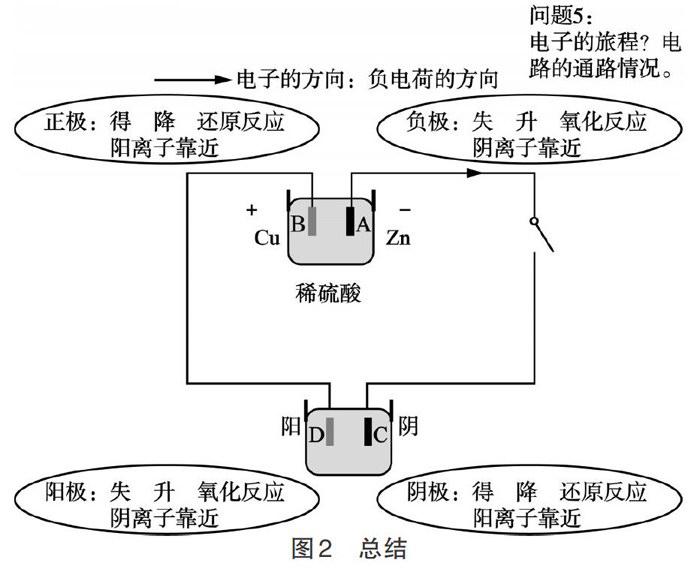
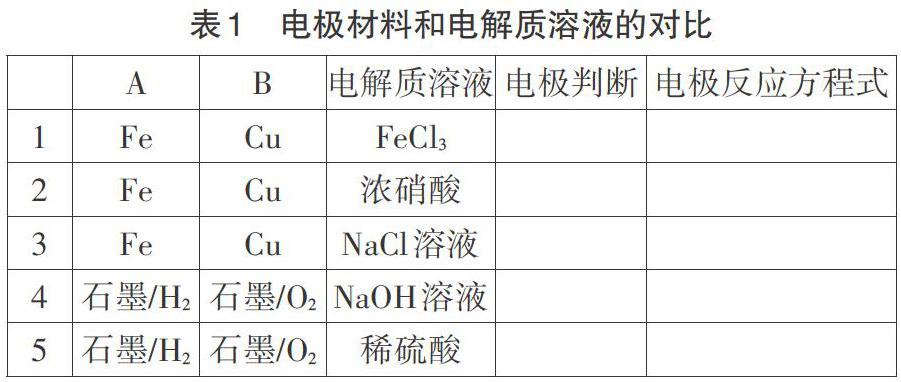
在高考試卷中,電化學部分的內容通常是披著科技信息的外衣,需要學生讀懂題干所給信息去判斷正負極,寫出正確的電極反應方程式。表1中一系列電極材料和電解質溶液的對比有助于學生從本質上理解,負極發生的是失電子反應,流出電子到外電路,正極是得電子的反應,學生也就能理解同樣是銅和鐵作兩極,電解質溶液不一樣,正負極都有可能不一樣,因為不一樣的氧化還原反應,失電子的一方有可能發生改變。在之前復習氧化還原反應中,學生已經知道氧化性(或還原性)強的物質優先得電子(或失電子)。在電極反應方程式的練習過程中,需要加深對環境影響產物這一思想的滲透,根據題中所給信息判斷反應環境,進而判斷反應產物,這一點和高考熱點題型——陌生化學方程式的書寫中的書寫原則是一致的。
4.向下要關注到更小的系統
如果說整體電化學概念的構建是一個系統,那么具體的考題呈現方式和得分點就是更小的系統。作為教師不僅要幫助學生構建整體的知識框架,更要幫助學生知道這部分知識考什么,怎么考,知道考題的方向,在考試中拿分也就不是什么難事了。例3的教學情境不僅可以幫助學生辨析清楚原電池中的概念,關于電極反應式的正確書寫就是常見的考題形式,對這一題型的訓練和糾錯就是關注到更細微的系統,讓學生不僅能看懂題,更能拿到分。
5.向上要看到更大的系統
電化學說到底是得失電子的反應,這就可以聯系氧化還原反應的概念來復習,比如燃料電池的正負極判斷,氧氣做氧化劑,通常是正極,再比如電解池溶液中離子放電順序就和氧化性還原性強弱有關。
6.跳出系統看系統
一般來講,電化學復習是先講原電池,包括高二選修中涉及到的鹽橋,然后是化學電源,也就是鞏固電極反應方程式的書寫以及設計電池,將原電池和電化學的內容全部結束后再講電解池,也就是將原電池和電解池作為兩個獨立知識單元來看。而本節課,在學生復習完電極反應方程式后直接進入電解池的基本裝置。這一設計就是將原電池和電解池看作一個系統,它們是化學能和電能轉化的兩個方向,它們作為電路中的電源和用電器,實現了化學能和電能的相互轉化。系統思維的核心思想就是整體性,我們在找規律時需要將對象按照某一規則劃分成一個特定的整體。那么原電池和電解池它們因為共同完成了化學能和電能之間的相互轉化,將它們看作整體電路的一部分。然后在這一整體電路中根據它們的特點再將整體中的部分用對比和聯系的方法加以整合從而幫助學生從整體上用系統思維的觀點去重新構建知識。
本節課的復習,雖然外觀相似,但是原電池是提供電能的電源,電解池是消耗電能的用電器。電子從電源的負極出發,來到電解池的陰極,電解池溶液中的陽離子靠近陰極得電子,陰離子靠近陽極失電子,失去的電子通過導線回到電源的正極,在原電池內部,陰離子會從正極移向負極,這樣負電荷就可以形成一個閉合回路,各電極上電子得失方向不容易混淆,溶液中陰離子的移動方向也容易記住,陽離子的移動方向恰好相反。分析清楚原電池和電解池中各電極的反應,在最后在一張圖(如圖2)中,既有原電池又有電解池,按照電子的流向加以總結,這樣對電化學中最核心的問題,也就是各電極得失電子的反應、離子的流向、能量的轉化、氧化還原反應的辨析,都能比較牢固地掌握。
本節課最后,結合高考電化學中的常見題型,明確接下來要解決的問題:①電子流向的化學表述即電化學中電極反應方程式的書寫;②得失電子順序,明確電化學復習后階段的方向。這就是對系統的向下延伸。
五、對系統思維在高三化學復習中應用實踐的思考
高中化學學習的一個重要目的是為了應對高考,這就要求在復習中不能以低級的刷題、解題、固定格式為追求,而是要幫助學生學會思維方法、提高思維能力,將知識統整與內化,從而更加有效地提高復習效率,提升化學學科素養。
以電化學為例,因為原電池和電解池都是在兩個電極將氧化還原反應拆成兩個半反應,所以可以將它們看作一個整體,兩者共同實現了化學能和電能的相互轉化,這就體現了系統思維從整體上認識和解決問題的思想。當宏觀基本概念框架搭好后,再深入內部細致分析問題就顯得順理成章并容易得多了。從電路中電子的流向為線索,明確原電池是直流電源,負極流出電子,正極流人電子,電解池是用電器,陰極連到電源負極,所以接收電子,也就是得電子,陽極要把電子給出,通過導線流人電源正極,也就是失電子,這就體現了本文開頭的系統思維的兩個主要觀點,即深入內部細致分析問題和重點解決關鍵問題。那么向下關注到更小的系統,就是本節課最后提到的間題,電極反應方程式的書寫和電子得失順序,聯系之前氧化還原的內容來看,又體現了向上看到更大的系統。
所以,當我們幫助學生從系統思維的角度來思考問題時,就抓住了最核心的問題,即培養學生的學習能力,幫助學生提高學科素養、優化思維方式、提升價值觀念。
參考文獻
[1]苗東升.論系統思維(一):把對象作為系統來識物想事[J].系統辯證學報,2004(7):7
[2]苗東升.論系統思維(二):從整體上認識和解決問題[J].系統辯證學報,2004(10):1
[3]苗東升.論系統思維(三):整體思維與分析思維相結合[J].系統辯證學報,2005(1):7
[4]苗東升.論系統思維(四):深入內部精細的考察系統[J].系統辯證學報,2005(4):1
[5]苗東升.論系統思維(五):跳出系統看系統[J].系統辯證學報,2005(7):1
[6]谷瑩瑩,吳永才.系統思維在高三化學復習教學中的應用研究[J].北學教學,2014(8):34-38

