化學動力學理論視角下實驗教學心像的矯正


摘要: 教師在長期實驗教學歷練過程中,若缺失了化學專業(yè)理論的持續(xù)研習與高端引領(lǐng),就容易形成限于個人理解慣性下的不良實驗教學心像。從化學動力學等理論視角,結(jié)合具體實驗教學與創(chuàng)新實踐案例,對教師如何以專業(yè)理論學習為抓手不斷完善個人化學實驗教學心像等問題進行分析與探討,提出了矯正不良實驗教學心像的實施策略: (1)強化理論學習,糾正實驗認知;(2)審視思維慣性,理解實驗操作;(3)探尋關(guān)鍵要素,引領(lǐng)實驗創(chuàng)新。
關(guān)鍵詞: 實驗教學心像; 化學動力學; 理解慣性; 理論學習; 化學教學
文章編號: 10056629(2019)4008405中圖分類號: G633.8文獻標識碼: B
1 研究背景
心像就是心理圖像,是每個人內(nèi)心中所具有的對現(xiàn)實或未來世界認識與理解的內(nèi)在影像。心像是對世界作出解釋的源泉,主宰了我們對外部世界的解釋,我們總習慣于根據(jù)自己內(nèi)在的影像來賦予外在世界的意義[1]。作家對生活物象的感覺和體驗達到一定程度,就自然產(chǎn)生了創(chuàng)造藝術(shù)形象的要求和沖動;化學教師對實驗的實踐和經(jīng)驗積累到一定程度,面對新的復雜實驗過程、現(xiàn)象與結(jié)果時內(nèi)心也自然會產(chǎn)生個人心像下的慣性理解。但通過純粹經(jīng)驗輸入建構(gòu)的教師個體實驗教學心像,在理解與解釋化學實驗時易限于教師個人經(jīng)驗來源、專業(yè)水平、教育理念、文化背景等諸多因素的影響,存在或多或少非理性的、有悖科學的成分,從而在教學中出現(xiàn)關(guān)于化學實驗的認知偏差和實踐障礙。
要矯正這種不良的非理性實驗教學心像,減少教師心像與客觀事實背離現(xiàn)象的發(fā)生,我們就必須減少個人非理性經(jīng)驗輸入、強化學科理論指導、促進專業(yè)素養(yǎng)提升。本文擬從化學動力學等理論的視角,結(jié)合教學實踐中具體的幾則化學實驗疑難探究與分析案例,對教師如何進一步通過專業(yè)理論學習矯正與完善化學實驗教學心像作簡要探討,拋磚引玉供同行參考。
2 化學動力學和熱力學的教學定位與內(nèi)涵
經(jīng)驗只能把握知識點滴,理論卻能撐起知識大廈。中學化學教材在介紹化學專業(yè)理論時羞答答,讓人霧里看花,致使有些教師教了幾年化學以后,理論水平逐步下滑,甚至慢慢退化到一個普通高中生的認知水平。如一些教師對化學熱力學和動力學的認識并不深刻、理解也不透徹,容易造成認識混淆,甚至知識紊亂、邏輯不清,導致處理諸如平衡移動標志及方向判斷等具體教學問題時,出現(xiàn)首鼠兩端、張冠李戴等不當行為。因此,教師有必要堅持學習,進一步厚實理論修養(yǎng),把握好熱力學和動力學的教學定位、理論內(nèi)涵與應用,從源頭加以理解甄別,提升自身課堂駕馭能力和執(zhí)教水平。
從教學定位角度看,熱力學和動力學的基礎(chǔ)內(nèi)容是中學化學課程的重要組成部分,課程標準對教學目標作了明確分割。學生認識動力學理論的具體要求有: (1)知道化學反應速率的定量表示方法,能通過實驗測定某些化學反應的速率;(2)知道活化能的涵義及其對化學反應速率的影響;(3)通過實驗探究溫度、濃度、壓強和催化劑等對化學反應速率的影響,認識其一般規(guī)律。對熱力學的要求則是: (1)能用焓變和熵變說明化學反應的方向;(2)能描述化學平衡建立的過程,知道化學平衡常數(shù)的涵義并利用化學平衡常數(shù)計算反應物的轉(zhuǎn)化率[2]。
從理論內(nèi)涵對比看,熱力學和動力學是綜合研究化學反應能否發(fā)生、能量變化、反應速率和程度等規(guī)律的兩個不可或缺的重要組成部分,兩者研究任務和側(cè)重點不同,既有顯著區(qū)別也存在必然聯(lián)系。熱力學著眼于反應體系狀態(tài)研究,從靜態(tài)角度出發(fā)通過應用基本原理研究化學反應的始終態(tài),討論化學變化過程中伴隨的能量變化,主要回答化學反應的可能性問題。而動力學從動態(tài)觀點出發(fā),主要著眼于化學反應過程性研究,在特定條件下(溫度、壓強、濃度及介質(zhì)等)通過對個別或少數(shù)分子、原子微觀性質(zhì)層面探討來分析化學反應機理,研究指向內(nèi)外因?qū)瘜W反應速率大小的影響,解決實現(xiàn)化學反應的現(xiàn)實性問題,其中反應速率理論是經(jīng)典化學動力學對反應歷程闡釋的基本理論,包括反應速率的概念和分子碰撞理論基本模型[3]。
3 動力學視角下化學實驗教學心像的矯正
教師心像決定著教師的教育視野,決定著教育行為的可能性和特征,教師教育教學行為的缺陷,歸根到底是其心像局限性導致的[4]。教師實驗教學心像決定了教師與實驗教學間的關(guān)系,若教師對專業(yè)理論知識與化學實驗能力有著深刻認識與足夠自信,那么就可能更積極地實施實驗教學,有效開展實驗探析,大膽改進與創(chuàng)新實驗方案。而現(xiàn)實中很多教師因動力學理解偏廢而實驗教學心像不正,造成照本宣科、固步自封、不求甚解等教學惰性,展示出“不可違背教材實驗內(nèi)容,同行們的理解也沒問題”等錯誤傾向,實踐時很容易引發(fā)誤判而導致教學行為與實驗事實相違背。因此,有必要進一步加強實踐反思與專業(yè)研修,提升動力學理論意識,全面審視和更新實驗認識,積極矯正自身不良的實驗教學心像。
3.1 強化理論學習,糾正實驗認知
速率是動力學概念,平衡是熱力學概念,屬不同范疇,兩者相關(guān)卻不互為因果。因現(xiàn)行教材編寫大多通過速率認識平衡,再基于速率變化討論平衡移動,這種時而速率、時而平衡的展示方式,致中學里動力學理論與熱力學混為一談現(xiàn)象很普遍。有關(guān)實驗方面,因長期受實驗固有經(jīng)驗、同行認識傳襲及教師個人惰性局限,教學時會將某些實驗中的平衡建立想當然地認為是一個很慢或很快的過程,喪失了應有的全面性與深刻性,導致認識片面化,出現(xiàn)一些實驗事實性證據(jù)張冠李戴、胡亂佐證的亂象。所以,一線教師通過加強動力學等理論學習不斷糾正和完善自身實驗認知是非常必要的。
隨著化學教學中數(shù)字化傳感設備的普及,基于傳感技術(shù)進行教學研究方面的素材愈加豐富。其中,NO2和N2O4平衡的探究就是一個創(chuàng)意與爭議并存的熱題。習慣上,通過壓縮(或拉伸)針筒時透光率(或壓強)變化來說明壓強對平衡的影響。如解讀圖1,一般認為t1壓縮和t2擴體表現(xiàn)的峰a、 b,體現(xiàn)了變壓后平衡移動并逐步建立新平衡的過程。
用注射器的傳統(tǒng)方式是側(cè)面觀察顏色變化,即注射器活塞迅速內(nèi)推后,可看到氣體顏色先變深后變淺,最終比壓縮前深。教學中,同行們常將以上現(xiàn)象分解成兩個過程: 內(nèi)推活塞氣體體積驟減,NO2濃度變大,體系顏色加深,這是物理變化過程;后續(xù)顏色漸淺屬化學變化過程,NO2濃度減小表明壓縮時2NO2N2O4平衡正向移動。反之,若外拉活塞,體系顏色則先變淺后變深,最終比擴體前淺,解釋與上類同。
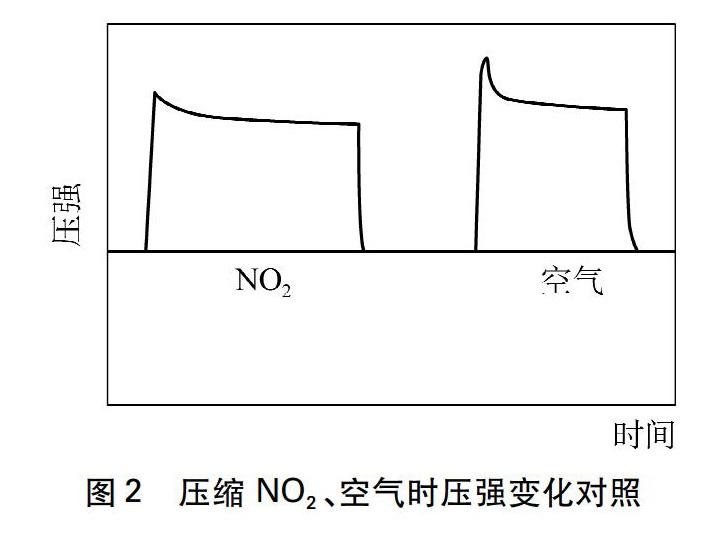
事實是否真如此?有同行證明[5],即使將對象換成空氣后也會出現(xiàn)類似結(jié)果,如等量壓縮NO2、空氣時壓強變化見圖2。解釋是,活塞迅速內(nèi)推會對壓強傳感器感應薄膜產(chǎn)生一個力的沖擊,瞬間壓強增大會讓薄膜因慣性發(fā)生過度形變,隨即薄膜逐步恢復至受力平衡態(tài)才顯示出壓縮后
的真實壓強,這個過程在圖像上就出現(xiàn)了一個峰值。我們認為,從傳感器感應薄膜固有物理性質(zhì)角度分析圖2有一定新意,但為什么色度傳感器不存在感應膜,實驗得圖1也會出現(xiàn)類似變化。可見,上述理由可能還不夠準確和全面。
從2NO2N2O4動力學角度看,生成N2O4屬二級反應,而解離N2O4是一級反應,即此為1~2級可逆反應[6]。 25℃時k正=(9.8±0.9)×106L·mol-1·s-1,k逆=(5.3±0.5)×104s-1。25℃下迅速擴體或縮體,由一個平衡態(tài)過渡到新平衡態(tài)所需時間可用松弛法近似處理[7],計算將原平衡態(tài)99.9%過渡到新平衡態(tài)所需時間約5×10-5s,而操作擴體或縮體一般要0.1s,即平衡在體積變化瞬間便已達成,變體時濃度改變的物理過程和平衡移動的化學過程兩階段不可能有效區(qū)分!有研究指出[8],迅速變體時體系因得到或損失功而會引起升溫或降溫。用溫度傳感器對實驗體系回復至室溫時間進行粗測,一般不少于15s。注射器管壁散熱或吸熱回復到室溫的過程會不斷引起平衡移動,這才是一個能被觀察的漸變過程。
3.2 審視思維慣性,理解實驗操作
有這樣一則小故事: 一聾啞顧客到五金店買鐵釘,將左手兩指作持釘狀放于柜臺,右手作錘打狀。售貨員遞來一把錘子,顧客搖頭并指指作持釘狀的兩手指,售貨員終于拿對了。此時又來一盲人顧客,請你想象盲人將如何用最簡單方法買到一把剪刀?我們絕不能定勢于聾啞人的手勢,因為盲人能說話。所以,思維陷阱是由單純經(jīng)驗慣性造成的,經(jīng)驗在指引我們做出決定的同時,也可能固化我們思維,影響思維發(fā)散與創(chuàng)新。教師基于長期經(jīng)驗積累而自然形成的實驗教學心像,在思考問題時易理解狹隘化、解釋片面化。杜甫詩云:“會當凌絕頂,一覽眾山小。”化學實驗教學需要我們多審視和破除思維慣性,通過加強動力學等理論的學習,增強自己從更高層面思考和研究實驗問題的能力,做到實驗過程知其然并知其所以然,不斷提升實驗操作水平。
例2 Fe(OH)3膠體制備的操作分析與把握
中學制備Fe(OH)3膠體常用FeCl3水解法。魯科版《化學1》教材[9]“練習與活動”中操作是: 首先用潔凈的燒杯取少量蒸餾水,用酒精燈加熱至沸騰,向燒杯中逐滴滴加1mol·L-1FeCl3溶液,至液體呈透明的紅褐色。一般認為用沸水在于促進Fe3+水解。這種理解正確嗎?有如下事實與分析為據(jù)。
(1) 潔凈試管取適量蒸餾水,加熱至沸,滴幾滴1mol·L-1FeCl3溶液,管口放一張濕潤藍色石蕊試紙,管內(nèi)液體澄清但逐漸加深為紅褐色,檢測有丁達爾現(xiàn)象,試紙未顯酸性現(xiàn)象。說明Fe(OH)3膠體生成過程中,未檢測到HCl逸出,即使有也是極少量的。將以上試管繼續(xù)冷卻至室溫,滴1滴稀鹽酸補償可能揮發(fā)出的少量HCl,膠體分散系未被顯著破壞。
(2) A、 B、 C、 D四試管各加等量FeCl3和NaOH溶液,得四等份Fe(OH)3沉淀。A作對照,B、 C、 D在沸水浴中各加熱5min、 15min、 30min,加熱時間越久,試管中渾濁越明顯,顏色也越深。若繼續(xù)用等濃度鹽酸溶解沉淀至恰好消失時,四試管所用酸的體積依次增多。可見,與未加熱相比,F(xiàn)e(OH)3沉淀受熱后更難溶于酸,所以受熱形成的Fe(OH)3膠體冷卻后也較難溶于酸。Fe(OH)3膠粒實際是一些多核鐵配合物或聚合體,組成可簡化表示為Fe2O3·nH2O。加熱或久置時n會逐步減小,顏色加深,也更趨難溶于酸。事實上這也是很多高價金屬氫氧化物的通性。
(3) FeCl3固體和蒸餾水現(xiàn)配1mol·L-1FeCl3溶液,測得pH為0.63,檢測無丁達爾現(xiàn)象;放置過夜,溶液光路逐漸明顯,pH減小到0.40;長時間(數(shù)周以上)放置出現(xiàn)一定程度渾濁,pH進一步下降至0.34。若改變所配FeCl3溶液的濃度,重復實驗,剛配好時都沒有明顯的丁達爾現(xiàn)象,久置后則都有不同程度的丁達爾現(xiàn)象甚至渾濁,pH也逐漸減小。
有同行也證得,通常條件下Fe3+水解平衡是一個較緩慢的建立過程[10]。從動力學機理角度,F(xiàn)e3+加水分解、聚合、老化直至形成不溶物等是一連串復雜多聚過程,主要可分成兩階段: 第一階段通過羥橋化作用,使簡單水解產(chǎn)物聚集成具有特征大小的高正電荷的多聚配合物;第二階段是羥橋化多聚物聚集成更大多聚物(電子顯微鏡觀察起始羥橋化多聚物,實際為直徑2.0~4.0nm球形陽離子),然后通過氧橋化作用進一步降低電荷,此原則是增長成核的過程。具體參見圖3[11]。
到此,可歸納出教材制膠體用沸水的理由。除促進Fe3+水解平衡正向移動外,還在于升溫加快速率以縮短水解平衡建立時間,及引起Fe(OH)3膠粒脫水與晶型轉(zhuǎn)化。所以,演示實驗時加熱操作就成了必備條件。但到底是蒸餾水煮沸后加FeCl3溶液,還是蒸餾水加FeCl3溶液后再加熱,只要操作嫻熟、把握到位就不影響效果,也沒必要死摳。還需指出,若實驗中FeCl3溶液與Fe(OH)3膠體要進行丁達爾現(xiàn)象對照,所用FeCl3溶液務必現(xiàn)配。
3.3 探尋關(guān)鍵要素,引領(lǐng)實驗創(chuàng)新
化學實驗能為學生正確認識物質(zhì)及其變化規(guī)律提供事實依據(jù),促進學生知識體系結(jié)構(gòu)化,培養(yǎng)學生學科思維與科學思想。但受實驗儀器、藥品、裝置、設計思路等影響,平時教學中有些演示實驗現(xiàn)象不明顯、教學效果差,致使學生對實驗結(jié)論產(chǎn)生懷疑,影響效果,也失去了實驗應有的魅力。諸多同行在實驗改進與優(yōu)化方面已做了大量成功嘗試與探索,但受個體不良實驗教學心像的束縛,一些研究仍停留于為改進而改進的層次,流于表面偏多而深入分析的較少,裝置改進偏多而條件探尋的較少,盲目實踐偏多而理論引領(lǐng)的較少。這時刻提醒我們要加強理論研修,從理論視角俯視和認識實驗,探尋成功的關(guān)鍵要素,破解疑難的失敗迷局,不斷實現(xiàn)實驗的改進與創(chuàng)新,更好地利用實驗激發(fā)學生興趣,啟迪學生心智,開拓學生思維。
例3 氯水光解實驗的理論分析與操作創(chuàng)新
氯水光解(見圖4)是一個傳統(tǒng)實驗,但課堂演示卻面臨操作、時限、成功率等方面的弊端,致使現(xiàn)行高中化學教材都很默契地舍棄“傳統(tǒng)”未加編排。故有必要從理論角度對其過程原理進行分析,并實現(xiàn)操作優(yōu)化與創(chuàng)新。
Cl2與水雖能反應生成HCl和HClO,但速率卻很慢,新制氯水中Cl2+H2OHCl+HClO需要較長時間才建立平衡。再者,粗算1L水溶解2L Cl2達飽和時,Cl2濃度約8.9×10-2mol·L-1。由25℃下平衡常數(shù)K=4.2×10-4算得平衡時c(HClO)僅3.0×10-2mol·L-1[12]。可見,縱使飽和氯水中HClO的濃度也很小。我們還需注意Cl2溶解能力較差,溶于水時需很長時間才能達到飽和,實際所用氯水一般都不會是飽和的,所以其中HClO實際濃度比先前理論值還要低得多!還有,氯水光解潛伏期比較長[13],通常需長時間持續(xù)照射才出現(xiàn)少量氣泡。從動力學機理看,HClO光解是光作用下分解出自由基的鏈反應。具體過程為[14]:
鏈引發(fā)HClO光HO·+Cl·
鏈傳遞Cl·+HClOHO·+Cl2
HO·+HClOH2O2+Cl·……
鏈終止Cl·+Cl·Cl2
HO·+HO·H2O2
所以,HClO光解反應可表示為2HClO光H2O2+Cl2,這也印證了文獻[15]“鹵素單質(zhì)的水溶液中存在H2O2分子”的表述。H2O2在酸性介質(zhì)中能穩(wěn)定存在,某些重金屬離子、MnO2、 Co2O3、生物酶等是分解生成O2的優(yōu)良催化劑,而320~380nm波長光對其也有催化分解作用,但能力不足、過程緩慢、效果不突出。因此,陽光照射飽和氯水直接釋放出的O2量一般很少,但若光照前先預加少量MnO2等粉末,則會大大提高O2生成速率與產(chǎn)量。
理論在混沌中建立秩序,從沙礫中找出金子。要優(yōu)化氯水光解實驗以滿足教學需求,化學理論猶如撥云見日般地指明了成功的核心與關(guān)鍵所在: 一要提高氯水中c(HClO),二要讓HClO光照生成的H2O2快速分解為O2。因此,除裝置、光源外操作上要重點把握以下幾點: (1)將常規(guī)方法制得的新制飽和氯水,盛于棕色試劑瓶,暗處密封放置5~10天再實驗;(2)通過加入適量Na2CO3溶液或CaCO3濁液,拉動Cl2+H2OHCl+HClO平衡進一步正向移動;(3)光照前,氯水中要預加少量MnO2、 Co2O3粉末等以催化H2O2快速釋放出O2。
4 結(jié)束語
經(jīng)長期化學實驗教學的歷練,積存在教師頭腦中那些大量實驗經(jīng)驗的表象,在碰到和處理新實驗情境問題時會被充分調(diào)動和活躍起來,并通過理性梳理和個人理解的雙重作用重新進行組合和化合,從而在教師內(nèi)心逐漸形成一個愈發(fā)明晰、具備個人理解慣性特征的解決問題的實驗教學心像。我們必須清醒認識到,經(jīng)驗思維只能把握點滴知識,而理論思維則能夠撐起知識大廈。正如傅鷹教授所說,沒有理論,實驗就可能變成盲動,勞而無功,進步遲緩,或根本不能進步。如果我們在個人實驗教學心像的養(yǎng)成過程中,缺少必要的、持續(xù)的理論學習與反思,失去化學理論的高端引領(lǐng)與撥正,就可能導致心像曲解,而這種不良實驗教學心像本身所具有的失真性與頑固性,很容易將我們引入思維歧途,到時心之所向也就未必真實了。因此,我們只有對化學動力學等理論知識學習、研究、實踐與反思,不斷調(diào)整姿態(tài)武裝好頭腦,有效矯正不當實驗教學心像,方能在化學教學與實驗創(chuàng)新中表現(xiàn)得游刃有余。
參考文獻:
[1][4]李黔蜀. 教師心像的教育意義及完善策略[J]. 教育評論, 2009, (3): 46~48.
[2]吳晗清, 李丹, 趙冬青. “速率”和“平衡”教學亟待澄清的誤區(qū)[J]. 化學教學, 2017, (3): 21~25.
[3]吳新建, 張賢金. 化學平衡、 化學反應速率概念及其關(guān)系的探討[J]. 化學教與學, 2012, (4): 8~9.
[5]劉言濤. 傳感器分析NO2和N2O4平衡常見問題辨析[J]. 化學教與學, 2012, (6): 91.
[6]E.A. Moelwyn-Hughes. Physical Chemistry [M]. London: Oxford University Press, 1961: 1123.
[7]楊志明. 壓力對N2O4解離平衡的影響及演示實驗[J]. 貴陽師院學報(自然科學版), 1983, (1): 117.
[8]沈鴻福. 二氧化氮氣體的體積變化同顏色變化的關(guān)系[J]. 化學教育, 1980, (4): 26.
[9]北京師范大學國家基礎(chǔ)教育課程標準實驗教材總編委會. 普通高中化學課程標準實驗教科書·化學1[M]. 濟南: 山東科學技術(shù)出版社, 2006: 37.
[10]沈彩娣. 對鐵離子水解的幾個異常現(xiàn)象的探討[J]. 中學化學教學參考, 2018, (6): 35~37.
[11]馬瑩, 何靜, 馬榮駿. 三價鐵離子在酸性水溶液中的行為[J]. 湖南有色金屬, 2005, (1): 36~39.
[12]陸燕海, 嵇月萍. 氯水光解實驗的改進[J]. 化學教學, 2012, (7): 47~48.
[13]劉懷樂. 給“氯水”性質(zhì)實驗加幾個注釋[J]. 化學教育, 2010, (5): 76~77.
[14]陳云生. 對次氯酸光照分解產(chǎn)物的探析[J]. 寧德師專學報(自然科學版), 1995, (2): 71~74.
[15]北京師范大學無機化學教研室等. 無機化學[M]. 北京: 高等教育出版社, 1981: 473~528.

