人脂肪干細胞的生物學特性及分化研究
李瑩 李小兵

摘要:目的? 研究從人脂肪組織中獲取人脂肪干細胞(hADSCs)的方法,并觀察其形態特點、生物學特性、多譜系細胞分化的特點及間充質來源細胞表面相關標志的表達,探討脂肪干細胞作為組織工程種子細胞的臨床應用前景。方法? 應用Ⅰ型膠原酶消化分離人脂肪組織,分時間段收集細胞并進行體外培養;采用流式細胞儀檢測CD29、CD34、CD44、CD45、CD105等間充質來源細胞表面相關標志抗原的表達;利用成脂、成骨及成軟骨誘導培養基對hADSCs進行定向分化誘導,觀察細胞隨誘導時間延長形態的變化,分別于誘導第11、14、21天進行油紅O染色、茜素紅染色及阿爾新藍染色;采用Cell Counting Kit-8(CCK-8)細胞增殖檢測試劑盒檢測hADSCs的增殖功能。結果? ①原代培養的hADSCs接種48 h后大部分細胞貼壁,為多角形的單層細胞;第3代細胞分裂增殖旺盛,細胞細長且排列規律;第8~9代后細胞形態不規則,胞內顆粒明顯增多。②第3代hADSCs的表面抗原標記結果:CD29、CD44、CD105陽性表達,陽性率分別為98.89%、93.73%、86.99%;CD34、CD45陰性表達,陽性率分別為0.16%、0.11%。③hADSCs成脂誘導第11天、成骨誘導第14天、成軟骨誘導第21天時細胞分化達到高峰,油紅O染色、茜素紅染色、阿爾新藍染色均為陽性;④第4、5、6代(P4、P5、P6)hADSCs隨培養時間的延長,均呈增長趨勢,細胞平均從第24 h開始進入指數增長期,三代之間細胞增殖功能比較: P4>P5,P6>P5,差異有統計學意義(P<0.05)。結論? 本次成功從人脂肪組織中分離、培養出目的細胞,經初步鑒定,證實其為hADSCs,同時成功對hADSCs進行了成脂、成骨及成軟骨定向誘導分化。hADSCs的增殖能力可能會隨傳代次數的增加而有所下降;無血清刺激也可能會影響hADSCs的增殖功能,使其增殖能力有所下降。
關鍵詞:脂肪干細胞;定向誘導分化;細胞增殖
中圖分類號:R329? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? DOI:10.3969/j.issn.1006-1959.2020.01.027
文章編號:1006-1959(2020)01-0089-05
Study on Biological Characteristics and Differentiation of Human Fat Stem Cells
LI Ying,LI Xiao-bing
(Plastic and Burn Surgery,Tianjin First Central Hospital,Tianjin 300000,China)
Abstract:Objective? To study the method of obtaining human adipose stem cells (hADSCs) from human adipose tissue, and to observe its morphological characteristics, biological characteristics, characteristics of multi-lineage cell differentiation, and expression of relevant markers on the surface of mesenchymal-derived cells, and to explore adipose stem cells. Prospects for clinical application of tissue engineering seed cells. Methods? Human adipose tissue was isolated and digested with type I collagenase, and cells were collected in time and cultured in vitro. Flow cytometry was used to detect the expression of surface-associated marker antigens on cells such as CD29, CD34, CD44, CD45, and CD105; Adipogenic, osteogenic, and chondrogenic induction media induce directional differentiation of hADSCs. Observe the morphological changes of cells with prolonged induction time. Oil red 0 staining, alizarin red staining, and Al New blue staining; Cell Counting Kit-8 (CCK-8) cell proliferation detection kit was used to detect the proliferation function of hADSCs.Results? ① 48 h after inoculation of primary cultured hADSCs, most of the cells were adherent, and they were polygonal monolayer cells; the third-generation cells had vigorous division and proliferation, and the cells were slender and arranged regularly. After the 8th to 9th generations, the cell morphology was irregular and the intracellular particles increased significantly. ② Surface antigen labeling results of the third generation hADSCs: CD29, CD44, and CD105 were positively expressed, with positive rates of 98.89%, 93.73%, and 86.99%, respectively; CD34 and CD45 were negatively expressed, with positive rates of 0.16% and 0.11%, respectively. ③ hADSCs reached the peak of cell differentiation on the 11th day of adipogenic induction, the 14th day of osteogenesis induction, and the 21st day of chondrogenic induction, and oil red O staining, alizarin red staining, and alcin blue staining were all positive; ④The 4th, 5th, and 6 th generation (P4, P5, P6) hADSCs showed an increasing trend with the increase of culture time. The cells entered an exponential growth period from the 24 h on average. Comparison of cell proliferation functions between the three generations: P4> P5, P6> P5, the difference was statistically significant (P<0.05). Conclusion? The target cells were successfully isolated and cultured from human adipose tissue this time. After preliminary identification, they were confirmed to be hADSCs. At the same time, hADSCs were successfully induced into adipogenic, osteogenic and chondrogenic differentiation. The proliferative capacity of hADSCs may decrease with the increase of the number of passages; serum-free stimulation may affect the proliferative function of hADSCs and reduce their proliferative capacity.
Key words:Adipose stem cells;Directional induced differentiation;Cell proliferation
脂肪間充質干細胞(ADSCs)是一種來源于中胚層的細胞。目前研究表明,ADSCs具有和骨髓來源的間充質干細胞相似的生物學性狀和免疫表型,并且已經證實其在體外具有向脂肪細胞、成骨細胞、軟骨細胞、神經細胞、心肌細胞等分化的能力,且其誘導分化的體系和骨髓來源的間充質干細胞相似[1]。脂肪組織來源的間充質干細胞除了具有間充質干細胞的共性外,還具有以下特點[2]:脂肪組織來源廣泛、取材容易,如患者進行局部麻醉后吸脂術即可獲得。不同組織來源的間充質干細胞免疫活性不同可能與間充質干細胞處于不同組織中的活化狀態、種屬差異、組織來源和培養條件的不同有關[3]。脂肪來源的間充質干細胞不易受到腫瘤細胞的污染,更容易進行體外凈化,具有免疫抑制作用。因此,從脂肪組織中獲得種子細胞,成為組織工程種子細胞的理想來源。人類脂肪組織可通過切取或吸脂術獲得,由于吸脂術的微創性及美體作用,該方法可成為醫生及患者更容易接受的細胞獲取方式。本研究擬從人脂肪組織中獲取人脂肪干細胞(hADSCs),觀察其形態特點、生物學特性,并對其進行誘導分化,探討其應用前景。
1材料與方法
1.1材料來源? 成人脂肪組織來源于整形外科健康縮乳手術患者,均為女性,年齡19~40歲,無糖尿病、肝炎、代謝性疾病及其他系統性疾病,在知情同意的情況下,取術中廢棄脂肪組織。
1.2方法
1.2.1人脂肪干細胞的分離、體外培養? 將無菌條件下獲取的脂肪組織用PBS清洗,切成0.5 mm×0.5 mm無殘余血液、皮膚和纖維組織的碎片,37℃下在1 mg/ml膠原酶Ⅰ(Gibco,USA)中消化1~2 h。于1000 r/min離心5 min,去除上清液。將細胞懸浮在含有10%FBS(Hyclone,USA)的DMEM(Gibco,USA)中,37℃、5%CO2溫箱中培養。48 h后觀察粘附細胞。培養基每3 d更換1次。當細胞達到80%匯合時進行傳代,第3代細胞用于隨后的實驗。
1.2.2人脂肪干細胞表面抗原鑒定? 第3代細胞用0.25%胰蛋白酶和0.02%EDTA(sigma,USA)消化,懸浮于含0.1%BSA(sigma,USA)的PBS中,細胞密度為3.0×106/ml。將100 μl細胞懸液添加到2 mlEP管中,再將標記抗體稀釋液(表1)加入到樣品管中。樣品在4℃下避光孵育30 min。孵育后,在每個樣品管中加入1.5~2 ml PBS和0.1%BSA。離心(244 g,? ? 4 min),將細胞懸浮于含0.1%BSA的PBS 400 μl溶液中進行后續檢測。
1.2.3人脂肪干細胞定向誘導分化? ①成脂分化誘導:37℃的6孔培養板中加入第3代細胞,5%CO2培養基培養,直到細胞達到100%融合。將原培養基替換為2 ml完全成脂培養基A(cyagen,USA)培養3 d,然后將其替換為完全成脂培養基B(cyagen,USA)培養24 h。介質A和B交換重復3個周期。用10%中性福爾馬林固定30 min,1 ml油紅O工作液(Sigma,USA)染色10 min,顯微鏡下觀察細胞。②成骨分化誘導:第3代細胞在上述培養基中培養直到細胞融合80%~90%,替換為2 ml完全成骨分化培養基(Cyagen,USA),每3 d更換1次培養基。3周后用10%中性福爾馬林固定30 min,1 ml茜素紅(sigma,USA)染色5 min,顯微鏡下觀察細胞。③成軟骨分化誘導:第3代細胞接種于離心管中,培養基為完全軟骨分化培養基(cyagen,USA),平均每管細胞數為2×105/ml。每2~3 d更換1次培養基。在誘導培養基中培養3~4周后,固定細胞進行石蠟切片,阿爾新藍50~60℃染色15 min,顯微鏡下觀察細胞。
1.2.4 CCK-8檢測細胞增殖? 分別取第4代(P4,無血清的DMEM培養基饑餓12 h)、第5代(P5,無血清的DMEM培養基饑餓12 h)、第6代(P6,未饑餓)脂肪干細胞,胰酶消化后計數,調整細胞密度為1×105/ml。96孔板中每孔2000個細胞,每組設8個平行復孔,共6個時間點。計算所需細胞總數和液體總量,鋪板。分別于12、24、36、48、60、72 h后取出96孔板加入CCK-8溶液,每孔10 μl,檢測各孔的吸光度值;在酶標儀上選擇450 nm波長,檢測各孔的吸光度值D450。以時間為橫坐標,以吸光度值為縱坐標繪制細胞生長曲線,將只含加培養基不加細胞作為空白對照孔調零。
1.3統計學分析? 采用SPSS 16.0軟件處理數據,計量資料以(x±s)表示,多組間比較采用單因素方差分析,各組數據經檢驗均為方差齊;當各組比較有統計學意義時,任意兩組比較用LSD-t法,以P<0.05表示差異有統計學意義。
2結果
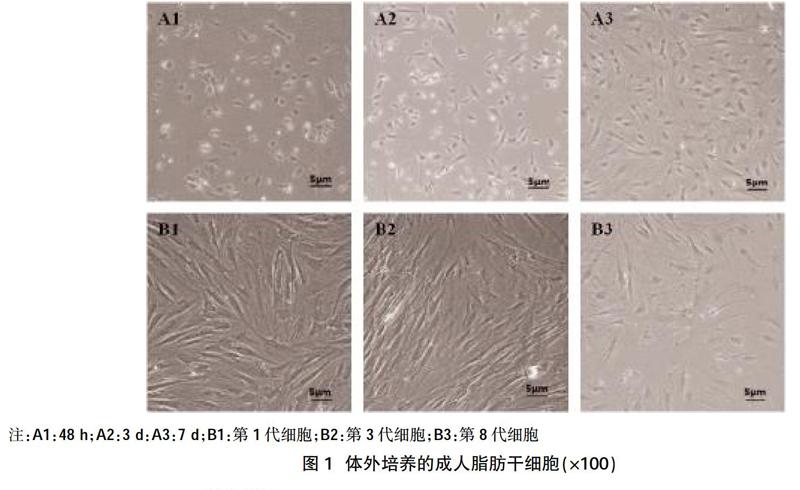
2.1人脂肪干細胞的形態觀察? 細胞接種48 h后可見大部分細胞開始貼壁,為多角形的單層細胞。有的細胞體細長,似成纖維細胞(圖1-A1)。72 h后大多數細胞貼壁,并開始伸展、分裂,呈梭形(圖1-A2)。5~7 d后細胞逐漸分裂、融合成單層并鋪滿瓶底? ? ?(圖1-A3)。傳代后細胞呈梭形,核居中,多數為1個核仁,也可雙核仁,呈圓形或卵圓形,細胞成簇分布,排列有一定的極性(圖1-B1)。細胞平均傳代擴增時間約為3 d,第3代細胞分裂增殖旺盛,細胞細長,排列緊湊且規律(圖1-B2)。第8~9代以后,細胞形態不規則,缺乏立體性,細胞邊緣融合不清,胞內顆粒明顯增多,培養液中可見較多的細胞碎片(圖1-B3)。
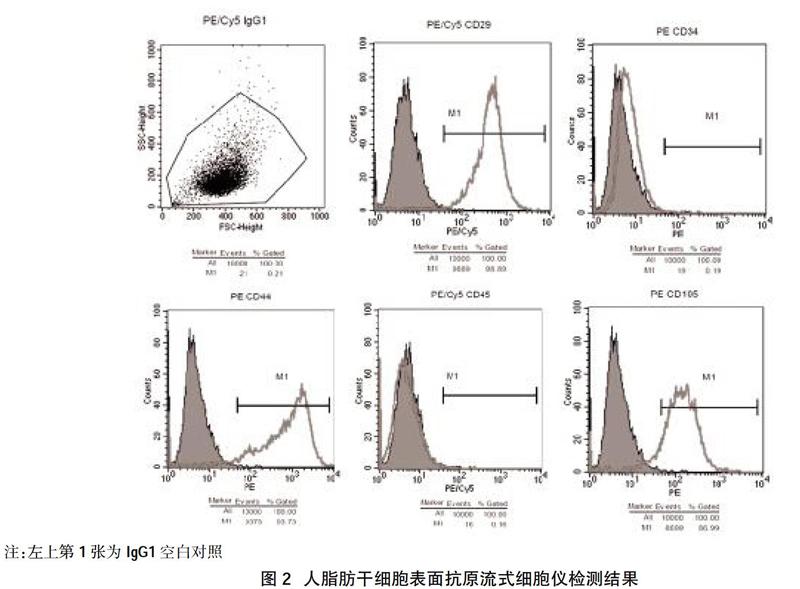
2.2人脂肪干細胞的表面抗原鑒定結果? 第3代人脂肪干細胞的表面抗原標記結果:CD29、CD44、CD105陽性表達,陽性率分別為98.89%、93.73%、86.99%;CD34、CD45陰性表達,陽性率分別為0.16%、0.11%,見圖2。
2.3人脂肪干細胞的定向誘導分化結果
2.3.1成脂誘導分化? 成脂誘導72 h后,鏡下觀察可見細胞立體感增強,細胞內有小脂滴出現(圖3-A1),約1周后脂滴數量增加并相互融合,細胞由長梭形變為圓形或多邊形(圖3-A2),誘導第11天時,細胞分化達到高峰,可見大量脂滴融合成團(圖3-A3),油紅O染色陽性,顯示有大量脂質沉淀(圖3-A4)。
2.3.2成骨誘導分化? 誘導第4天細胞呈多角形,胞質內細胞顆粒增多;第8天胞質內充滿顆粒,細胞呈集落樣生長,細胞間見鈣質沉積(圖3-B1,箭頭);第12天細胞結節中心的細胞逐漸融合失去細胞結構,鈣結節形成明顯(圖3-B2,箭頭);第14天誘導分化達到高峰,可見大量鈣沉積,并融合成片(圖3-B3,箭頭),茜素紅染色陽性,呈紅色結節(圖3-B4,箭頭)。
2.3.3成軟骨誘導分化? 誘導24 h后,細胞成小顆粒狀漂浮在誘導液中,單個細胞形態無明顯變化。隨誘導時間延長,在細胞密度較大處細胞群逐漸聚集;誘導第7天即可在聚集細胞的表面看到微黃色的物質積累,量逐漸增多;誘導第21天達到高峰,阿爾新藍染色陽性(圖3-C1、C2)。
2.4 hADSCs的增殖功能? 第4代細胞隨培養時間的延長,均呈現增長趨勢。從第24 h開始進入指數增長期,各時間點與前一時間點細胞平均吸光度值比較,差異有統計學意義(F=13.230,P<0.05);其中細胞平均吸光度值在36 h比24 h增加了28.00%,60 h比48 h增加了21.88%。第5代細胞從第48 h開始進入指數增長期,各時間點與前一時間點細胞平均吸光度值比較,差異有統計學意義(F=56.525,P<0.05),細胞平均吸光度值在60 h時比48 h增加了38.46%,72 h比60 h增加了72.22%。第6代細胞從第24 h開始進入指數增長期,各時間點與前一時間點細胞平均吸光度值比較,差異有統計學意義(F=23.890,P<0.05),其中細胞平均吸光度值36 h比24 h增加了71.43%。見圖4A。
不同代數之間細胞增殖功能比較,細胞平均吸光度值的趨勢為:P4>P5,P6>P5,三代之間兩兩比較,各時間點差異均有統計學意義(F=40.855、13.976、58.260、52.616、38.616、11.573,P均<0.05)。見圖4B。
3討論
軟骨、心肌、神經等組織由于缺乏再生能力,其損傷修復一直是醫學領域的難題。以干細胞為基礎的組織工程技術為解決這一難題提供了可能,其核心是建立由種子細胞和支架構成的三維空間復合體。其中,種子細胞的選擇非常重要,與胚胎干細胞相比,成體干細胞由于無倫理爭議,更適合作為組織工程的種子細胞。目前,在成體干細胞中,間充質干細胞(MSC)的研究開展較早,并已作為種子細胞進行了組織工程方面的相關研究。但取骨髓時患者比較痛苦,而且可獲得的MSC數量甚少,要以體外擴增來得到足夠的細胞數,所需周期長且造價昂貴。隨著MSC研究的不斷深入,人們對MSC的生物學特性、分化能力及臨床應用有了進一步認識[4]。研究發現,脂肪組織位于較易獲得的結締組織內,和骨髓一樣來源于間充質,其中存在的一類干細胞族的克隆細胞株稱為脂肪干細胞(ADSCs)。這些細胞可以從脂肪組織中大量分離,和MSCs一樣具有多向分化潛能,在一定條件下可以向脂肪、骨、軟骨、心肌細胞、神經細胞等分化。而相比MSCs,ADSCs具有的優點是:取標本時患者痛苦小;細胞含量豐富,每單位體積脂肪組織中含有多分化潛能細胞的數量約是骨髓組織的500倍以上;不需進行長期的體外擴增。因此,ADSCs體外擴增能力強,傳代培養易于獲得大量有分化能力的細胞[5],其可能更適合作為組織工程的種子細胞。
本實驗發現,100 ml脂肪組織可產生約2×107個細胞,在傳代培養中,平均倍增時間約為2~3 d,并能保持穩定的倍增率至第8代。這表明ADSCs的增殖能力很強,傳代培養時易于獲得大量有分化能力的細胞。ADSCs與成纖維細胞形態相似,且都無特異性的鑒別標志。有研究將脂肪組織和結締組織用膠原酶消化后,比較兩者獲得的細胞發現:脂肪來源的細胞內脂肪聚成大滴,成纖維細胞只有少量的脂滴,且30%~40%的原代ADSCs能自發生成脂肪細胞,提示原代分離的細胞來源于脂肪基質。隨著培養時間的延長和換液次數的增加,這些細胞基本可被清除,說明應用以上原代細胞培養法可從人脂肪組織中分離出hADSCs,并可進行體外培養擴增。
目前,ADSCs尚缺乏特異性的表面標記物,常用的鑒定方法有免疫組化染色和流式細胞儀檢測表面抗原等,但采用單一檢測方法來鑒定ADSCs是不全面的。因此,本實驗通過流式細胞儀進行細胞表面抗原標記物的檢測和成脂、成骨、成軟骨定向誘導等實驗對ADSCs進行初步鑒定。ADSCs表面標志蛋白主要有CD9、CD10、CD13、CD29、CD34、CD44、 CD105、CD106、CD146、CD166、HLA-ABC,誘導分化培養后ADSCs雖表現出成脂細胞、成骨細胞、成軟骨細胞等已分化細胞的特征,但表面蛋白的表達卻與未分化前基本一致。這些表面蛋白與MSCs的表面蛋白很相似,CD29、CD44、CD71、CD70、CD105等為陽性標記,CD31、CD34、CD45等為陰性標記。CD45在內皮細胞、成纖維細胞中有表達,而ADSCs不表達。本實驗第3代hADSCs的表面抗原標記結果為CD29、CD44、CD105陽性表達,陽性率分別為98.89%、93.73%、86.99%;CD34、CD45陰性表達,陽性率分別為0.16%、0.11%。
ADSCs與MSCs類似,在不同的培養條件下可分化為不同的中胚層來源的組織細胞。本實驗中分別加入成脂、成骨及成軟骨誘導培養基,誘導培養一定時間后進行特異染色,結果均為陽性,證實其具有多向分化潛能。本實驗將細胞置于離心管內進行立體培養,相比單層平面培養更利于其向軟骨定向分化。不同代數之間細胞增殖功能比較顯示:細胞平均吸光度值的趨勢為:P4>P5,P6>P5。分析原因:P4、P5和P6細胞培養的血清條件不同,P4、P5均在測增殖功能前用無血清的培養基饑餓12 h,而P6細胞無低血清饑餓刺激,說明同一血清條件下,隨著代數的增加hADSCs增殖能力有所下降;不同血清條件下,無血清刺激可以影響hADSCs的增殖功能,其增殖能力有所下降。
研究干細胞增殖和分化機制的最終目的是應用干細胞治療疾病,干細胞具有的多向分化潛能和自我更新能力使其成為未來再生醫學的重要種子細胞,并成為研究人類早期胚層特化和器官形成、藥物篩選以及基因治療的最佳工具。利用胚胎干細胞治療疾病有著廣泛的應用前景,但它的應用還受到社會倫理方面的制約。而成體干細胞橫向分化的發現對于細胞研究和應用具有重要意義,從患者體中分離出成體干細胞,在體外定向誘導分化為特定組織細胞,將這些細胞自體移植回輸該患者體內,從而達到長期治療的目的。干細胞的醫學應用還包括體外克隆人體器官,然而這比體內移植干細胞要復雜的多。相信隨著研究的不斷深入,來自人體干細胞的器官應用于臨床治療已為期不遠。干細胞研究與應用不僅在疾病治療方面有著極其誘人的前景,還將對克隆動物、轉基因動物生產、發育生物學、新藥物的開發與藥效和毒性評估等領域產生極其重要的影響。
綜上所述,本研究成功分離培養出hADSCs,對hADSCs進行了成脂、成骨、成軟骨的定向誘導分化;并研究了細胞的增殖功能,初步探討了脂肪來源干細胞作為構建組織工程種子細胞的可行性,同時對干細胞作為組織工程種子細胞臨床應用前景進行了展望。
參考文獻:
[1]Chun SY,Lim J,Lee EH,et al.Preparation and Characterization of Human Adipose Tissue-Derived Extracellular Matrix,Growth Factors,and Stem Cells:A Concise Review[J].Tissue Eng Regen Med,2019,16(4):385-393.
[2]農霖.脂肪干細胞的生物學特性、分化潛能及應用[J].中國醫療美容,2015(4):99-101.
[3]方洪松,周建林,彭昊,等.不同來源間充質干細胞生物學特性差異[J].中國組織工程研究,2015,19(32):5243-5248.
[4]弓勛,云升.間充質干細胞的生物學特性及應用[J].中國醫學工程,2018,26(12):44-48.
[5]胡曉根,張文健,王在,等.體外培養人脂肪干細胞生物學特性的初步探究[J].中日友好醫院學報,2015,29(5):287-289,封2.
收稿日期:2019-10-15;修回日期:2019-11-05
編輯/成森

