抗栓藥物對內鏡黏膜下剝離術術后出血的影響
陳佳園 陳怡 陳成帷 張益光


[摘要] 目的 探討抗栓藥物對內鏡黏膜下剝離術(ESD)術后出血的影響。 方法 選取2016年1月至2020年12月期間接受ESD治療的患者納入本研究,分析抗栓藥物對ESD術后出血的影響。 結果 肝素替代治療(HR)、多重抗栓藥物、切除標本直徑超過38 mm、病灶位于胃上1/3均為術后出血的危險因素,連續使用阿司匹林不是術后出血的危險因素。在單抗血栓藥物組,持續組與停藥組的出血率比較,差異無統計學意義(4.5% vs. 4.4%,P=1.000);在多種抗血栓藥物組,持續組出血率高于停藥組(66.7% vs. 14.8%,P=0.020)。 結論 ESD術后出血風險與抗栓藥物種類、組合、使用方法相關。在抗血栓藥物ASA停用或連續使用的情況下,可行胃ESD術。使用多種抗栓藥物或HR會增加ESD術后出血的風險。
[關鍵詞] 抗栓藥物;內鏡黏膜下剝離術;術后出血;危險因素;藥物管理
[中圖分類號] R735.2? ? ? ? ? [文獻標識碼] B? ? ? ? ? [文章編號] 1673-9701(2021)34-0105-04
[Abstract] Objective To investigate the effect of antithrombotic drugs on postoperative bleeding after endoscopic submucosal dissection (ESD). Methods Patients who received ESD from January 2016 to December 2020 were included in this study. The effect of antithrombotic drugs on bleeding after ESD was analyzed. Results Heparin replacement therapy (HR),multiple antithrombotic drugs, the diameter of excised specimen exceeding 38 mm,and the focus located in the upper third of the stomach were all risk factors for postoperative bleeding. Continuous administration of aspirin was not a risk factor for postoperative bleeding.In the monotherapy antithrombotic drug group, there was no significant difference in bleeding rate between the continuous group and the drug withdrawal group (4.5% vs. 4.4%,P=1.000). In the multi-antithrombotic drug group,the bleeding rate in the continuous group was higher than that in the drug withdrawal group (66.7% vs. 14.8%,P=0.020). Conclusion The risk of bleeding after ESD is related to the type,combination and use of antithrombotic drugs. Gastric ESD is feasible when ASA, an antithrombotic drug, is discontinued or used continuously. The use of multiple antithrombotic drugs or HR will increase the risk of bleeding after ESD.
[Key words] Antithrombotic drugs; Endoscopic submucosal dissection; Postoperative bleeding; Risk factor; Drug management
內鏡黏膜下剝離術(ESD)廣泛應用于早期胃癌的治療[1]。薈萃分析顯示,術后出血是ESD最常見的并發癥,發生率約4.5%,應用抗栓藥的患者風險更高[2]。血栓栓塞高危患者停用抗栓藥物可能引起嚴重的血栓事件,因此內鏡圍術期抗栓藥物管理需引起高度關注。日本學者建議針對血栓栓塞高危患者,在持續使用阿司匹林(Acetylsalicylic acid,ASA)單藥的情況下進行ESD[3]。美國、英國和歐洲指南也建議血栓栓塞高危患者在繼續服用ASA情況下進行ESD[4-5]。少數研究指出單一持續使用抗血小板藥物不會增加胃ESD術后出血的風險[6-7]。然而這些研究結果仍存在爭議,本研究旨在根據對抗栓藥物的管理評估ESD術后出血風險,現報道如下。
1 資料與方法
1.1 一般資料
本研究納入2016年1月至2020年12月期間在本院接受ESD治療的患者872例(1020個病灶),男652例,女220例,平均年齡(71.7±13.8)歲。納入標準:接受ESD治療的患者,臨床及隨訪數據完整。排除標準:①有上消化道手術史者;②病理診斷為胃腺瘤或惡性腫瘤者;③臨床資料不完善者。
記錄:①患者因素:年齡、性別、基礎疾病、幽門螺旋桿菌感染、抗栓藥物管理;②病灶因素:病灶部位及大小、生長方式、病理類型;③操作因素:操作者熟練程度[8]、操作時間、整塊切除率、穿孔。
抗栓藥物管理遵照日本胃腸內鏡學會2014年發布的《胃腸道內鏡檢查的抗血栓形成治療》[3],分組如下:①對照組:不使用抗栓藥物(814個病灶,690例患者);②停藥組:在ESD術前停用所有抗栓藥物而不接受HR(140個病灶,128例患者);③持續組:抗栓藥物使用者繼續使用ASA單藥治療(28個病灶,23例患者),包括接受多重抗血小板治療的患者,在沒有使用HR的情況下改用ASA單藥治療;④HR組:停止所有抗栓藥物但接受HR(38個病灶,31例患者)。
1.2 ESD操作
首先確定病灶邊界,使用APC、Hook刀或IT刀標記后行黏膜下注射。病灶隆起后預切開,然后開始黏膜下剝離。在黏膜下剝離的過程中,需要反復進行黏膜下注射,且需要保持剝離的層面位于黏膜下層以內。發生出血使用熱凝等方法進行止血。最后,處理創面,需要時鈦夾縫合。
1.3 方法
術后出血的診斷標準[9],符合以下觀察指標中任意兩項:①出現嘔血、黑便等不適;②術后血紅蛋白下降>10 g/L;③術后血壓下降>20 mmHg或心率增加>20次/min;④內鏡檢查見手術創面活動性出血、血凝塊或創面潰瘍底部見裸露血管。
當發生術后出血,立即啟動急診內鏡電凝、鈦夾夾閉等措施,若無效則轉外科行手術治療。本研究中ESD術后出血的病例均經內鏡止血,無需手術治療。需要輸血的患者13例(1.5%)。所有患者在圍術期均未發生血栓栓塞,臨床轉歸良好。
1.4 統計學方法
采用SPSS 26.0統計學方法進行數據分析。計量資料采用(x±s)表示,使用成組t檢驗;計數資料用χ2檢驗進行比較。多因素Logistic回歸模型包括單因素分析中P<0.05的變量和既往研究中報道的與術后出血有關的一些重要指標[10-12]。采用Logistic回歸計算OR值和95%置信區間(95%CI),確定術后出血的相關因素。P<0.05為差異有統計學意義。
2 結果
2.1 術后出血危險因素的單因素分析
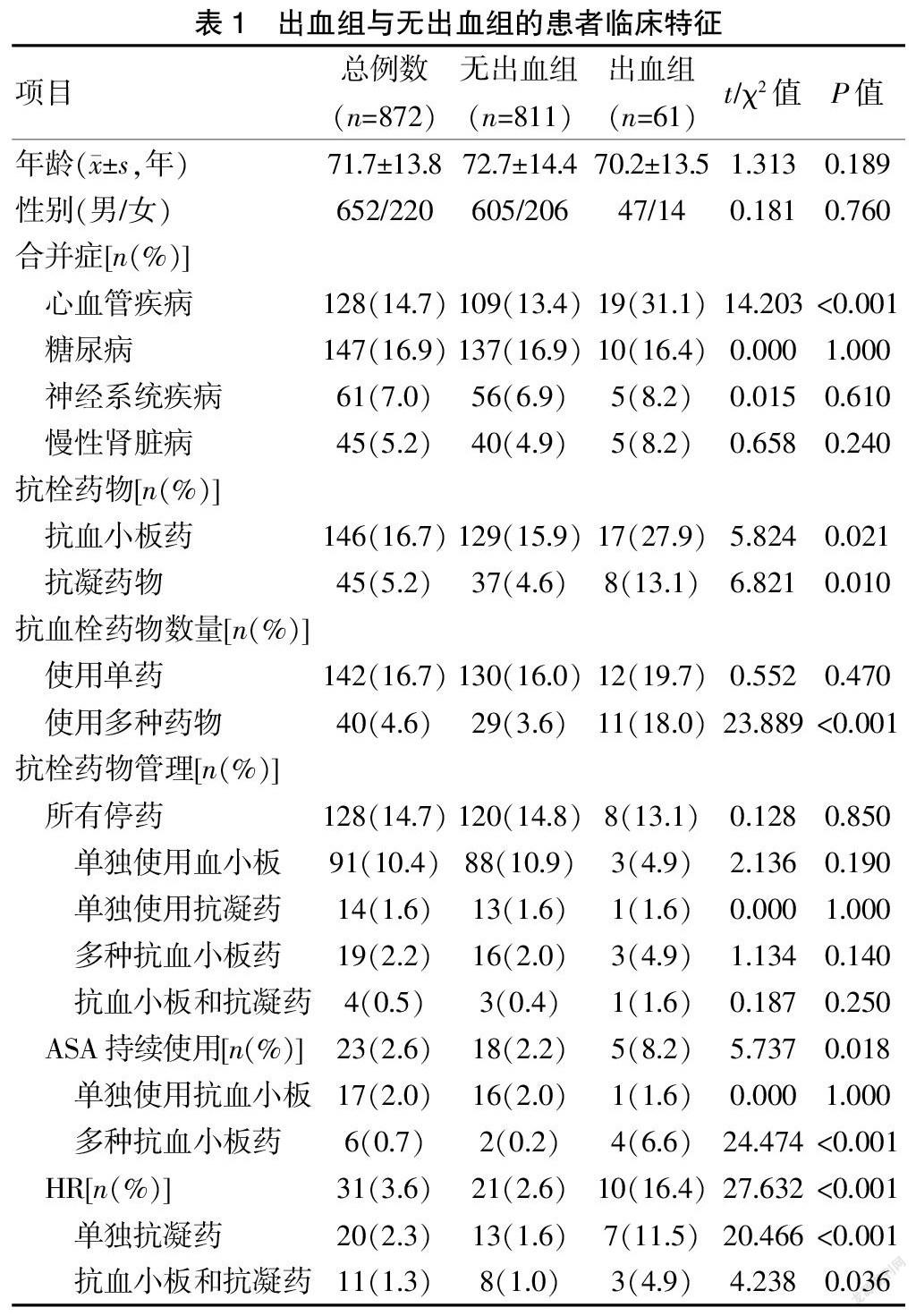
表1顯示,ESD術后出血與心血管疾病、抗栓藥物使用、持續使用ASA、使用多種抗栓藥物、使用HR相關。表2顯示,ESD術后出血與病灶位于胃上1/3、病灶直徑≥38 mm相關。
2.2 術后出血危險因素的多因素分析
表3顯示,應用HR、使用多種抗栓藥物、切除標本直徑≥38 mm、腫瘤位于胃上1/3與術后出血風險顯著相關。ASA的持續使用不是術后出血的危險因素。
2.3 各組間術后出血率的比較
圖1顯示四組ESD術后出血率的差異。停藥組和持續組出血率無明顯差異(P=0.360)。HR組出血率明顯高于停藥組(P=0.002),但與持續組比較,差異無統計學意義(P=1.000)。
本研究還比較了在使用單種和多種抗栓藥物的情況下,停藥組和持續組的術后出血率差異(圖2)。在單種抗栓藥物使用人群中,停藥組和持續組的術后出血率無統計學差異(4.4% vs. 4.5%,P=1.000)。而多種抗栓藥物使用者中,持續組術后出血率明顯高于停藥組(66.7% vs. 14.8%,P=0.020)。
3 討論
本研究主要探討了抗栓藥物對ESD術后出血的影響。腫瘤位于胃上1/3、切除標本直徑≥38 mm、使用多種抗血栓藥物、HR是ESD術后出血的危險因素。ASA的持續使用不是術后出血的危險因素,停藥組和持續組術后出血率無統計學差異。多種抗血小板藥物使用者繼續使用ASA,與單獨使用抗血小板藥物相比,術后出血風險更大。
病灶位于胃上1/3易并發術后出血,考慮與胃底手術操作難度較大,黏膜下血管較豐富有關[13]。既往研究表明多發病灶及病灶大小≥20 mm在術中會造成較大創面,因此術后出血的發生率增加[14]。
一項薈萃分析[15]顯示,持續ASA治療下ESD出血風險未顯著增加,但中斷ASA后血栓栓塞事件明顯增加。因此對于高血栓栓塞風險患者,可選擇在胃ESD圍術期繼續使用ASA。
雙聯抗血小板治療(DAPT)是急性冠脈綜合征的標準治療[16]。Tounou等[17]的研究顯示繼續DAPT的患者ESD術后出血的風險較單獨使用ASA者增加。Cho等[18]發現與單獨使用ASA相比,術后重新使用氯吡格雷者ESD術后出血的發生率更高。本研究發現使用多種抗栓藥物者術前轉換為單一ASA療法,與單獨使用ASA者相比,術后出血風險增加。但鑒于此種情況例數較少,仍需大樣本前瞻性RCT證實胃ESD圍術期將多種抗栓藥物轉換為ASA單藥治療的益處風險比。
一項回顧性研究表明,接受HR的患者ESD后出血發生率為23%~38%,且更易發生遲發性出血[19],可能與橋接過程中兩種藥物的重疊作用有關,從而在后期引起更強的抗栓作用。Douketis等[20]的RCT研究評估了HR對因慢性房撲或房顫而服用華法林的患者術后血栓栓塞和出血事件的影響,結果顯示,圍術期是否使用HR對血栓發生率無影響,但大出血風險升高。上述這些研究表明HR治療增加了ESD后出血的風險,但預防血栓栓塞效果尚不明確,對血栓栓塞高危患者,ESD圍術期不停用華法林治療也是一種可行的選擇。
本研究存在如下局限性:①系單中心回顧性研究,可能存在其他的影響因素未納入研究;②涉及ASA持續使用及使用多種抗栓藥物的樣本量較小,結果可能存在偏倚。
綜上所述,ESD術后出血風險與抗栓藥物種類、組合、使用方法相關。在抗栓藥物ASA停用或連續使用的情況下,可進行胃ESD術。使用多種抗栓藥物或HR會增加ESD術后出血的風險。臨床醫生應關注相關風險因素,減少ESD術后出血的發生。
[參考文獻]
[1] Tan Y,Lu J,Lv L,et al. Current status of endoscopic submucosal tunnel dissection for treatment of superficial gastrointestinal neoplastic lesions[J]. Expert Rev Gastroenterol Hepatol,2020,14(6):453-462.
[2] Zhu H,Li F,Tao K,et al. Bleeding after endoscopic resection between direct oral anticoagulants or warfarin: Systematic review and meta-analysis[J]. J Gastroenterol Hepatol,2021,24.Online ahead of print.
[3] Fujimoto K,Fujishiro M,Kato M,et al. Guidelines for gastroenterological endoscopy in patients undergoing antithrombotic treatment[J]. Dig Endosc,2014,26(1):1-14.
[4] Acosta RD,Abraham NS,Chandrasekhara V,et al. The management of antithrombotic agents for patients undergoing GI endoscopy[J]. Gastrointest Endosc,2016,83(1):3-16.
[5] Veitch AM,Vanbiervliet G,Gershlick AH,et al. Endoscopy in patients on antiplatelet or anticoagulant therapy,including direct oral anticoagulants:British society of gastroenterology(BSG) and European society of gastrointestinal endoscopy(ESGE) guidelines[J]. Gut,2016,65(3):374-389.
[6] Sanomura Y,Oka S,Tanaka S,et al. Continued use of low-dose aspirin does not increase the risk of bleeding during or after endoscopic submucosal dissection for early gastric cancer[J]. Gastric Cancer,2014,17(3):489-496.
[7] Furuhata T,Kaise M,Hoteya S,et al. Postoperative bleeding after gastric endoscopic submucosal dissection in patients receiving antithrombotic therapy[J]. Gastric Cancer,2017,20(1):207-214.
[8] Yoshida M,Kakushima N,Mori K,et al. Learning curve and clinical outcome of gastric endoscopic submucosal dissection performed by trainee operators[J]. Surg Endosc,2017,31(9):3614-3622.
[9] Park SK,Goong HJ,Ko BM,et al.Second-look endoscopy findings after endoscopic submucosal dissection for colorectal epithelial neoplasms[J]. Korean J Intern Med,2021.Online ahead of print.
[10] Choi JJ,Cho SJ,Na SH,et al.Use of direct oral anticoagulants does not significantly increase delayed bleeding after endoscopic submucosal dissection for early gastric neoplasms[J]. Sci Rep,2021,11(1):9399.
[11] Mukai S,Cho S,Kotachi T,et al. Analysis of delayed bleeding after endoscopic submucosal dissection for gastric epithelial neoplasms[J]. Gastroenterol Res Pract,2012, 2012:875 323.
[12] Yoshioka T,Nishida T,Tsujii M,et al. Renal dysfunction is an independent risk factor for bleeding after gastric ESD[J]. Endosc Int Open,2015,3(1):E39-E45.
[13] 王偉,郝璐,施新崗,等.內鏡黏膜下剝離術在早期胃癌及癌前病變治療中的價值[J].第二軍醫大學學報,2017,38(7):923-927.
[14] 李焱冬,張延強,俞江平,等.早期胃癌內鏡黏膜下剝離術后追加手術的原因分析[J].中國微創外科雜志,2020, 20(4):300-303.
[15] Jaruvongvanich V,Sempokuya T,Wijarnpreecha K,et al.Continued versus interrupted aspirin use and bleeding risk after endoscopic submucosal dissection of gastric neoplasms:A meta-analysis[J].Ann Gastroenterol,2018, 31(3):344-349.

