從數據出發
薛琴 黃謙
摘要:培養學生分析、處理數據并從中獲取信息、加工信息的能力,無論是在高考中還是將來學生從事科學研究都非常重要,這是學科核心素養的重要組成部分。文章以基于數據分析的證據推理在化學教學中的應用為例,深化對概念的理解、細化對規律的探究、強化思維的深刻性、濃化學生的參與度,發展學生化學學科核心素養。
關鍵詞:數據分析;證據推理;核心素養;化學教學
文章編號:1008-0546(2022)01-0024-06中圖分類號:G632.41文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2022.01.006
“證據推理與模型認知”是普通高中化學課程的五大學科核心素養之一。“證據推理”是指“基于證據的推理”。它既是科學家從事科學研究的思維方式之一,也是學生化學學科核心素養的組成部分和具體表現。化學家可以根據實驗現象、實驗數據得到證據,通過相關的推理建立相應的認識模型并不斷修正。化學上的很多重要規律和認識,都是在大量的事實證據中發現的。
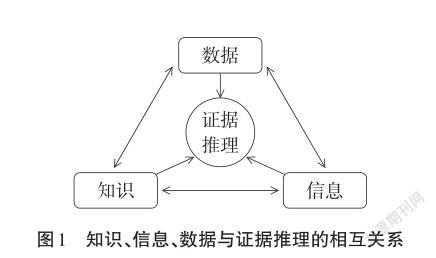
一、知識、信息、數據與證據推理
“證據”是學生通過科學探究開展學習活動的重要基礎和前提條件,在化學中的證據就是各種可見的化學現象、化學基礎知識和規律,以及抽象的各種數據等。本文主要闡述證據推理中的各種數據分析與應用。數據有間接數據和直接數據之分。間接數據是指文獻資料和調查數據,主要來自各版本的高中化學教科書、普通化學原理等大學化學教材、各類化學工作手冊、各類論文論著等,也可以是學習者在調查和訪談時獲得的相關數據與材料;直接數據是指學生在課堂中通過實驗、或者通過計算直接得到的數據。
在進行推理時所需要的“證據”就是“信息”,它可能是以數據的形式呈現。同時,證據也可能是某種確定的、或者抽象意義的知識,是在數據、信息理解基礎之上形成的,具有可利用的形式。一般來說,數據需要經過處理和整合,才能更為他人理解、傳播等,此時的數據已經具有信息的形態[1]。對信息進行加工的思維方式就是證據推理(見圖1)。
結合化學學科的特點,關鍵認知能力主要表現為證據推理能力、科學探究能力、應用化學知識解決實際問題的能力和批判創新的思維能力這四個方面。關鍵認知能力各要素之間相互促進、相互補益,其核心是證據推理能力[2]。化學教學中的“證據推理”指的是根據化學概念、理論知識,從已有經驗、問題情境中識別、轉換、形成證據,通過比較分析、抽象概括和歸納演繹等進行推理,從而獲得結論、解決問題的綜合能力表現,強調的是利用科學相關的證據,體現科學推理的思維要求[3]。
二、證據推理核心素養在普通高中化學課程標準(2017年版)中的課程理念和要求
根據化學學科核心素養對高中學生發展的具體要求,作為核心素養的“證據推理”其課程目標是:(1)能夠基于證據進行分析推理,證實或證偽假設;(2)能夠通過分析、推理等方法認識研究對象的本質特征、構成要素及其相互關系,確定形成科學結論所需要的證據和尋找證據的途徑(見表1)。
一方面,江蘇高考試題的發展越來越注重對知識運用能力的考查,試題背景信息出現了大量的圖像和表格,要求學生具有較強的對表格數據、圖像數據的信息獲取和分析能力;另一方面,在掌握基礎知識的同時滲透對證據推理數據分析能力的培養。數據分析推理的過程是科學方法的傳授,發展學生的化學學科思維、證據推理的方法比僅僅記住一些重點教學內容更加重要。數據分析的方法和證據推理能力的培養是重要的教學目標。
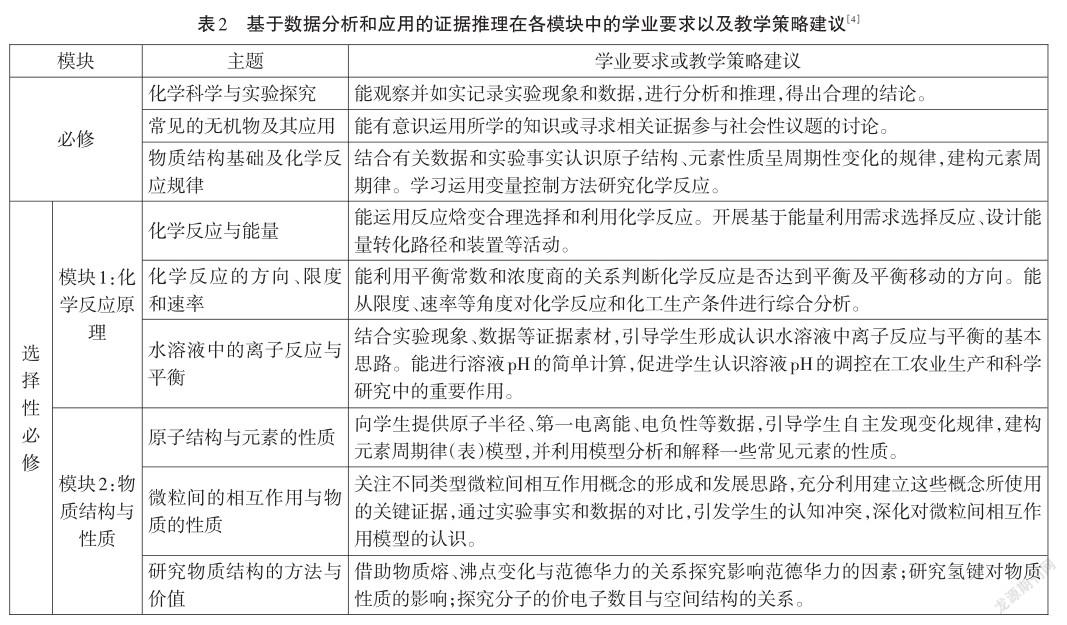
分析《普通高中化學課程標準(2017年版)》發現(見表2):基于數據分析和應用的證據推理在物質結構和化學反應原理的知識模塊中應用較多,在必修化學中涉及較少,有機化學基礎模塊中也較少涉及。

三、基于數據分析的證據推理在發展學生化學學科核心素養的應用
證據推理是多方面的,數據的分析應用是其中很重要的一環。數據分析的目的是將一大批看似雜亂無章的數據進行信息的集中、萃取和提煉,以找出研究對象的內在規律。在化學教學中的數據應用涉及到數據的觀察、數據的對比、數據的表述和數據的分析等。有的數據不是很直觀,我們可以借助坐標系統畫出曲線圖、柱狀圖、面積圖等;通過趨勢線對數據進行探究、尋找數據表象背后的理論支撐,解釋和預測數據,也可以通過一些數據的對比,確定實驗方案。
教學中應充分挖掘和利用各種相關的數據資源,讓學生體驗科學論證過程,提升他們的證據推理能力。一門學科對學生發展的價值,除了學科領域的知識以外,從更深的層次看,還應該給予學生認識世界和解決問題提供獨特的視角、思維的方法和特有的邏輯。這就是學科核心素養。
1.通過數據分析、證據推理,發展“科學態度與社會責任”的核心素養
2004年,某市物價局公布了該市天然氣銷售價格。其中居民生活用天然氣的價格變為原來管道煤氣價格的兩倍。十幾年前燃氣定價時,廣大市民不理解。使用天然氣后,燃氣價格真的變貴了嗎?
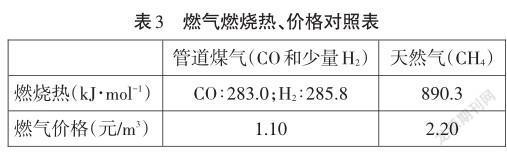
市民消費的是燃氣,但是根本消費的是燃氣產生的熱量。因此需要比較的是使用不同燃氣前后單位熱量的價格。從反應熱的視角來分析,天然氣的燃燒熱(890.3kJ?mol-1)是煤氣的燃燒熱(CO的燃燒熱為283.0 kJ?mol-1,H2的燃燒熱為285.8kJ·mol-1)的3倍多,而等體積燃氣的價格只多了1倍,所以使用天然氣反而更便宜了(見表3)。
另外,從2019年6月1日開始,民用氣價按全年用量分三個階梯收費(見表4):
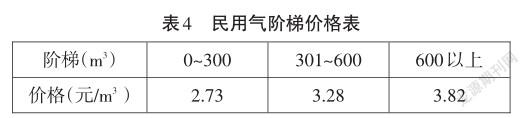
根據單位熱量價格的換算,從表4數據可以看出,即使在調整燃氣價格15年之后,301~600階梯段的價格才基本與2004年之前的煤氣價格持平。這還是在多年通貨膨脹之后做出的比較。可見,燃氣的價格確實越來越實惠了。
設計意圖:通過引入生活中的真實情境,引導學生在發現問題解決問題的過程中能夠自覺運用化學的思維方式進行有邏輯地思考,習慣于運用數據與事實進行有證據地表達與交流。能依據證據證明或證偽假設。不被大眾的輿論所裹挾,人云亦云,而應該有自己獨立的見解和思考。
2.通過數據分析、證據推理,發展“證據推理與模型認知”的核心素養
根據表5數據,以溫度為橫坐標,密度為縱坐標做出圖2。
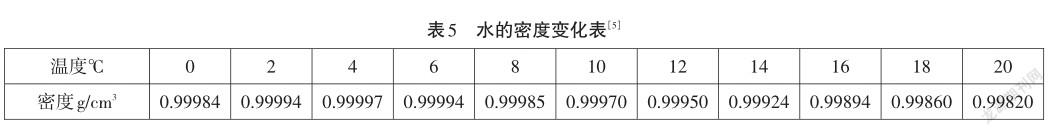

圖2可以很直觀地發現,從0℃到4℃,水的密度逐漸增大,4℃達到最大。4℃以后,水的密度隨溫度升高又逐漸減小。
溫度升高,液體的體積膨脹,會帶來其密度的減小,這是學生的物理學常識。然而從0℃到4℃,水的密度不降反升,這種反常現象究竟是如何發生的?0℃到4℃的水中一定有我們不知道的秘密。另一個生活常識是,水結冰之后體積會發生膨脹,在冰中間存在著大量的空腔。可以想象,空腔的產生意味著固態的水有著固定的晶體結構。此處應該有一種特殊的分子間作用力支撐起這種固定的晶體結構。
既然有這種作用力的存在,這種作用力會不會對水的熔沸點也產生一些特別的影響呢?此時教師給出了IVA、VA、VIA、VIIA元素形成的氫化物沸點變化趨勢圖(圖3)。

可以發現NH3、H2O和HF沸點突然升高,意味著一定有額外的分子間作用力存在。結合元素周期表中“構”“位”“性”三者關系,引導學生推導出原子半徑小,電負性大,吸引電子的能力很強,生成的HF、H2O、NH3的共價鍵的極性很強,共用電子對強烈偏移,使H原子幾乎成為“裸露”的質子,進而在靜電作用的本質上提出了氫鍵的概念。
能夠形成這種晶體結構的正是氫鍵。再次分析水的密度變化:當溫度逐漸升高時,冰逐漸融化,從0℃到4℃過程中破壞了冰的晶體中有規律的氫鍵,使得水分子中的空腔減少,水的密度增大;4℃以后,由于水仍然是液體,分子間距離很小,雖然氫鍵繼續存在,但是不斷被破壞,隨著分子熱運動加劇,此時以水的熱膨脹為主導,密度減小。
設計意圖:從宏觀和微觀結合上收集證據,依據證據從不同視角分析問題,推出合理的結論。在化學教學中,教師要能夠有意識地引導學生關注一些“反常”數據,關注實驗過程中所表現的形態變化,通過想象理解物質的微觀結構特征,建立“觀察—假設—實驗驗證—理論—修正—再驗證—再修正理論”這樣的研究方法,發展學生證據推理與模型認知核心素養。
3.通過數據分析、證據推理,發展“宏觀辨識與微觀探析”的核心素養
1903年,湯姆遜在發現電子的基礎上提出了原子結構的“葡萄干布丁”模型,開始涉及原子內部的結構。1911年,物理學家盧瑟福根據α粒子散射實驗提出了原子結構的核式模型。那么原子核外電子分層排布的證據是什么呢?
教師給出由Na原子到Ar原子的各電離能的數據(見表6)。

根據電離能的定義可知,電離能越小,表示在氣態時該元素的原子(或離子)越容易失去電子;反之,電離能越大,表示在氣態時該元素的原子(或離子)越難失去電子。通常運用電離能數值來判斷金屬元素的原子在氣態時失去電子的難易程度。
分析表6數據,發現從縱列看,同種元素的原子從I1到I6數據不斷增大,說明電子越來越難電離,原子核對電子的吸引力不斷增強。“反常”之處在于變化增大的過程中數據會突然增大很多。引導學生分析,每一種元素的原子都有一些電子處于最外層,這些電子相對容易失去,此時電離能較小。當失去最外層電子之后,進入內一層,原子核對電子的吸引力突然增強很多,導致電子更難失去,電離能增大。這是核外電子分層排布的一個重要證據。
設計意圖:“核外電子是分層排布的。”這一知識點同學們初中就已經知道。但是在教學設計中為什么要花費這么多時間給出這么多數據來重新學習呢?我們重新經歷的不是學習知識點的過程,而是正在經歷尋找證據的過程。“結構決定性質”。電子看不見也摸不著,但是通過對宏觀可測得的電離能數據的分析,我們可以窺見微觀世界的奧秘。在這里解決問題的方法比記住這些問題的答案更為重要。
4.通過數據分析、證據推理,發展“科學探究與創新意識”的核心素養
將合成氨工業過程與索爾維氨堿法制備純堿工業過程相聯系,此時的氨堿法制堿就被稱為聯合制堿法。這是侯氏制堿法的最大特點之一。但就析出NaHCO3反應過程而言,索爾維氨堿法與侯氏制堿法的原理是一致的。


設計意圖:溶解度的概念是一個經驗規律,物質的量濃度是更能準確評價物質溶解性的一種參數。此處將溶解度轉化為物質的量濃度的方法來進行思考,使學生的思維方式從經驗的直觀走向科學的理性。通過引用侯氏制堿法的真實案例,從數據分析和處理的角度出發,通過定性分析和定量計算推出合理的結論,進行科學探究,同時敢于質疑,勇于創新。
5.通過數據分析、證據推理,發展“變化觀念與平衡思想”的核心素養
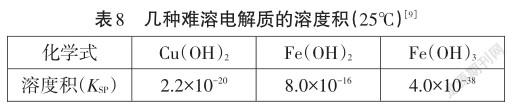
問題一:根據表8各難溶電解質的溶度積常數,分別計算初始濃度為1 mol/L、0.1 mol/L、0.01 mol/L、 0.001 mol/L Cu2+、Fe2+、Fe3+溶液中開始形成沉淀的pH值、沉淀完全(<10-5mol/L)的pH值。計算過程中允許學生使用計算器。這里鞏固的是溶度積常數的概念,強調的是計算的方法和思路,而不是運算能力。同時可以安排學生分組計算。計算結果如表9。
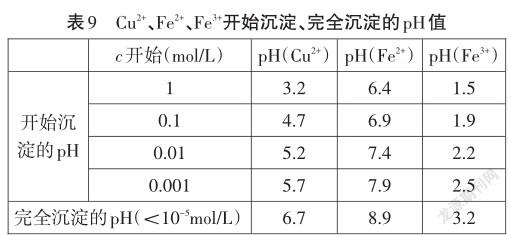
問題二:如何通過調節pH的方法,將混合溶液中的Cu2+、Fe2+、Fe3+分離出來?
根據表9的數據,以pH值從小到大為數軸,學生繪制Cu2+、Fe2+、Fe3+這三種離子開始形成沉淀的pH值到沉淀完全的pH值范圍。
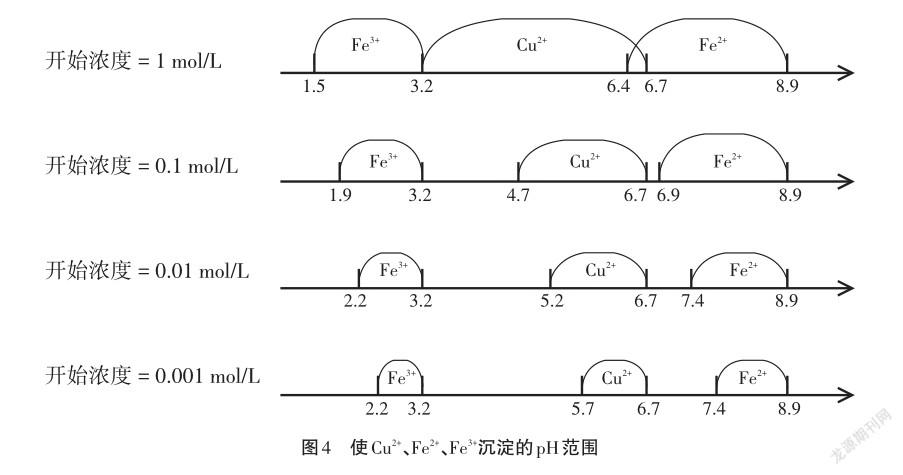
通過數軸范圍可以分析得到:當c始=1 mol/L時,Cu2+和Fe2+沉淀pH范圍有重疊,此外即使將Fe2+全部氧化為Fe3+之后,在pH=3.2時也很難控制Cu2+和Fe3+徹底分離。當起始濃度逐漸減小時,三種離子隨pH值的變化其分離度逐漸增大。但是當c始=0.001 mol/L時,溶液濃度過稀,實用價值不大。在c始=0.1 mol/L時,濃度不大不小,實用價值高。但是此時Cu2+完全沉淀的pH為6.7,與Fe2+開始沉淀的pH值6.9靠的太近,不易控制,此時可以將Fe2+氧化為Fe3+之后再行分離。
設計意圖:數據分析和處理是最常見、最有效的培養學生定量觀的手段。通過引導學生參與數據的計算,親手繪制曲線變化圖能充分調動學生學習的積極性,提高其課堂參與度,學生也能得到更加直觀和深刻的印象。通過對不同濃度、不同pH情境條件下沉淀溶解平衡的討論、數據分析和處理,發展學生變化觀念與平衡思想核心素養,促進學生認識溶液pH的調控在工農業生產和科學研究中的重要作用。
四、補充說明幾個問題
1.證據推理是學生經歷的“再發現”和“再創造”的過程
學生在學習過程中所學的知識,大都是前人已經發現和創造的知識和經驗。建構主義強調,教學應該把學習者原有的知識經驗作為新知識的生長點,引導學習者從原有的知識經驗出發,依靠他們的認知能力,形成對問題的解釋,提出他們的假設,主動建構新的知識經驗。這個“再發現”和“再創造”的過程不能簡單粗暴地從外部對學習者實施知識的“填灌”,而是他們通過自己的證據推理和探究習得的。
2.學生的證據意識和能力是需要教師著力培養的
證據意識是學生在學習過程中的一種重要的心理狀態。通過培養學生的證據意識,可以培養他們的批判精神,體現了學生對科學和事實的尊重。而這種意識和能力不是一朝一夕就能夠形成的,需要教師在課堂教學中好好設計著重培養。不可否認,一節課的時間是有限的,有些探究環節在課堂上逐一實施會遇到很大困難。因此,對于植根于證據推理的探究能力的培養需要化整為零,通過將其合理分割成若干個環節,可以將幾節課或一個單元為一個整體,將探究系統化。
3.在數據分析中合理引入數字化技術將極大地提高探究效率
首先,通過數據結合Excel等計算機軟件輸出可視化報表和圖像將更加直觀,可以帶來很大的視覺沖擊力,能夠非常容易看出數據的拐點、變化的趨勢,發現數據中所隱藏的問題;其次,借助于各類傳感器技術開展數字化實驗探究,可以更加快速地采集數據、更加直觀地得到各類變化曲線,可及時調整我們的思路,提高探究的效率。
當前,仍然有不少教師沉溺于結論性知識的傳授,或者一味地提高教學的難度和知識的深度,造成中學教學的大學化,這樣的教學充其量只是提前傳授一些高深的化學知識。知識本身的確很重要,但是教學過程中還有遠比一味地傳授知識多得多的東西值得我們去關注和發現。帶領學生認識世界,重構對中學化學教學的理解和實踐,努力改變純傳授知識的教學現狀,有效落實“素養為本”的教育理念,還有很多東西值得我們去研究。
參考文獻
[1]傅德榮.教育信息處理(第二版)[M].北京:北京師范大學出版社,2011:12-13.
[2]王秀閣.化學關鍵認知能力的發展路徑及培養策略[J].化學教育(中英文),2020,41(15):24-28.
[3]羅瑪.從科學推理到證據推理:內涵的探討[J].化學教學,2019(9):3-6.
[4]中華人民共和國教育部.普通高中化學課程標準(2017年版)[S].北京:人民教育出版社,2018.
[5][美]J. A.迪安.蘭氏化學手冊(第二版)[M].北京:科學出版社,2003.
[6]武漢大學,吉林大學.無機化學上冊(第三版)[M].北京:高等教育出版社,1994:111.
[7]人民教育出版社,課程教材研究所,化學課程教材研究開發中心.普通高中課程標準實驗教科書·化學與技術[M].北京:人民教育出版社,2007:16.
[8]江敏.學科思維與社會生活的融合——兼談“氨堿法制堿”的教學與思考[J].中學化學教學參考,2015(9):1-5.
[9]人民教育出版社,課程材教研究所,化學課程教材研究開發中心.普通高中教科書.化學:化學反應原理(選修4)[M].北京:人民教育出版社,2007:65.

