強直性脊柱炎患者外周血CD4+CD25+Foxp3+調節性T細胞的變化及臨床意義
陳溶微 謝文靜 江裕 馬國斌
【摘要】 目的 探討強直性脊柱炎(ankylosing spondylitis, AS)患者外周血CD4+CD25+Foxp3+調節性T細胞(Treg)的變化及臨床意義,為其臨床診治提供參考。
方法 選擇福州市第二醫院風濕免疫科及骨科在2018年10月至2021年3月收治的80例AS患者作為研究對象,根據Bath AS疾病活動指數評分(BASDAI)不同將患者分為非活動組(n=50,BASDAI<4)和活動組(n=30,BASDAI≥4)兩組,另取同期體檢的50名健康者作為對照組。比較各組受試者相關血清學指標變化,觀察各組外周血CD4+CD25+Foxp3+Treg、CD8+CD28+Tc、CD8+CD28-Treg及CD8+CD28+/CD8+CD28-值差異,采用Pearson法對CD4+CD25+Foxp3+Treg、CD8+CD28+ Tc、CD8+CD28-Treg及CD8+CD28+/CD8+CD28-與BASDAI、血沉(ESR)、超敏C反應蛋白(hs-CRP)的相關性進行分析。
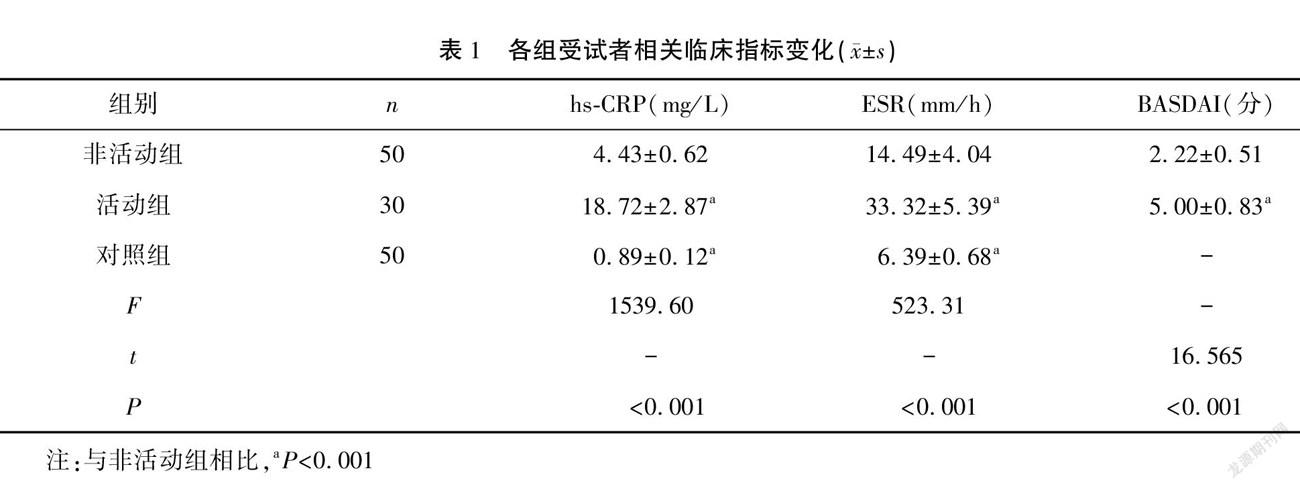
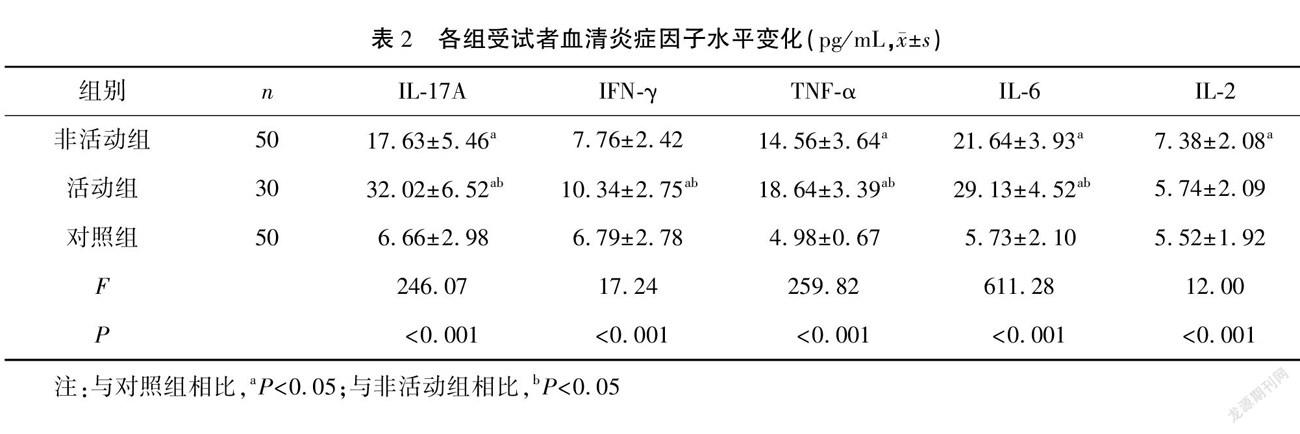
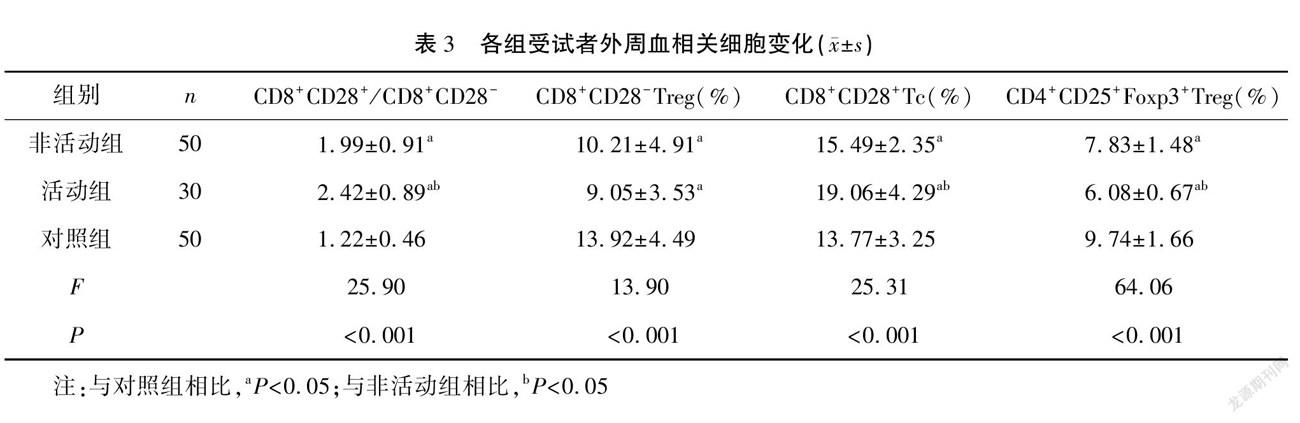
結果 活動組的BASDAI分級評分高于非活動組,活動組和非活動組的血清hs-CRP、ESR水平均明顯高于對照組,且活動組高于非活動組,差異有統計學意義(P<0.05)。活動組和非活動組的外周血CD8+CD28+/CD8+CD28-、CD8+CD28+Tc細胞值及血清IL-17A、IFN-γ、TNF-α、IL-6水平均明顯高于對照組,外周血CD8+CD28-Treg、CD4+CD25+Foxp3+Treg均明顯低于對照組,且活動組上述指標變化更為顯著(P<0.05)。經Pearson相關性分析顯示,CD4+CD25+Foxp3+Treg與BASDAI分級、ESR及hs-CRP均呈負相關(P<0.001),CD8+CD28+Tc及CD8+CD28+/CD8+CD28-值與BASDAI分級均呈正相關(P<0.05)。
結論 外周血CD4+CD25+Foxp3+調節性T細胞表達異常,在疾病發生發展過程中作用顯著,且與AS疾病BASDAI評分呈負相關,具有一定的臨床參考價值。
【關鍵詞】 強直性脊柱炎;活動度;CD4+CD25+Foxp3+;調節性T細胞
中圖分類號:R593.23?? 文獻標志碼:A?? DOI:10.3969/j.issn.1003-1383.2022.04.007
Changes and clinical significance of CD4+CD25+Foxp3+ regulatory T cells in peripheral blood of patients with ankylosing spondylitis
CHEN Rongweia, XIE Wenjinga, JIANG Yua, MA Guobinb▲
(a. Department of Laboratory Medicine, b. Department of Cardiology, The Second Hospital of Fuzhou City, Fuzhou 350007, Fujian, China)
【Abstract】 Objective To investigate the changes and clinical significance of CD4+CD25+Foxp3+ regulatory T cells (Treg) in peripheral blood of patients with ankylosing spondylitis (AS), so as to provide references for clinical diagnosis and treatment.
Methods 80 AS patients admitted to the Department of Rheumatology and Immunology and Orthopedics of The Second Hospital of Fuzhou City from October 2018 to March 2021 were selected as research objects. According to the Bath AS disease activity index score (BASDAI), patients were divided into inactive group (n=50, BASDAI<4) and active group (n=30, BASDAI≥4). In addition, 50 healthy people who received physical examination during the same period were selected as control group. The changes of relevant serum indexes of subjects in each group were compared, and the differences of CD4+CD25+Foxp3+Treg, CD8+CD28+Tc, CD8+CD28-Treg and CD8+CD28+/CD8+CD28- values in peripheral blood of each group were observed. In addition, Pearson method was used to analyze the correlation between CD4+CD25+Foxp3+Treg, CD8+CD28+Tc, CD8+CD28-Treg, CD8+CD28+/CD8+CD28- and BASDAI, erythrocyte sedimentation rate(ESR), and hypersensitive C-reactive protein(hs-CRP).
Results The BASDAI grading score of the active group was significantly higher than that of the inactive group, the levels of serum hs-CRP and ESR in the active group and the inactive group were significantly higher than those in the control group, and those of the active group were higher than those in the inactive group, and difference was statistically significant (P<0.05). The CD8+CD28+/CD8+CD28- and CD8+CD28+Tc cell values in peripheral blood and serum IL-17A, IFN-γ, TNF-α, IL-6 levels of the active group and the inactive group were significantly higher than those of the control group, while the? CD8+CD28-Treg and CD4+CD25+Foxp3+Treg in peripheral blood were significantly lower than those in the control group, and the changes in the above indicators in the active group were more significant(P<0.05). Pearson correlation analysis showed that CD4+CD25+Foxp3+Treg was negatively correlated with BASDAI grading, ESR and hs-CRP(P<0.001), CD8+CD28+Tc and CD8+CD28+/CD8+CD28-values were positively correlated with BASDAI grading(P<0.05).
Conclusion The abnormal expression of CD4+CD25+Foxp3+ regulatory T cells in peripheral blood plays a significant role in the development of the disease, and it is negatively correlated with the BASDAI score of AS disease, which has certain clinical reference value.
【Key words】 AS; mobility; CD4+CD25+Foxp3+; regulatory T cells
強直性脊柱炎(ankylosing spondylitis, AS)是一種慢性炎癥性自身免疫性疾病,臨床主要特征為關節強直,椎間盤纖維環及其附近的結締組織骨化、纖維化,脊柱和骶髂關節附著點炎癥[1]。在我國AS的患病率為0.3%左右,且病程相對較長,多以男性為主,具有較高的致殘率[2]。目前關于AS的發病機制及病因尚未有權威性說明,相關研究顯示,AS的發生發展與淋巴細胞亞群功能異常、比例失衡、細胞免疫調節功能紊亂以及T細胞異常激活關系較為密切[3]。而調節性T細胞(Treg)是一類CD4+T細胞亞群,具有一定的免疫負調節功能,可通過抑制細胞間接觸或分泌抑制性細胞因子等途徑,對炎癥細胞因子分泌、活化以及效應T細胞增殖進行抑制,從而達到對自身免疫耐受進行維持,發揮抗炎的效果[4]。CD4+CD25+調節性T細胞是一種在胸腺合成、分化及成熟的具有免疫功能的細胞亞群[5]。多項研究結果顯示,多種自身免疫性疾病存在Treg功能和數量上的平衡失調[6~7]。但不同表型的Treg細胞在AS體內的表達異常情況,以及與病情活動度的關系尚未解釋清楚。故本文探討AS患者外周血CD4+CD25+Foxp3+Treg的變化及臨床意義,為其臨床診治提供參考。
1 資料與方法
1.1 一般資料
選擇我院風濕免疫科及骨科在2018年10月至2021年3月收治的80例AS患者作為研究對象,根據Bath AS疾病活動指數評分(BASDAI)不同將患者分為非活動組(n=50,BASDAI<4)和活動組(n=30,BASDAI≥4)兩組。其中非活動組患者男43例,女7例,年齡18~50歲,平均(30.76±4.09)歲,病程0.2~30年,平均(6.57±4.18)年;活動組患者男27例,女3例,年齡16~50歲,平均(30.40±5.09)歲,病程0.3~30年,平均(6.76±5.10)年。另取同期在我院體檢的50名健康者作為對照組,其中男41人,女9人,年齡19~48歲,平均(29.32±4.47)歲。各組受試者在年齡、性別等一般資料方面差異無統計學意義,具有可比性(P>0.05)。
1.2 納入和排除標準
納入標準:①符合1984年美國風濕病協會修訂的關于AS診斷標準[8];②疾病活動度符合2009年國際脊柱關節炎協會(ASAS)制定新AS病情活動度評分中的相關規定[9];③經本院倫理學委員會批準實施(180612);④所有受試者均簽署知情協議書。排除標準:①合并炎癥疾病、自身免疫性疾病及風濕病者;②合并嚴重的心肝腎功能障礙者;③妊娠哺乳期者;④近期經過糖皮質激素及其他免疫抑制劑治療者;⑤腫瘤、感染引發的關節疼痛者;⑥合并高熱、肺部或肝膽道感染、嚴重的上呼吸道感染及敗血癥者;⑦合并周圍血管栓塞性疾病或者周圍血管疾病者;⑧依從性差,中途退出者。
1.3 方法
1.3.1 儀器與試劑
流式細胞儀為BD公司生產的FACScaibur型號;低速離心機購于上海手術器械廠;微型旋渦混合器購于上海躍進醫療器械廠的WXH型號。FACSTM Lysing solution紅細胞裂解液、磷酸緩沖液(PBS)、HLA-B27試劑盒、PE-CY7-鼠抗人CD3抗體、APC-鼠抗人CD25、PE-鼠抗人CD28、PE-鼠抗人CD127、FITC-鼠抗人CD4、FITC-鼠抗人CD8及Foxp3試劑盒均購于美國BD公司。
1.3.2 外周血Treg水平檢測
取所有受試者清晨8~9點的2 mL空腹靜脈全血,抗凝采用EDTA-K2處理。取4支流式檢測管,將上述處理好的50 μL抗凝靜脈全血置于其中,并編號1、2、3、4,之后分別向檢測管1和3中加入APC-鼠抗人CD25、PE-鼠抗人CD127、FITC-鼠抗人CD4以及與此相對應的同型抗體,之后再在檢測管2和4中加入PE-CY7-鼠抗人CD3抗體、PE-鼠抗人CD28、FITC-鼠抗人CD8以及與此相對應的同型對照抗體,每種抗體的用量5 μL,渦旋對上述檢測管進行混勻處理,之后在室溫條件下,進行30 min的避光孵育,再將2 mL的10紅細胞裂解液加入其中,混勻后在避光室溫條件下進行10 min的孵育,直到紅細胞全部溶解以后,再將3 mL的PBS加入其中,3000 rpm條件下進行5 min的離心,棄去上清液,重復上述操作1次,再將PBS重懸細胞500 μL加入其中,之后通過流式細胞儀對其進行監測。通過側向散射角和前向散射角對門圈進行設置,將淋巴細胞取出,再分別利用CD8和側向散射角、CD4和側向散射角對門圈進行設置,將CD8+和CD4+淋巴細胞取出,對CD8+淋巴細胞上的CD28和CD4+淋巴細胞上的CD127、CD25表達情況進行測定,并計算CD8+CD28-Treg占總淋巴細胞比例、CD4+CD25+Foxp3+Treg占CD4+淋巴細胞比例。每次獲取設門內細胞10 000個以上,Flowjo和Diva軟件對上述數據進行分析整理,Foxp3的檢驗嚴格按照試劑盒操作說明書執行。
1.3.3 相關臨床指標測定
采集5 mL的外周靜脈血,將其置于干燥管中,之后3000 rpm條件下離心10 min,取上清液,-80℃條件下保存待用。血清超敏C反應蛋白(hs-CRP)采用散射免疫比濁法進行檢測,血清血沉(ESR)采用魏氏法進行測定。
1.3.4 血清炎癥因子水平
采用酶聯免疫吸附法對血清白細胞介素2(IL-2)、白細胞介素6(IL-6)、腫瘤壞死因子α(TNF-α)、γ干擾素(IFN-γ)、白細胞介素17A(IL-17A)進行測定,試劑盒購于上海鈺博生物科技有限公司,操作方法嚴格按照說明書執行。
1.4 統計學方法
應用SPSS 22.0進行數據分析,服從正態分布的計量資料描述為(±s),多組間比較采用方差分析,進一步兩兩比較采用q檢驗;計數資料比較行χ2檢驗;采用Pearson法對相關性進行分析。檢驗水準:α=0.05,雙側檢驗。
2 結? 果
2.1 各組受試者相關臨床指標變化
活動組的BASDAI分級評分高于非活動組,活動組和非活動組的血清hs-CRP、ESR水平均明顯高于對照組,且活動組高于非活動組,差異有統計學意義(P<0.001)。見表1。
2.2 各組受試者血清炎癥因子水平變化
活動組和非活動組的血清IL-17A、TNF-α及IL-6水平均明顯高于對照組,且活動組上述血清炎癥因子升高更為顯著(P<0.05);而活動組IFN-γ水平高于對照組,非活動組IL-2則高于對照組(P<0.05)。見表2。
2.3 各組受試者外周血CD4+CD25+Foxp3+Treg、CD8+CD28+Tc、CD8+CD28-Treg及CD8+CD28+/CD8+CD28-值變化
活動組和非活動組的外周血CD8+CD28+/CD8+CD28-、CD8+CD28+Tc細胞值均明顯高于對照組,CD8+CD28-Treg、CD4+CD25+Foxp3+Treg均明顯降低,且除CD8+CD28-Treg外,活動組上述T細胞變化更為顯著(P<0.05)。見表3。
2.4 CD4+CD25+Foxp3+Treg、CD8+CD28-Treg與BASDAI、ESR、hs-CRP相關性分析
經Pearson相關性分析顯示,CD4+CD25+Foxp3+Treg與BASDAI分級、ESR及hs-CRP均呈負相關(P<0.001)。見表4。
2.5 CD8+CD28+Tc及CD8+CD28+/CD8+CD28-值與BASDAI、ESR、hs-CRP相關性分析
經Pearson相關性分析顯示,CD8+CD28+Tc及CD8+CD28+/CD8+CD28-值與BASDAI分級均呈正相關(P<0.05)。見表5。
3 討? 論
AS是以骶髂關節、中軸脊柱受累為主的一種炎癥性和慢性自身免疫性疾病,伴有不同程度的外周關節癥狀,嚴重者可致使關節強直和脊柱畸形[10]。目前對于其發病機制和病因尚未有權威性說明,但機體免疫功能異常,尤其是T細胞免疫功能異常對AS的發病作用顯著[11]。Treg是一類T細胞亞群,可對體內自身免疫反應進行控制,按照來源的不同可將其分為誘導產生的適應性調節性T細胞和自然調節性T細胞,按照免疫表型的不同,可將其分為NKT、CD4+CD25+、CD4+CD25+Foxp3+、CD8+CD28-細胞[12]。其中CD4+CD25+Treg的功能和數量異常是人類出現炎性疾病或者自身免疫性疾病的重要因素。多項研究也表明多種疾病的發生發展與不同表型Treg的異常表達關系密切[13~14]。HAN等[15]研究顯示,與健康者相比,AS患者外周血CD8+CD28-Treg水平明顯升高,CD4+CD25+Treg水平明顯降低。也有研究顯示[16],與正常組相比,多發性硬化癥患者外周血CD4+CD25+Foxp3+細胞水平明顯降低。但目前臨床上對于不同表型Treg,尤其是CD4+CD25+Foxp3+細胞與AS患者之間關系的研究報道相對較少。
本研究結果顯示,與對照組相比,活動期的AS患者外周血CD4+CD25+Foxp3+Treg水平均明顯降低。且相關性分析顯示,外周血CD4+CD25+Foxp3+Treg水平與BASDAI、ESR、hs-CRP均呈負相關,與以往研究結果相符合[17]。表明CD4+CD25+Foxp3+Treg細胞水平可以較好地反映AS患者病情嚴重程度及病情活動度。另外,關于CD8+CD28-Treg相關結果表明,在AS患者中,CD8+CD28-Treg的占比相對較低,對CD8+CD28+Tc細胞的抑制作用也會相對降低,致使CD8+CD28+Tc細胞出現相應的增殖和活化,這兩種細胞之間的平衡被打破可能在AS的發生發展過程中起著關鍵性的作用。這可能是由于CD28分子可與CD86或者CD80相結合,形成活化T細胞所必須的一種信號因子,根據細胞膜對CD28分子的表達情況,可以將其分為CD8+CD28-Treg和CD8+CD28+Tc(殺傷性)細胞。其中CD8+CD28+Tc可特異性識別體內的抗原,執行相應的免疫功能,而CD8+CD28-Treg可通過下調和上調共刺激分子和APCs表面的抑制性受體的表達,從而達到降低T細胞活化,抑制免疫功能的效果[18]。在不同細胞因子的作用下,初始CD4+T細胞可以分化成Th17、Th2、Th1細胞,其中Th17細胞可分泌IL-17等細胞因子;Th2細胞分泌IL-6等因子,可對體液免疫反應產生介導作用,從而促進細胞活化;Th1細胞可分泌IFN-γ、TNF-α、IL-2等炎癥因子,對細胞炎癥反應及細胞免疫反應產生介導效果。文中關于血清炎癥因子水平的結果表明,Treg細胞數量的減少會相應降低其自身免疫抑制作用,增強Th細胞的功能性,致使自身免疫淋巴細胞過度增殖,從而產生大量的自身抗體和炎癥因子,機體免疫功能失調,進而致使自身免疫反應的發生。
綜上所述,外周血CD4+CD25+Foxp3+調節性T細胞表達異常,在疾病發生發展過程中作用顯著,且與AS的BASDAI評分呈負相關,具有一定的臨床參考價值。
參 考 文 獻
[1] CHAVARRA-MIRANDA A,HERNNDEZ LAIN A,TOLDOS GONZLEZ O,et al.Immune-mediated necrotising myopathy after treatment with adalimumab in a patient with HLA-B27 ankylosing spondylitis[J].Neurologia (Engl Ed),2021,36(8):631-632.
[2]? GAO S,LIANG W,XU T,et al.Associations of tumor necrosis factor alpha gene polymorphisms and ankylosing spondylitis susceptibility:a meta-analysis based on 35 case-control studies[J].Immunol Invest,2021:1-24.
[3]? KOO B S,LIM Y C,LEE M Y,et al.Dose reduction of tumor necrosis factor inhibitor and its effect on medical costs for patients with ankylosing spondylitis[J].Rheumatol Ther,2021,8(1):347-359.
[4]? YU H Y,WU H W,ZHENG F P,et al.Gene-regulatory network analysis of ankylosing spondylitis with a single-cell chromatin accessible assay[J].Sci Rep,2020,10(1):19411.
[5]? 李秀娟,黃勝起,王阿妮,等.CD154與CD4+CD25+Foxp3+調節性T細胞在強直性脊柱炎患者外周血中的表達及意義[J].中國基層醫藥,2014,21(13):1942-1944.
[6]? 劉磊,劉健,萬磊.強直性脊柱炎患者血小板參數和外周血B、T淋巴細胞衰減因子及調節性T細胞變化[J].中國臨床保健雜志,2016,19(1):8-11.
[7]? KOH J,HUR J Y,LEE K Y,et al.Regulatory (Foxp3+) T cells and TGF-β predict the response to anti-PD-1 immunotherapy in patients with non-small cell lung cancer[J].Sci Rep,2020,10(1):18994.
[8]? 李文清.強直性脊柱炎患者外周血miR-155表達及Th17/Treg平衡的關系[J].山西醫科大學學報,2019,50(2):235-240.
[9]? 王作龍,鐘乃風,馬莉.檢測不同活動期強直性脊柱炎患者外周血Th1、Th2和Treg細胞的意義[J].貴陽醫學院學報,2015,40(4):363-367.
[10]? ZHANG W,YU H Y,WANG H L,et al.An innovative adjustable prone positioning frame for treatment of severe kyphosis secondary to ankylosing spondylitis with two-level osteotomy[J].Eur Spine J,2021,30(11):3209-3215.
[11]? HUNTER T,SANDOVAL D,BOOTH N,et al.Comparing symptoms,treatment patterns,and quality of life of ankylosing spondylitis and non-radiographic axial spondyloarthritis patients in the USA:findings from a patient and rheumatologist survey[J].Clin Rheumatol,2021,40(8):3161-3167.
[12]? GUO H F,ZHENG M,ZHANG K,et al.Functional defects in CD4+CD25 high Foxp3+ regulatory cells in ankylosing spondylitis[J].Sci Rep,2016,6:37559.
[13] BAUTISTA-CARO M B,ARROYO-VILLA I,DE MIGU-EL E,et al.THU0371 Increased frequency of regulatory CD19+CD24high CD38high B cells in patients with ankylosing spondylitis (AS)[J].Ann Rheum Dis,2016,75(Suppl 2):1-321.
[14]? 楊曉.強直性脊柱炎患者外周血CD8+調節性T細胞水平變化及臨床意義[D].合肥:安徽醫科大學,2017.
[15]? HAN R F,YANG X,CHEN M Y,et al.Changes and clinical significance of CD8+CD122+ T cells in the peripheral blood of patients with ankylosing spondylitis[J].Clin Rheumatol,2018,37(3):639-646.
[16]? HOSSEINI A,BABALOO Z,GHARIBI T,et al.Epigenetic mechanisms shape the underlining expression regulatory mechanisms of the STAT3 in multiple sclerosis disease[J].BMC Res Notes,2020,13(1):568.
[17]? 于萍,宋海澄,王健,等.強直性脊柱炎患者外周血CD8+CD28-和CD8+CD28+的表達及意義[J].中國煤炭工業醫學雜志,2017,20(3):273-276.
[18]? TEDESCHI V,ALBA J,PALADINI F,et al.Unusual placement of an EBV epitope into the groove of the ankylosing spondylitis-associated HLA-B27 allele allows CD8+ T cell activation[J].Cells,2019,8(6):572.
(收稿日期:2022-02-11 修回日期:2022-03-29)
(編輯:潘明志)

