顯微手術夾閉與血管介入栓塞術對大腦中動脈瘤破裂延遲性腦缺血的療效比較
李 俊, 丁漣沭
(南京醫科大學附屬淮安第一醫院 神經外科, 江蘇 淮安, 223300)
腦動脈瘤是由先天畸形或后天病理因素造成的一種以血管壁局限性膨出、擴張為主要表現的血管性疾病,患者多伴有劇烈的頭痛癥狀。腦動脈瘤易突發破裂出血,導致患者病情危重,死亡率較高[1]。大腦中動脈為大腦主要供血動脈,位于此處的動脈瘤若發生破裂出血,患者預后往往較差,多數患者幸存后會遺留不同程度的神經功能殘疾[2]。目前,臨床對于腦動脈瘤仍采取手術治療手段,例如顯微手術夾閉、血管內介入栓塞等,但這兩種手段用于大腦中動脈瘤破裂的治療效果仍存爭議。本研究采用回顧性研究設計,分析顯微手術夾閉與血管內介入栓塞在大腦中動脈瘤破裂治療中的價值,現報告如下。
1 資料與方法
1.1 一般資料
回顧性選取2020年12月—2022年11月在南京醫科大學附屬淮安第一醫院接受治療的大腦中動脈瘤破裂患者作為研究對象。納入標準: ① 符合蛛網膜下腔出血(SAH)診斷標準[3]者; ② 術前經數字減影血管造影(DSA)或CT血管成像(CTA)檢查明確診斷為大腦中動脈瘤破裂者; ③ 單發性動脈瘤者; ④ 滿足開顱手術及血管內治療適應證者; ⑤ 獲得隨訪且臨床資料完整者。排除標準: ① 不愿接受顯微夾閉手術或血管內介入栓塞治療者; ② 有開顱手術或血管內治療禁忌證者。本研究共納入96例大腦中動脈瘤破裂患者,其中男39例,女57例,年齡6~80歲,平均(59.10±11.40)歲; 入院時格拉斯哥昏迷指數(GCS)評分3~15分,平均(12.26±4.08)分; Fisher分級為1級19例, 2級45例, 3級17例, 4級15例; Hunt-Hess分級為1級16例, 2級43例, 3級15例, 4級18例, 5級4例。將65例行顯微手術夾閉治療的患者設為顯微手術組,將31例行血管內介入栓塞術的患者設為介入栓塞組。本研究符合生物醫學研究的倫理原則,通過了醫學委員會的倫理學審查。
1.2 方法
所有患者入院后采取積極的對癥治療措施,以維持生命體征穩定,并在入院后72 h內行顯微手術夾閉治療或血管內介入栓塞術。血管內介入栓塞術前4 h需口服300 mg阿司匹林腸溶片、300 mg氯吡格雷,術前0.5 h靜脈注射10 mg地西泮,術中靜脈滴注肝素鈉(速率1.25 g/h)進行全身肝素化。
顯微手術夾閉: 患者取仰臥位,氣管插管全身麻醉下實施手術。頭架固定頭部,消毒、鋪巾。采取翼點入路開顱,使用骨膜剝離子對皮瓣行鈍性分離。顳上線與冠狀縫交界位置鉆孔,銑去骨瓣,去除2/3蝶骨嵴以暴露顱底。將腦膜固定,沿弧形剪開硬腦膜,開放側裂池,打開額葉并適當降低顱內壓。置入顯微鏡,鏡下沿頸內動脈找到大腦中動脈,確定瘤體位置后,輕柔地分離并暴露瘤頸,使用臨時阻斷夾夾閉瘤體供血動脈,動脈瘤夾型號根據瘤頸大小進行選擇,在理想位置使用瘤夾完全夾閉血管,可適當調整瘤夾位置或增加瘤夾數量,以完全阻斷瘤體血供。阻斷完全后松開臨時阻斷夾,確認載瘤動脈暢通且無出血后,對硬腦膜進行縫合。若術后腦組織有明顯腫脹,可通過不復位骨瓣以降低顱內壓,無異常則正常復位骨瓣后固定。完成后徹底止血、縫合頭皮,最后覆蓋無菌敷料。
血管內介入栓塞術: 患者取仰臥位,全憑靜脈麻醉下行Seldinger股動脈穿刺,置入鞘導管(6F),引入血管內導管,行全腦血管造影,再次確認動脈瘤情況(大小、位置、形狀等)后,將型號適合的彈簧圈送入動脈瘤瘤腔內部。再次血管造影,確認瘤腔是否完全閉塞,完全閉塞后將導管拔出。所有患者術后送監護室觀察,采取抗感染、抗血管痙攣、降顱內壓等措施,并密切監測患者的生命體征。
1.3 觀察指標
① 記錄2組患者的圍術期指標,包括手術時間、術中出血量、術后住院時間、治療費用等。② 術前及術后3 d時,采集患者的空腹靜脈血,離心分離血清,測定血漿纖維蛋白原(Fib)、血清白細胞計數(WBC)、中心粒細胞計數(NE)、腫瘤壞死因子-α(TNF-α)及免疫指標[免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)]。比較2組治療前后的IgG、IgM、IgA、WBC、NE、Fib水平。③ 比較2組患者術后1周的延遲性腦缺血發生率。延遲性腦缺血診斷標準: 意識水平下降,瞳孔對光反應敏感性降低,新增神經功能缺損病灶,格拉斯哥預后評分(GOS)下降。④ 記錄2組患者術后并發癥發生情況,包括肺部感染、切口愈合不良、顱內感染、慢性腦積水等。⑤ 術后3個月,采用Barthel指數評定量表對患者的日常生活能力進行評估,量表共設10項(進食、穿衣、洗澡、梳妝洗漱、行走等),各項目根據自理程度評分0~15分,滿分100分,得分越高表明自理能力越強。⑥ 2組患者均隨訪3個月以上,比較2組術后3個月的動脈瘤復發情況,動脈瘤復發經末次隨訪的CTA或DSA檢查予以判定。
1.4 統計學分析
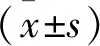
2 結 果
2.1 2組患者基線資料比較
2組患者的性別分布、年齡、入院GCS評分、Hunt-Hess分級及Fisher分級等資料比較,差異無統計學意義(P>0.05)。見表1。
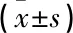
表1 2組患者基線資料比較
2.2 2組患者圍術期指標比較
與顯微手術組相比,介入栓塞組的手術時間更短,術中出血量更少,但治療費用更高,差異有統計學意義(P<0.05)。見表2。
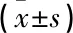
表2 2組患者圍術期指標比較
2.3 2組患者血清免疫指標比較
2組患者術前的各項血清免疫指標比較,差異無統計學意義(P>0.05); 術后3 d時, 2組患者的IgG、IgM及IgA水平均較術前降低,且顯微手術組的IgG、IgM及IgA水平低于介入栓塞組,差異有統計學意義(P<0.05)。見表3。
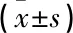
表3 2組患者血清免疫指標比較 g/L
2.4 2組患者手術前后的WBC、NE、Fib及TNF-α水平比較
2組術前WBC、NE水平比較,差異無統計學意義(P>0.05); 術后3 d時, 2組WBC、NE水平與術前比較,差異無統計學意義(P>0.05), 2組組間WBC、NE水平比較,差異也無統計學意義(P>0.05)。術后3 d時, 2組Fib及TNF-α水平較術前升高,但介入栓塞組的Fib及TNF-α水平均低于顯微手術組,差異有統計學意義(P<0.05)。見表4。
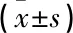
表4 2組手術前后的WBC、NE、TNF-α及Fib水平比較
2.5 2組術后延遲性腦缺血發生情況
介入栓塞組術后1周共有12例發生延遲性腦缺血,發生率為38.71%(12/31), 因腦缺血死亡2例(6.45%); 顯微手術組有18例術后發生延遲性腦缺血,發生率為27.69%(18/65), 因腦缺血死亡2例(3.08%)。2組延遲性腦缺血發生率、腦缺血死亡率比較,差異均無統計學意義(χ2=0.728、0.052,P>0.05)。
2.6 2組術后并發癥發生率比較
介入栓塞組術后并發癥總發生率為6.45%, 顯微手術組為9.23%, 差異無統計學意義(P>0.05)。見表5。

表5 2組患者術后并發癥發生率比較
2.7 2組術后的Barthel指數及復發情況對比
介入栓塞組術后3個月的Barthel指數為(83.55±9.64)分,高于顯微手術組的(61.69±6.72)分,差異有統計學意義(t=12.886,P<0.05)。介入栓塞組術后有2例復發,復發率為6.45%; 顯微手術組復發1例,復發率為1.54%; 介入栓塞組的復發率高于顯微手術組,差異有統計學意義(χ2=4.614,P<0.05)。
3 討 論
臨床對于大腦中動脈瘤的發生機制尚無統一認識,普遍認為是先天因素(遺傳、血管畸形等)及后天因素(退行性病變、外傷等)共同作用的結果。臨床治療大腦中動脈瘤的關鍵在于減少遲發性腦血管痙攣的發生,恢復腦組織正常血運,進而降低患者的病死率及致殘風險[4]。顯微神經外科手術是治療腦動脈瘤的傳統手段,隨著造影技術的不斷提高和手術室環境的不斷改善,顯微夾閉術對動脈瘤的完全夾閉率明顯提高,手術并發癥發生率也有所降低。在顯微夾閉術中進行血管搭橋、吻合能方便復雜動脈瘤的處理,但對術者的技術要求更高,并且會延長手術時間[5]。由于大腦中動脈分叉部位的動脈瘤位置表淺,發生破裂出血的動脈瘤還多伴有局部血腫,因此既往多采用外科顯微手術,該術式的視野范圍大,可在直視下夾閉動脈瘤,確保瘤體周圍結構的安全,便于徹底清除血腫,緩解腦血管痙攣,臨床應用也取得了一定的成效[6]。但是該術式的手術創傷較大,術后容易發生動脈瘤再破裂及腦血管痙攣等并發癥。由于大腦中動脈血管分支無側支循環,但存在為腦功能區供血的豆紋動脈,顯微夾閉治療極易造成腦功能損傷[7]。
血管介入栓塞術通過在瘤體腔內置入彈簧圈等材料來達到栓塞動脈瘤的目的,具有創傷小、恢復快的優點。對于年齡較大或術中難以顯露動脈瘤的患者,血管介入栓塞術的優勢明顯。然而,血管介入栓塞術并不能有效解決顱內血腫或巨大動脈瘤產生的占位效應,對于顱壓高、腦腫脹及腦血管痙攣嚴重者,血管介入栓塞術也不適宜[8]。大腦中動脈瘤多為寬徑動脈瘤,且周圍解剖結構復雜,支架導管通過有一定難度,而破裂出血的大腦中動脈瘤使用支架還會增加血栓形成風險。顯微夾閉術可能更適宜處理大腦中動脈瘤破裂出血,但顯微夾閉處理大腦中動脈瘤是否比血管介入栓塞術更具有優勢尚無明確結論[9]。本研究結果顯示,相較于顯微手術組,介入栓塞組的手術時間更短,術中出血量更低,治療費用更高,這是因為顯微手術夾閉對術者的技術要求較高,操作復雜,對患者機體創傷較大,所以手術時間更長,術中出血更多。
延遲性腦缺血是動脈瘤性SAH最常見的并發癥之一,研究[10]指出SAH患者中超過3/5會發生延遲性腦缺血,而癥狀性腦出血發生率超過30%,并且這類患者的死亡風險會增加1~3倍。研究[11]指出炎性因子對預測動脈瘤性SAH術后延遲性腦缺血發生有一定的參考價值,認為炎性因子可刺激血管內皮細胞,促使血管壁發生免疫性炎癥反應,誘發平滑肌收縮,并且炎性因子還能刺激血管內皮細胞合成,上調內皮素-1, 從而使血管收縮加劇,增加延遲性腦缺血發生風險。本研究顯示, 2組患者術后3 d的TNF-α水平升高,而介入栓塞組的升幅相對更小。這一結果與相關研究[12]結論相符,可能是因為顱內血腫、動脈瘤破裂出血、手術創傷均可導致炎癥因子釋放,而顯微夾閉操作過程中為暴露瘤動脈及瘤頸而進行血管牽拉、分離,造成的創傷較大,而血管介入栓塞術的創傷較小,對于解剖位置復雜的大腦中動脈瘤,術中對腦血管的損傷較小,因此術后炎癥因子水平相對更低[13]。
Fib是一種參與凝血與止血過程的重要纖維蛋白,主要由肝細胞產生。本研究結果顯示, 2組術后3 d的Fib水平均較術前提高,且顯微手術組的Fib水平顯著高于介入栓塞組,這與徐四軍[14]研究結論相符,提示相比顯微夾閉手術,介入栓塞治療對機體凝血-纖溶系統的影響更小。郭星星等[15]研究指出,介入栓塞術治療的患者的延遲性腦缺血發生率低于常規手術夾閉治療的患者。本研究中,介入栓塞組與顯微手術組的術后延遲性腦缺血發生率比較無顯著差異,但術后TNF-α、Fib水平均提示介入栓塞組的炎癥反應更輕,可能與本研究中介入栓塞組病例數偏少有關。
本研究發現2組患者術后的免疫功能指標水平均較術前明顯降低,但介入栓塞組的IgG、IgM及IgA降幅相對更低,說明介入栓塞術治療大腦中動脈瘤破裂造成的免疫功能抑制更小,其原因可能是介入栓塞術對腦組織的二次損傷較輕,不易引起顱內壓升高或腦腫脹,而顯微夾閉術的創傷更大、操作時間更長,因此對免疫功能的影響更大[16]。本研究結果還顯示,2組術后并發癥總發生率接近,介入栓塞組術后3個月的Barthel指數評分顯著高于顯微手術組,但介入栓塞組術后的復發率也顯著高于顯微手術組。顯微夾閉治療和血管介入栓塞治療均可能有瘤頸殘留,因此有一定的復發風險。顯微夾閉手術后雖可經熒光造影術明確瘤頸有無殘留,根據需要調整動脈瘤夾位置,但位于瘤動脈后下方的動脈瘤因存在顯微鏡死角遮蔽,仍可能有瘤頸殘留[17]。血管內介入栓塞術雖能全方位地觀察動脈瘤,但可能存在部分彈簧圈無法操控突入載瘤動脈的問題,考慮到突出彈簧圈會使載瘤動脈閉塞,所以臨床需采取栓塞大部分瘤體而殘留部分瘤頸的做法[18]。該方法雖然能夠較好地避免動脈瘤再破裂,但卻增加了術后動脈瘤復發的風險。
綜上所述,顯微手術夾閉與血管內介入栓塞術均是治療大腦中動脈瘤破裂的有效手段,但血管內介入栓塞術創傷更小,免疫抑制更輕,可能對降低術后延遲性腦缺血發生風險有益,但術后復發率也較高,治療費用更高。

