農(nóng)桿菌浸種對甘藍種子萌發(fā)及幼苗生長的影響
李光遠 王鳳華 蔣燕

摘要:采用不同D600 nm值的農(nóng)桿菌菌液浸泡甘藍種子,研究農(nóng)桿菌浸種對甘藍種子萌發(fā)及幼苗生長發(fā)育的影響,并檢測其轉(zhuǎn)化效果。結(jié)果發(fā)現(xiàn),農(nóng)桿菌浸種對甘藍種子的發(fā)芽率、發(fā)芽指數(shù)、活力指數(shù)均有抑制作用,且D600 nm值越高,抑制作用越明顯。此外,農(nóng)桿菌浸種對甘藍幼苗的株高、葉面積、根莖比、鮮質(zhì)量均有顯著抑制作用。葉綠素含量隨D600 nm值增大,呈先增加后降低的趨勢,D600 nm為0.8時,葉綠素含量最高,為7.86 mg/g,D600 nm 為1.6時,葉綠素含量最低,為5.64 mg/g。農(nóng)桿菌浸種不影響SOD活性,但POD、CAT活性均隨著D600 nm值的升高而升高。農(nóng)桿菌浸種能獲得一定的PPT抗性苗,其中D600 nm 為0.8時獲得的抗性苗最多,達到10.32%。PCR結(jié)果顯示農(nóng)桿菌浸種能實現(xiàn)基因的轉(zhuǎn)化,其中D600 nm 為1.6時轉(zhuǎn)化率最高,達到2.33%。
關(guān)鍵詞:甘藍;農(nóng)桿菌浸種;種子萌發(fā);幼苗;轉(zhuǎn)化
中圖分類號: S635.04 文獻標志碼: A
文章編號:1002-1302(2015)03-0139-03
農(nóng)桿菌介導的遺傳轉(zhuǎn)化是目前較廣泛應用的轉(zhuǎn)基因方法,但是常規(guī)的農(nóng)桿菌介導法依賴于組織培養(yǎng)[1-2],導致其應用受到一定的限制。農(nóng)桿菌浸種法是近年誕生的一種轉(zhuǎn)基因方法,是將萌發(fā)的種子直接浸在農(nóng)桿菌菌液中,利用農(nóng)桿菌的浸染特性和植物細胞自身的物質(zhì)轉(zhuǎn)運系統(tǒng)把外源基因?qū)胧荏w細胞并整合到基因組中穩(wěn)定表達,從而實現(xiàn)遺傳轉(zhuǎn)化[3],如Feldmann等首次利用農(nóng)桿菌浸種法將npt[QX(Y15]Ⅱ[QX)]基因?qū)肓藬M南芥[4],該方法后來相繼在水稻、小麥、黃瓜、番茄、中華結(jié)縷草等植物遺傳轉(zhuǎn)化中取得了成功[5-8]。甘藍的遺傳轉(zhuǎn)化研究起步早,目前已相繼導入抗蟲基因Bt、蛋白酶抑制劑基因、育性基因、抗病基因、生長素基因等[9]。縱觀甘藍的遺傳轉(zhuǎn)化,最常采用的方法還是依賴于組織培養(yǎng)的農(nóng)桿菌介導的遺傳轉(zhuǎn)化,筆者所在實驗室采用該傳統(tǒng)的轉(zhuǎn)化方法獲得了部分激活標簽突變體[10],但是轉(zhuǎn)化效率低下,且需要在無菌條件下進行離體操作。因此,本研究將采用農(nóng)桿菌浸種法,將含激活標簽pSKI015的農(nóng)桿菌轉(zhuǎn)化甘藍,調(diào)查浸種對甘藍種子萌發(fā)及幼苗生長的影響,并探討其轉(zhuǎn)化效果,以期獲得一種甘藍激活標簽突變體材料的簡便轉(zhuǎn)基因方法。
1 材料與方法
1.1 供試材料
供試甘藍為夏光種子,供試農(nóng)桿菌為GV3101(含質(zhì)粒pSKI015)。
1.2 農(nóng)桿菌的培養(yǎng)
用LB培養(yǎng)基接種農(nóng)桿菌,28 ℃、220 r/min振蕩培養(yǎng)過夜,分光光度計測定600 nm下的D值。
1.3 農(nóng)桿菌浸種
取成熟飽滿發(fā)芽率85%以上的種子,用0.4% KMnO4浸種6 min,無菌水沖洗3~4次,25 ℃催芽。待種子80%露白時,再用無菌水沖洗干凈,加入農(nóng)桿菌液,農(nóng)桿菌菌液D600 nm分別為0(未加入農(nóng)桿菌的LB溶液,對照)、0.4、0.8、1.2、1.6。浸種2 h,倒掉菌液,25 ℃黑暗條件下培養(yǎng)2 d后轉(zhuǎn)入鋪有濾紙的培養(yǎng)皿(濾紙使用1 mg/L的PPT浸濕,適時補加),置于 20 ℃、14 h/d光照的培養(yǎng)箱中培養(yǎng),觀察記載發(fā)芽情況。
1.4 幼苗移栽
種子發(fā)芽后統(tǒng)計發(fā)芽率、發(fā)芽勢、活力指數(shù)。用自來水將幼苗沖洗干凈,移栽于穴盤培養(yǎng)。
1.6 生理指標測定
取移栽30 d的苗,測定各生理指標[11]。采用丙酮提取法測定葉綠素含量,氮藍四唑光化還原法測定超氧化物歧化酶(SOD)活性,紫外吸收法測定過氧化氫酶(CAT)活性,愈創(chuàng)木酚法測定過氧化物酶(POD)活性。
1.7 PPT抗性苗篩選
浸種后的種子播種在含1 mg/L PPT的培養(yǎng)皿中發(fā)芽,移栽穴盤后后噴施10 mg/L Basta溶液。
1.8 PCR檢測
CTAB提取PPT抗性苗葉片基因組DNA,以BarF (5′-TCGACTCTAGCGAATTC)和BarR(5′-ATAGGCGTCTCGCATATCTC)為引物擴增長度為700 bp的bar基因,未轉(zhuǎn)化的甘藍為陰性對照,pSKI015為陽性對照,擴增方法和程序參照王愛榮等的方法[12]。PCR 反應總體積 25μL。擴增程序:5 ℃ 預變性5 min;95 ℃變性 30 s,60 ℃退火 30 s,72 ℃延伸 35 s,30 個循環(huán);72 ℃延伸 5 min。取擴增產(chǎn)物10 μL于1% 瓊脂糖凝膠上電泳。
1.9 數(shù)據(jù)處理
用SPSS系統(tǒng)軟件進行數(shù)據(jù)處理,Microsoft Excel軟件作圖,P<0.05作為顯著性檢測標準。
2 結(jié)果與分析
2.1 農(nóng)桿菌浸種對甘藍種子萌發(fā)的影響
由表1可知,隨著農(nóng)桿菌D600 nm的升高,甘藍種子發(fā)芽率基本呈現(xiàn)下降趨勢,其中D600 nm 為0.4時,與對照差異不顯著,但是D600 nm為0.8、1.2、1.6時的發(fā)芽率顯著低于對照,D600 nm為1.6時,發(fā)芽率最低,D600 nm為0.8 和D600 nm為1.2處理之間差異不顯著。發(fā)芽指數(shù)的變化與發(fā)芽率的變化類似,隨著D600 nm的升高而降低,除D600 nm為 0.4與對照差異不顯著外,其他各處理的種子發(fā)芽指數(shù)均顯著低于對照。種子活力指數(shù)的變化也是隨著D600 nm的升高而降低。除D600 nm為 0.4與對照差異不顯著外,其他各處理的種子活力指數(shù)均顯著低于對照。不同的D600 nm之間也存在差異,其中D600 nm 為1.6處理下,種子的活力指數(shù)最低,僅為53.6%。由此可知,農(nóng)桿菌的D600 nm過高,對甘藍種子的萌發(fā)有抑制作用。
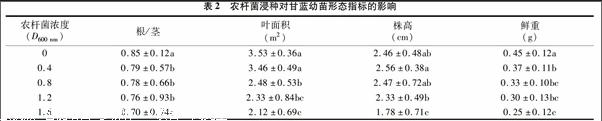
2.2 農(nóng)桿菌浸種對甘藍幼苗生長的影響
由表2可知,對照組的根莖比最大,且隨著D600 nm值的增加,根莖比逐漸減小,所有處理的根莖比均顯著低于對照,D600 nm為 0.4、0.8、1.2 3者之間差異不大,D600 nm為1.6處理時的根莖比最低,僅為0.70,比對照降低了約18%。因此,農(nóng)桿菌浸種對甘藍幼苗的根莖比有抑制作用。甘藍幼苗的葉面積也隨著D600 nm值的增加而降低,其中D600 nm為 0.4與對照差異并不顯著,對照組的葉面積最大,D600 nm為 1.6的葉面積最小。由此可知,農(nóng)桿菌浸種對甘藍幼苗葉面積有抑制作用,在D600 nm高于0.8時開始表現(xiàn)較明顯的抑制效應。株高的變化與根莖比和葉面積的變化有所不同,僅在D600 nm為1.2、1.6下表現(xiàn)抑制效應。在D600 nm達到1.6時,株高僅為對照的72%。所有單株鮮質(zhì)量中,對照組最大,與各處理之間差異顯著。D600 nm值為1.6時單株鮮質(zhì)量最低,僅為對照的56%,D600 nm 為0.4、0.8、1.2 3組之間差異不顯著。由此可見,農(nóng)桿菌浸種對甘藍幼苗生長存在一定的抑制作用。
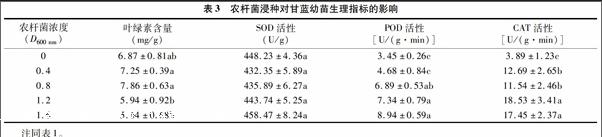
2.3 農(nóng)桿菌浸種對甘藍生理指標的影響
由表3可以看出,在農(nóng)桿菌D600 nm低于0.8時,隨D600 nm的增大,葉綠素含量增加,D600 nm為0.8時,葉綠素含量達到最大值,之后隨著D600 nm的進一步增大,葉綠素含量開始下降,且明顯低于對照,在D600 nm 達到1.6時,葉綠素含量最低。由此可知,高濃度農(nóng)桿菌菌液浸種會降低甘藍的葉綠素含量。
表3還顯示,各處理之間SOD活性差異并不顯著,說明農(nóng)桿菌浸種并不影響SOD活性。POD活性均隨著D600 nm值的增大而升高,對照組的POD活性最低,當D600 nm值大于0.8時POD活性顯著提高,說明農(nóng)桿菌已經(jīng)對甘藍造成脅迫,POD活性提高,其清除自由基的能力也提高,從而避免植株受到傷害。CAT活性的變化也是隨著農(nóng)桿菌菌液濃度升高而增加,當D600 nm大于0.4時,其與對照的差異已經(jīng)達到顯著水平。由此可見,農(nóng)桿菌菌液浸種對甘藍是一種脅迫,為了提高其適應逆境的能力,POD活性升高以清除產(chǎn)生的自由基。
2.4 農(nóng)桿菌浸種對PPT抗性苗率及轉(zhuǎn)化率的影響
由表4可以看出,采用農(nóng)桿菌浸種甘藍能獲得一定的PPT抗性苗,其中D600 nm 為0.8時獲得的抗性苗最多,PPT抗性苗率可以達到10.32%,D600 nm 為1.6時獲得的抗性苗最少,僅為8.34%。
提取PPT抗性植株葉片的基因組 DNA,進行PCR 擴增,部分植株擴增到了長約為 700 bp的片段(圖1-B、C、D、G、H),與從質(zhì)粒Pski015擴增出的片段基本相同(圖1-J),說明基因已經(jīng)整合到了轉(zhuǎn)化植株中,但也有例外,如圖1-E擴增出的片段明顯比對照大,具體原因有待進一步研究。
經(jīng)PCR檢測,統(tǒng)計轉(zhuǎn)化率結(jié)果如表4。由表4可以看出,轉(zhuǎn)化率的大小依次為D600 nm 0.4 3 討論 植物在逆境條件下通常會表現(xiàn)出衰老癥狀,如葉綠素含量降低,蛋白質(zhì)、核酸等大分子水解加速,原生質(zhì)膜以及內(nèi)膜系統(tǒng)發(fā)生過氧化,膜脂過氧化產(chǎn)物MDA含量增加,POD酶促防御系統(tǒng)活性下降等[13]。本研究結(jié)果表明甘藍幼苗葉片中的葉綠素含量隨菌液D600 nm值的增加成先升高后降低的趨勢,在 D600 nm為0.8時,葉綠素含量達到最大值,之后開始下降,這與徐開杰等的研究結(jié)果[14]有所不同,他們發(fā)現(xiàn)隨著農(nóng)桿菌菌液濃度升高,小麥幼苗葉片中葉綠素含量呈下降趨勢。徐開杰等的結(jié)果顯示小麥POD活性隨農(nóng)桿菌菌液濃度升高呈先升后降的趨勢[14],而本研究證實甘藍的POD隨著D600 nm的增加一直成上升趨勢。本研究結(jié)果還表明隨著農(nóng)桿菌菌液濃度升高,甘藍種子發(fā)芽率、發(fā)芽勢、幼苗株高、鮮質(zhì)量含量呈下降趨勢,這與徐開杰等的結(jié)果[14]一致。因此,農(nóng)桿菌浸種對甘藍是一種脅迫作用,特別是高濃度的農(nóng)桿菌會影響萌發(fā)和幼苗的生長代謝。 轉(zhuǎn)化率是衡量轉(zhuǎn)化效果的重要指標,本研究結(jié)果表明在低D600 nm值時(D600 nm<0.8),轉(zhuǎn)化率為零,這與陳明利等的結(jié)果[15]類似,他們認為農(nóng)桿菌濃度D600 nm值小于0.5時,即使采用長時間侵染,轉(zhuǎn)化效率也不高。但是農(nóng)桿菌菌液濃度也不宜過高,如本研究中在D600 nm為1.6時,獲得的轉(zhuǎn)化率雖然較高,但是在此處理下甘藍幼苗生長嚴重受抑、甚至死亡。陳明利等發(fā)現(xiàn),當農(nóng)桿菌菌液D600 nm超過1.5時,對小麥種子萌發(fā)和幼苗生長發(fā)育產(chǎn)生了較為嚴重的傷害作用,小麥種子發(fā)芽率顯著降低,幼苗出現(xiàn)生長減慢、停止甚至出現(xiàn)白化、最終死亡的現(xiàn)象[15]。他們認為從獲得轉(zhuǎn)基因植株的規(guī)模方面考慮,農(nóng)桿菌菌液D600 nm不超過1.5,這與本研究結(jié)果是一致的。 目前,依賴于組織培養(yǎng)的農(nóng)桿菌介導的遺傳轉(zhuǎn)化仍然是甘藍轉(zhuǎn)基因研究的主要手段。但是這種方法操作繁瑣,需要高頻率的再生系統(tǒng),特別是組織培養(yǎng)要求無菌,而農(nóng)桿菌本身又是一種細菌,這增加了無菌操作的難度。因此,探索一種簡單、快捷、高效的遺傳轉(zhuǎn)化方法勢在必行。種子浸泡法是最近誕生的一種用于植物轉(zhuǎn)化的方法,已經(jīng)取得了一定的成功。本研究證實采用農(nóng)桿菌浸種甘藍也可以實現(xiàn)基因的轉(zhuǎn)移,雖然轉(zhuǎn)化率僅為2.33%,但今后深入研究將有助于獲得轉(zhuǎn)化率更高的轉(zhuǎn)基因轉(zhuǎn)化體系。 參考文獻: [1]劉 凡,王國英,曹鳴慶. 農(nóng)桿菌介導的植物原位轉(zhuǎn)基因方法研究進展[J]. 分子植物育種,2003,1(1):108-115.
[2]鄭 杰. 農(nóng)桿菌介導的高效水稻遺傳轉(zhuǎn)化體系的研究[J]. 湖南農(nóng)業(yè)科學,2008(2):6-7,10.
[3]張慶祝,韓天富. 植物非組培遺傳轉(zhuǎn)化方法研究的進展[J]. 分子植物育種,2004,2(1):85-91.
[4]Feldmann K A,Marks M D. Agrobaterium mediated transformation of germinating seeds of Arabidopsis thaliana:a non-tissue culture approach[J]. Molecular & General Genetics,1987,208:1-9.
[5]許 耀,王 艇,李寶健. 根癌農(nóng)桿菌介導的外源基因轉(zhuǎn)化植物萌動種胚的研究[J]. 實驗生物學報,1991,24(2):109-117.
[6]奚亞軍,張啟發(fā),林擁軍,等. 利用農(nóng)桿菌浸種法將葉片衰老抑制基因PSAG12-IPT導入普通小麥的研究[J]. 中國農(nóng)業(yè)科學,2004,37(8):1235-1238.
[7]雷江麗,王 丹,吳燕民,等. 農(nóng)桿菌浸種法介導中華結(jié)縷草遺傳轉(zhuǎn)化體系的建立[J]. 農(nóng)業(yè)生物技術(shù)學報,2009,17(5):865-871.
[8]林擁軍. 農(nóng)桿菌介導的水稻高效遺傳轉(zhuǎn)化體系的研究[D]. 武漢:華中農(nóng)業(yè)大學,2001.
[9]秦耀國,雷建軍,曹必好,等. 甘藍類蔬菜遺傳轉(zhuǎn)化研究進展[J]. 中國蔬菜,2004(4):61-63.
[10]王鳳華,陳雙臣,李光遠,等. 激活標簽轉(zhuǎn)化結(jié)球甘藍的研究[J]. 西北植物學報,2009,29(5):905-909.
[11]張立軍,樊金娟. 植物生理學實驗教程[M]. 北京:中國農(nóng)業(yè)大學出版社,2007.
[12]王愛榮,吳智芳,張麗麗,等. 影響擬南芥轉(zhuǎn)化效率和激活標簽丟失的因素分析[J]. 福建農(nóng)林大學學報:自然科學版,2006,35(3):298-302.
[13]徐開杰,孟 敏,史麗麗,等. 農(nóng)桿菌對大麥種子萌發(fā)及幼苗生長發(fā)育的影響[J]. 西北植物學報,2009,29(7):1408-1414.
[14]徐開杰,史麗麗,劉曙東,等. 農(nóng)桿菌浸種處理對小麥種子萌發(fā)及幼苗生長發(fā)育的影響[J]. 西北植物學報,2011,31(5):985-994.
[15]陳明利,劉香利,唐廣立,等. 農(nóng)桿菌侵染小麥的優(yōu)化方案[J]. 分子植物育種,2007,5(4):577-582.

