銅鋅原電池作為原電池基本模型的局限及其突破
吳晗清+張娟+趙冬青
摘要:銅鋅原電池作為學生學習原電池的基本模型,不具備原電池工作原理的普適性,從而導致師生對原電池的理解存在諸多困境。對北京市某示范高中的158名高一學生進行測試發現:絕大部分學生認為“電極材料必然活潑性不同”,“電極材料的不同是產生電勢差的本質原因”,學生對原電池工作原理的理解局限于銅鋅原電池模型。基于此,構建了原電池認知的通用模型,并提出相應的教學建議。
關鍵詞:銅鋅原電池;原電池模型;局限性;教學建議;化學教學
文章編號:1005–6629(2017)1–0016–05 中圖分類號:G633.8 文獻標識碼:B
“原電池”是高中化學的核心概念,也是電化學的基礎,與生產、生活有著密切聯系。對于這部分學習,不僅要基于相關物質的性質、氧化還原反應、電解質、離子反應、能量變化等知識的綜合理解和運用[1],還涉及物理學中電流產生的原因,電勢差等知識。初學階段,就要求學生能夠對原電池的宏觀現象進行微觀、抽象的解釋;隨著學習的深入,原電池的種類越來越多,涉及的理論也更加抽象。在實際教學中,銅鋅原電池常作為學生對原電池的第一認知模型,認為“原電池由活潑性不同的電極材料、電解質溶液、導線構成”(負極反應為Zn-2e-=Zn2+;正極反應H++2e-=H2),這極易引發學生對于原電池模型及其工作原理的錯誤理解。例如,學生通常認為兩極一定為活潑性不同的材料,而較活潑的材料必為負極。甚至有學生認為電極材料的差異是原電池產生電勢差的本質原因。由此可見,學生對于原電池模型及其工作原理的理解存在大量的迷思概念。筆者通過實證研究的方式調查學生對于電極材料、電流產生原因、工作原理等內容的理解,分析學生對于原電池模型及工作原理理解的癥結所在。筆者嘗試建構有助于學生對于原電池工作原理深入理解的通用模型,并提出相應的教學建議,以期為完善原電池內容的教學現狀帶來教益。
1 銅鋅原電池作為原電池基本模型的局限性
1.1 不具備原電池工作原理的普適性
銅鋅原電池相對簡單,新舊教材和大部分的教學也都將其作為學生對原電池的第一認識模型,這種由淺入深的教學方式不可否認存在一定的優點,但同時也對于學生錯誤概念的產生埋下了隱患。
首先,銅鋅原電池的兩個電極材料不同,但并非所有的原電池都要求兩個不同的電極材料,比如燃料電池。其次,大都認為電勢差是由兩個不同的電極材料產生。由于鋅的失電子能力比銅的強,導致鋅的周圍電子相對富集。金屬的性質越活潑其電極電勢就越低,當連接兩個電極時,電子就從電勢低的鋅這一極向電勢高的銅這一極移動[2]。但電勢差的產生絕非僅來自兩個不同的電極材料,還可以由氧化還原反應的兩個半反應電對以及溶液中電荷的不均勻分布產生。比如氫氧燃料電池的兩個電極材料相同,其液接電勢一樣,此時提供電勢差的是氫氣和氧氣發生氧化還原反應的兩個半反應電對[3]。溶液中電荷的不均勻分布引起陰、陽離子的定向移動。
再者,較活潑的鋅做負極,較不活潑的銅做正極。學生在大量題海訓練時,如果學生沒有掌握原電池的本質,往往會認為較活潑的一極必是負極,而忽略離子導體的影響。比如鐵銅做電極材料,電解質溶液分別為稀硫酸和濃硫酸的兩個原電池,總的氧化還原反應不同,正負極也恰好相反。因為,前者是鐵和稀硫酸的反應,鐵是負極;后者是銅和濃硫酸的反應,鐵則成了正極。
此外,鋅這一極既做載體又參與電極反應,而銅這一極僅充當載體。因此學生往往認為負極的電極材料就一定參加電極反應,而正極材料就一定不能參加。事實上,對于原電池來說,如果氧化劑和還原劑可以充當電極材料則優先考慮;若不能,再考慮其他的材料,但選擇的電極材料不能影響總反應。
1.2 導致師生對原電池工作原理的認知困境
近年來原電池相關的考題越來越靈活,原電池也更加的抽象。在此情境下,如何讓學生對原電池的原理有更深層次的認識,能夠促進學生思維的多元發展,自主建構原電池的通用模型,就顯得尤為重要。
首先,教材以銅鋅原電池引入,導致各種參考用書及教輔資料大都在銅鋅原電池的基礎上總結原電池的構成條件:即兩個活潑性不同的金屬或者金屬與可導電的其他物質;電解質溶液;閉合回路;自發進行的氧化還原反應。但當學生學習氫氧燃料電池時就會產生困惑,它為何是兩個相同的電極材料,一些師生錯誤地將其當作原電池中的特例。
其次,學生學習銅鋅原電池的一大障礙是難以理解電子為何從鋅流向銅,使得氧化反應和還原反應分別在兩極上發生。多數教師歸因于鋅的活潑性強于銅,從而導致學生認為電子的移動需要有兩個活性不同的電極。事實上,這里涉及電勢差產生的最根本的原因,即氧化還原反應的兩個半反應電對之間的電勢不同。
此外,銅鋅原電池僅是眾多原電池中的一種,師生易將其作為原電池的“標本”,從而產生錯誤的認知。比如電極材料是否發生反應,并非都像銅鋅原電池一樣,要求一極參加反應而一極不反應,還可以兩個電極材料均參與反應,也可以均不參與反應。
2 學生對原電池理解的實證研究
為了進一步了解課堂觀察與訪談得到的原電池教學困境,筆者針對北京市某示范高中高一實驗班的158名學生進行紙筆測試,收回有效測試卷156份,有效率為98.7%。問題主要涉及三個方面:學生對電極材料的理解、對原電池反應的理解、對原電池工作原理的理解。為了保證研究的有效性,該測試在集中的時間段內進行。
2.1 學生對電極材料的理解:大部分學生錯誤地認為“電極材料必然活潑性不同”
為了考察學生對電極材料的理解,筆者設計了“原電池中一定是較活潑的電極做負極”、“原電池中兩個電極材料一定是活潑性不同的”兩道題,讓學生進行判斷并解釋說明。具體結果如表1所示。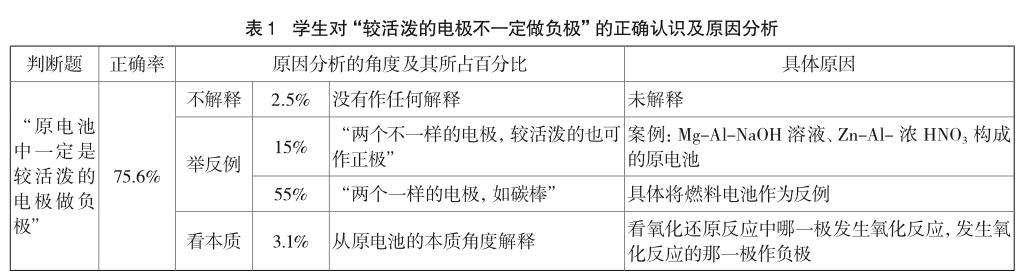
從表1可以看出,有75.6%的學生能正確判斷“在原電池中不一定是較活潑的電極做負極”,通過原因分析發現,學生的解釋可以分為三個層面。其一,憑感覺作判斷,沒有提供任何合理的解釋,這類學生較少。其二,多數學生以舉反例的方式做判斷。有55%的學生將燃料電池作為反例,認為“兩個電極可以是一樣的,如碳棒”;另有15%的學生認為較不活潑金屬也可以作負極,比如Zn-Al-濃HNO3構成的原電池。其三,通過分析原電池的本質得出正確結論,僅占3.1%。這部分學生明確地指出“只要看氧化還原反應中哪一極發生氧化反應,其就做負極”。
由于絕大部分學生并未從本質的角度來理解,有71.8%的學生堅定地認為“原電池的兩個電極材料一定是活潑性不同的”,其理由是“要想發生電子的轉移,電極必須不同”。
2.2 學生對電流產生原因的理解:大部分學生不能認識原電池中電勢差產生的本質原因
為了考察學生對原電池反應的理解,筆者設計了以下問題:從電子移動的角度分析“原電池中的氧化還原反應為何在兩極發生”,從離子在離子導體中移動的角度分析“原電池中陰、陽離子分別向哪一極移動”,并解釋說明。
學生大都能準確地說出:電子是由負極出發經過導線流向正極,陰離子往負極移動,陽離子往正極移動。但對于電子為何這樣移動,少數學生能從電勢差的角度分析,但對于電勢差的理解局限于不同的電極材料產生的電極電勢不同;僅有極個別學生認為“電極材料既可做電極反應物,又可做反應的載體,比如氫氧燃料電池”,能認識到電勢差產生的最根本原因即氧化還原反應的兩個半反應電對之間的電勢不同。
2.3 學生對原電池工作原理的理解:局限于銅鋅原電池模型
通過測試發現,很少有學生能分清楚電極材料、電極反應、電解質溶液三者之間的關系。多數學生依據銅鋅原電池去分析它們之間的關系,局限地認為:負極電極材料一定和電解質溶液發生氧化反應,變成陽離子進入溶液,正極則是溶液中的離子得電子發生還原反應,而且必須用導線連接形成閉合回路。具體分析見表2。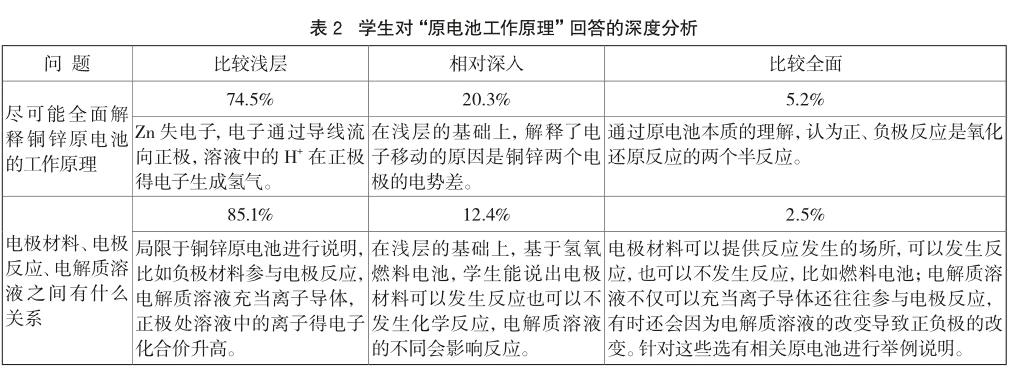
原電池的內容相對抽象,理論性和綜合性又強,學生只能通過邏輯推理和想象,無法通過直觀的實驗現象來理解原電池的工作原理,學生從微觀上理解微粒的移動和所發生的反應。
3 促進學生有效認知原電池的教學建議
課程標準對原電池的教學提出了以下的要求[4]:能夠舉例說明化學能與電能的關系;經歷化學能轉化為電能的探究過程,了解原電池的工作原理,能寫出電極反應和電池反應方程式。然而通過理論分析及實證研究發現學生對原電池的理解很大程度上受到銅鋅原電池的干擾。教材中缺少對電極的說明,學生易將電極材料和電極反應物混為一談,如果把銅鋅原電池作為第一認知模型,并由此總結原電池的構成條件,容易導致學生產生一些錯誤的認知。
因此教師如何幫助學生建構原電池通用模型就顯得非常重要,只用銅鋅原電池去建構學生對原電池的認知模型顯然是不夠的,甚至是有害的。筆者基于對原電池系統的整體分析,設計了“兩個電極材料均不參與反應”、“一個電極材料參與反應”、“兩個電極均參與反應”的原電池認知教學方案。具體的典型案例見表3。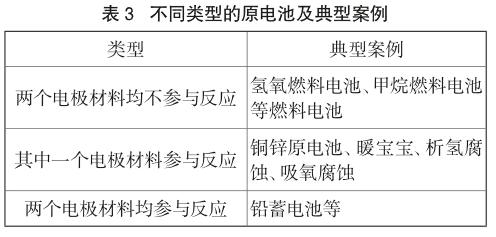
在教學中首先通過火力發電效率低,引入火力發電的實質是想通過化石燃料燃燒最終實現向電能的轉化,由此引發學生思考:化學能通過什么途徑釋放出來?又如何能將化學能轉化為電能?通過問題線索引發學生思考,引導學生逐步認識氧化還原反應與電荷移動的關系。在深入分析的基礎上得出,化學能向電能的轉化需要有電子的定向移動,需要提供電子的裝置和接受電子的裝置。如何實現氧化還原反應中電子的定向移動,引出還原劑提供電子,氧化劑接收電子,兩極之間連接電子導體(如導線或者直接接觸)以及離子導體(電解質溶液或熔融電解質等)從而形成閉合的回路。學生在思考中逐步構建基本模型:兩極的反應物、兩極的電極材料、電子導體、離子導體。基于此,在依次分析“兩個電極材料均不參與反應”的氫氧燃料電池、“一個電極材料參與反應”的銅鋅原電池、“兩個電極均參與反應”的鉛蓄電池后,接下來從電極材料、電極反應、原電池工作原理三個方面分別闡釋。
3.1 對電極材料和電極反應物的探討
如上所述,根據電極材料是否參加反應,可分為三類。首先討論氫氧燃料電池,引導學生分析其中的總反應,確定還原劑和氧化劑。裝置的作用使得反應不再需要點燃引發就可以直接進行,其中電極反應物分別是通入的H2和O2,電極材料是兩個相同的石墨。氫氣做還原劑發生氧化反應,氧氣做氧化劑發生還原反應。兩個相同的電極材料提供反應發生的場所,但均不參加反應。其次,對銅鋅原電池進行分析,在思考總反應的基礎上分析電極材料,鋅既做電極反應物,又提供反應場所;銅與稀硫酸不反應,僅充當載體。最后,分析“兩個電極均參與反應”的鉛蓄電池,在給出其裝置和總反應方程式的基礎上,探討兩個電極材料均參與反應,鉛在負極被氧化,既做電極材料,又參與反應;同樣氧化鉛在正極被還原,既做電極材料,又參與反應。
3.2 對電流產生原因的探究
在教師提供電勢差資料的基礎上,學生分析三種類型原電池的電勢差產生的來源,引導學生分析電子導體中的電子移動及離子導體中離子的運動。首先對氫氧燃料電池進一步分析,兩個電極材料相同,它們之間不存在電勢差。但是通入的氫氣在界面上有發生氧化反應的趨勢、電子相對富集;通過氧氣的這一極有得電子的趨勢,使得電子從電勢低的負極通過導線向正極移動。電子在輸送的過程中,氫氣不斷地失電子,不斷有氫離子進入溶液,氧氣這一極則源源不斷地得到電子發生氧化反應。


3.3 對原電池工作原理的整體把握
整個設計是基于電極材料是否參與電極反應,原電池是自發的氧化還原反應提供電勢差,使得電流得以產生而展開。在對三類原電池案例分析的基礎上,開展學生活動,以粘貼紙的形式更換電極材料、電極反應物,以及電子導體、離子導體的方式,讓學生明白無論什么類型的原電池,其構成的基本要素必須有:兩個電極材料、兩個電極反應物、離子導體和電子導體[6],只不過同一極的電極材料和電極反應物可以相同也可以不同,從而建立原電池認知的通用模型,以期消除以銅鋅原電池作為第一認知模型帶來的教學困境,具體如圖1所示。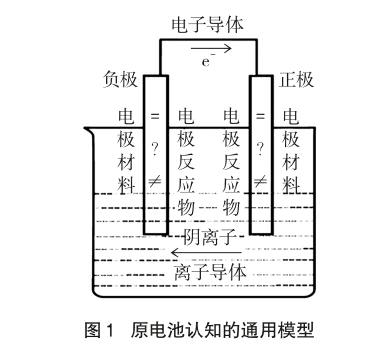
在上述通用模型中,一方面以“問號”引發學生對原電池的電極材料與電極反應物之間的關系進行思考。對于鉛蓄電池,電極反應物即電極材料本身,此時電極材料Pb和PbO2均“=”電極反應物。有些則不然,如氫氧燃料電池的兩個鉑電極均“≠”電極反應物H2和O2。因此,通用模型以“電極材料”、“等號”、“不等號”等內容替換銅鋅原電池中的“銅”和“鋅”,在一定程度上增強了原電池模型的普適性。另一方面,電子和離子在電勢差的作用下,定向移動至原電池的兩極。圖中“箭頭”表示電子導體中電子由負極移到正極,離子導體中陰離子向負極移動,陽離子向正極移動。自發進行的氧化還原反應是產生電勢差推動電子或離子定向移動的本質原因。在銅鋅原電池模型中,學生無法對電勢差究竟產生于電極材料還是電極反應做出有效判斷。而在通用模型中,“問號”、“電極材料”、“等號”、“不等號”、“箭頭”等符號將抽象的概念原理進行形象化,讓學生有效地建構了對“原電池”的深度認知。
參考文獻:
[1]姜麗莉.高中生原電池錯誤概念的診斷及教學對策[J].教學儀器與實驗,2015,(31):3~6.
[2]周慶華.對原電池工作原理的探討[J].化學教學,2016,(1):23~25.
[3]張玲,陳磊磊.有關原電池的概念及原理[J].化學教學,2010,(4):1~4.
[4]中華人民共和國教育部制定.普通高中化學課程標準(實驗)[S]北京:人民教育出版社,2003:9~20.
[5]吳晗清.高中生科學素養模型的建構及其實證研究[J].上海教育科研,2016,(5):33.
[6]徐敏.深入原電池原理本質,促進學生觀念和能力的發展[J].化學教育,2015,36(19):27~31.

