淺談藥品質(zhì)量標(biāo)準(zhǔn)的建立和有效期的評(píng)估
石水萍 梁芳芳

DOI:10.16660/j.cnki.1674-098X.2102-5640-6830
摘? 要:近十幾年,中國(guó)制藥行業(yè)快速發(fā)展,隨著大眾及藥監(jiān)部門對(duì)公眾健康及安全用藥的重視,藥品的安全性、有效性和質(zhì)量可控性越來(lái)越被制藥企業(yè)所關(guān)注。結(jié)合藥品申報(bào)經(jīng)驗(yàn)及藥品日常質(zhì)量控制情況,藥企在藥品質(zhì)量標(biāo)準(zhǔn)的建立及有效期的評(píng)估中,仍存在一些普遍性問(wèn)題。本文對(duì)如何通過(guò)工藝能力和質(zhì)量指標(biāo)詮釋藥品的特性,以及如何通過(guò)穩(wěn)定性研究建立合理的有效期,做了一些分析、匯總和總結(jié),淺析如何更好地制定藥品的質(zhì)量標(biāo)準(zhǔn)及有效期。
關(guān)鍵詞:制藥企業(yè)? 質(zhì)量標(biāo)準(zhǔn)? 有效期? 評(píng)估
中圖分類號(hào):R95 ? ? ? ? ?文獻(xiàn)標(biāo)識(shí)碼:A? ? ? ? ? ? ? ? ? 文章編號(hào):1674-098X(2021)03(c)-0186-03
Establishment of Drug Quality Standard and Evaluation of Validity
SHI Shuiping? LIANG Fangfang
(Xinchang Pharmaceutical Factory of Zhejiang Pharmaceutical Co., Ltd., Xinchang, Zhejiang Province, 312500 China)
Abstract: In recent years, China's pharmaceutical industry has developed rapidly. With the public and drug administration departments paying more attention to public health and safe drug use, pharmaceutical companies pay more and more attention to the safety, effectiveness and quality control of drugs. Combined with the experience of drug declaration and the daily quality control of drugs, there are still some common problems in the establishment of drug quality standards and the evaluation of validity period in pharmaceutical enterprises. This paper makes some analysis, summary and summary on how to interpret the characteristics of drugs through process capability and quality indicators, and how to establish a reasonable period of validity through stability research, so as to analyze how to better formulate the quality standard and period of validity of drugs.
Key Words: Pharmaceutical enterprises; Quality standard; Validity; Assessment
藥品,作為一種用于預(yù)防、治療或診斷人類疾病的特殊物質(zhì),除了外觀,使用者是無(wú)法辨別其內(nèi)在質(zhì)量的。這樣一來(lái),制藥企業(yè)如何評(píng)價(jià)、通過(guò)哪些項(xiàng)目、設(shè)定怎樣的指標(biāo)來(lái)詮釋藥品的安全性、有效性和穩(wěn)定性,就顯得尤為重要。
藥品的質(zhì)量標(biāo)準(zhǔn),正是在藥物開(kāi)發(fā)、研究、生產(chǎn)過(guò)程中制定出來(lái)的,用于判定藥品這些特性的重要指標(biāo),直接關(guān)系到藥品的放行和使用。如何確保出廠藥品以及貨架期內(nèi)藥品的質(zhì)量,關(guān)鍵因素之一就是建立合理的質(zhì)量標(biāo)準(zhǔn)及制定合理的有效期。
1? 對(duì)質(zhì)量標(biāo)準(zhǔn)的理解
質(zhì)量標(biāo)準(zhǔn)是由一系列的檢測(cè)、分析方法的參照和適當(dāng)?shù)目山邮軜?biāo)準(zhǔn)(限度值、范圍或其他檢測(cè)中描述的標(biāo)準(zhǔn))組成,是國(guó)家對(duì)藥品質(zhì)量、規(guī)格及檢驗(yàn)方法所做的技術(shù)規(guī)定,是藥品生產(chǎn)、采購(gòu)、使用、檢驗(yàn)和藥監(jiān)部門共同遵循的法定依據(jù)[1]。
因此,好的質(zhì)量標(biāo)準(zhǔn)的制定,不僅要考慮藥品本身特性,還要考慮分析方法、生產(chǎn)工藝過(guò)程的控制、原輔料、穩(wěn)定性等各方面因素,這樣綜合制定的一個(gè)合理的、適當(dāng)?shù)臉?biāo)準(zhǔn),才能夠切實(shí)確保藥品質(zhì)量,確保患者的用藥安全和有效。
質(zhì)量標(biāo)準(zhǔn)制訂時(shí),首先應(yīng)收集和掌握藥物在國(guó)內(nèi)外藥典中是否有收載、文獻(xiàn)中是否有相關(guān)的研究,包括分析方法、安全性、有效性、雜質(zhì)譜、結(jié)構(gòu)確證等資料。其次,應(yīng)掌握在工藝過(guò)程中的中間體和使用到的一些溶劑情況。
在藥物研發(fā)過(guò)程中,從小試開(kāi)始,應(yīng)不斷積累各方面檢測(cè)數(shù)據(jù),并通過(guò)工藝的摸索和變動(dòng),得到更多的藥物質(zhì)量屬性變化的數(shù)據(jù)。其中還應(yīng)關(guān)注原輔料帶入的雜質(zhì)、工藝雜質(zhì)和降解雜質(zhì)等。中試階段,經(jīng)過(guò)多批次數(shù)據(jù)的積累,逐漸確定了處方和工藝,結(jié)合前期研發(fā)數(shù)據(jù)及中試檢測(cè)數(shù)據(jù),能夠初步建立質(zhì)量標(biāo)準(zhǔn),可以對(duì)確定處方和工藝的中試批開(kāi)展預(yù)穩(wěn)定性研究。到了放大試生產(chǎn),不僅需要關(guān)注工藝控制能力,還需要收集和分析工藝波動(dòng)情況下,各質(zhì)量屬性數(shù)據(jù)的波動(dòng)情況。在此期間形成最終的質(zhì)量標(biāo)準(zhǔn)及驗(yàn)證過(guò)的分析方法,用于工藝驗(yàn)證[2],如圖1所示。
2? 質(zhì)量標(biāo)準(zhǔn)的檢驗(yàn)項(xiàng)目及分析方法
質(zhì)量標(biāo)準(zhǔn)的檢驗(yàn)項(xiàng)目可以分為常規(guī)性檢驗(yàn)及專屬性檢驗(yàn)。常規(guī)性檢驗(yàn)是基于指示藥物性質(zhì)的一些共有的檢測(cè)項(xiàng)目,如性狀、鑒別、含量、有關(guān)物質(zhì)等。專屬性檢驗(yàn)則依賴于藥物劑型或工藝或化合物本身的特征,并非共性因素,如:注射劑中的摩爾滲透壓、無(wú)菌檢測(cè)、晶型不穩(wěn)定產(chǎn)品的多晶型檢測(cè)、口服制劑的含量均勻度等[3]。
對(duì)于分析方法,如果藥典方法適用,應(yīng)首選藥典方法并驗(yàn)證。如果采用了文獻(xiàn)報(bào)道,應(yīng)確認(rèn)該方法能夠重現(xiàn)并適用,并確認(rèn)該方法是否具有改進(jìn)的空間,最終通過(guò)驗(yàn)證并使用。當(dāng)完全無(wú)藥典和文獻(xiàn)可供參考的情況下,只能自行開(kāi)發(fā)。自行開(kāi)發(fā)的分析方法,要注意方法自身的變異應(yīng)能夠被控制,分析方法應(yīng)能夠識(shí)別產(chǎn)品的變異[4]。
對(duì)質(zhì)量標(biāo)準(zhǔn)中的項(xiàng)目進(jìn)行分析,基于對(duì)產(chǎn)品安全性和有效性的影響程度,得到關(guān)鍵質(zhì)量屬性,即CQA,這些項(xiàng)目應(yīng)是質(zhì)量研究的重點(diǎn)。
3? 法規(guī)因素及指南
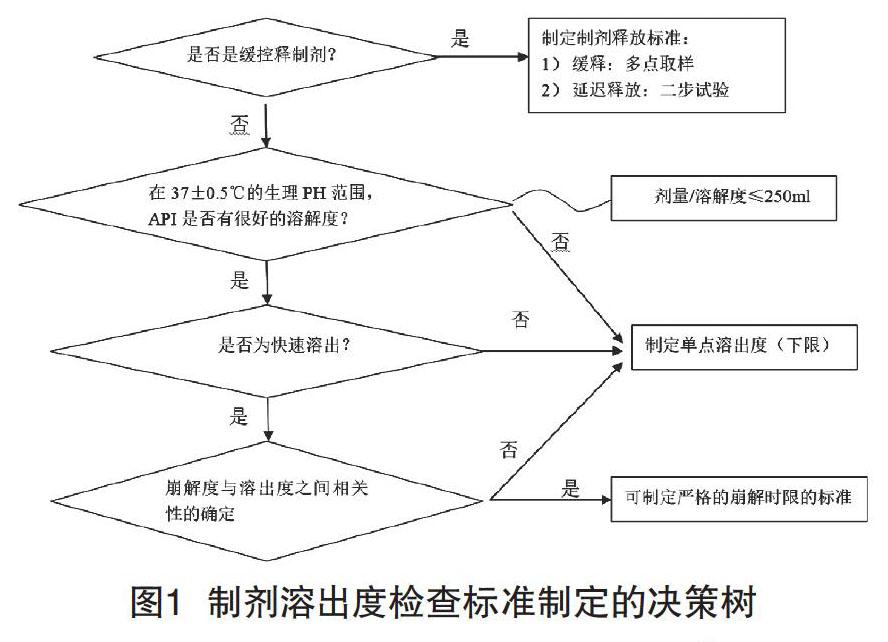
以如何確定口服固體制劑是否需要設(shè)置溶出度可接受標(biāo)準(zhǔn)為例,可通過(guò)下面的決策來(lái)確定。
如圖2,ICH中,對(duì)于藥品質(zhì)量標(biāo)準(zhǔn)的制定、雜質(zhì)研究等,在藥品研發(fā)、臨床、商業(yè)化生產(chǎn)及產(chǎn)品整個(gè)生命周期均有規(guī)定。如表1。
法規(guī)的變化是動(dòng)態(tài)的,應(yīng)時(shí)刻關(guān)注法規(guī)的動(dòng)向及藥典的變化,及時(shí)對(duì)已有的質(zhì)量標(biāo)準(zhǔn)進(jìn)行評(píng)估及變更。
4? 質(zhì)量標(biāo)準(zhǔn)限度的制定
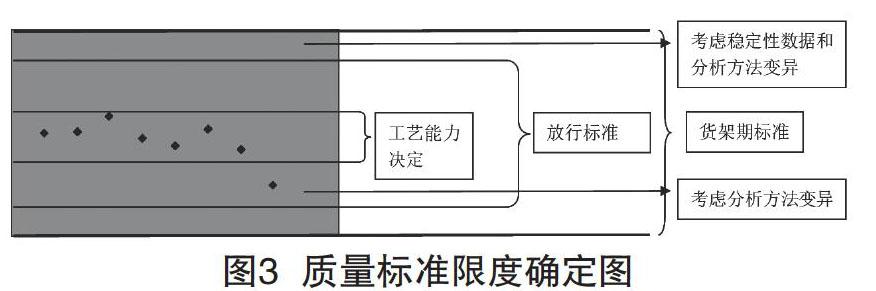
質(zhì)量標(biāo)準(zhǔn)限度的制定,除了基于藥典和文獻(xiàn)的限度外,還應(yīng)考慮工藝過(guò)程的控制能力、穩(wěn)定性過(guò)程中項(xiàng)目的變化情況以及分析方法的誤差。
(1)工藝過(guò)程控制能力:標(biāo)準(zhǔn)的建立要基于數(shù)據(jù)統(tǒng)計(jì),積累一定批次的檢測(cè)數(shù)據(jù),考察工藝變異帶來(lái)的檢測(cè)數(shù)據(jù)的波動(dòng)情況,對(duì)得到的數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析,設(shè)定一定的容忍區(qū)間,例如±3σ。因此,在工藝生產(chǎn)過(guò)程中,應(yīng)該注重控制過(guò)程,減少變異性,確保產(chǎn)品合格。
(2)穩(wěn)定性項(xiàng)目的變化情況:制定合適的標(biāo)準(zhǔn)限度,確保放行產(chǎn)品和貨架期內(nèi)產(chǎn)品都能夠符合標(biāo)準(zhǔn)。因此,是否需要制定內(nèi)控放行標(biāo)準(zhǔn),應(yīng)取決于該藥物穩(wěn)定性期間項(xiàng)目的變化情況。
(3)分析方法誤差:標(biāo)準(zhǔn)限度制定時(shí)還應(yīng)關(guān)注分析方法本身的誤差,但這部分誤差可能在總誤差中占比很小。
(4)其他:有的質(zhì)量標(biāo)準(zhǔn)限度的確定,還要考慮到一些臨床數(shù)據(jù)和生物利用度數(shù)據(jù)。如某一緩控釋制劑應(yīng)如何確定合適的標(biāo)準(zhǔn)范圍。
因此,制訂一個(gè)藥物的質(zhì)量標(biāo)準(zhǔn)時(shí),應(yīng)當(dāng)明確哪些項(xiàng)目是該做的,哪些是不該做的,哪些是頻率性檢測(cè),并且應(yīng)理解為什么要做,以便于確定究竟哪些項(xiàng)目應(yīng)當(dāng)列入最終申報(bào)的質(zhì)量標(biāo)準(zhǔn)中。
綜上,可以用圖3來(lái)表達(dá)質(zhì)量標(biāo)準(zhǔn)限度的確定。
5? 有效期的評(píng)估
有效期是藥品在儲(chǔ)存及銷售期間的一項(xiàng)重要指標(biāo),有效期的長(zhǎng)短,除了影響藥品貨架期內(nèi)的安全性和有效性,還影響制藥企業(yè)的銷售及公眾用藥的便利性。因此,制定合理的有效期,對(duì)于藥品來(lái)說(shuō)是至關(guān)重要的[5]。
在原料藥或制劑的復(fù)檢期/有效期的評(píng)估工作中,可以借鑒ICH Q1E數(shù)據(jù)評(píng)估的決策樹(shù)(見(jiàn)圖4),冷凍制劑除外。當(dāng)我們理解了這個(gè)決策樹(shù),就能夠清楚在藥物的質(zhì)量研究過(guò)程中,如何使用和分析穩(wěn)定性數(shù)據(jù)來(lái)合理的推測(cè)藥物的有效期/復(fù)檢期[6]。
其中,Y=預(yù)定的復(fù)檢期或有效期;X=長(zhǎng)期數(shù)據(jù)所覆蓋的時(shí)間長(zhǎng)度。
我們需要明確的是變化與變異的不同,也應(yīng)當(dāng)分析實(shí)驗(yàn)數(shù)據(jù)究竟是數(shù)據(jù)的變動(dòng),還是反應(yīng)系統(tǒng)的變異。當(dāng)無(wú)法評(píng)判或沒(méi)有證據(jù)說(shuō)明數(shù)據(jù)的波動(dòng)是工藝變異造成時(shí),只能考慮是分析方法的變異。
對(duì)于一個(gè)新品種產(chǎn)品或一項(xiàng)仿制藥產(chǎn)品,可以基于良好的穩(wěn)定性數(shù)據(jù),初步建立適當(dāng)?shù)挠行冢捎谀承┮蛩兀贫ㄓ行诘闹С中詳?shù)據(jù)并不能完全覆蓋整個(gè)有效期的時(shí)間區(qū),因此,還可以在上市后的持續(xù)穩(wěn)定性研究期間,繼續(xù)延長(zhǎng)穩(wěn)定性研究的時(shí)間,當(dāng)積累一定數(shù)據(jù)后,仍然可以申請(qǐng)延長(zhǎng)有效期。
以上針對(duì)質(zhì)量標(biāo)準(zhǔn)的建立及有效期的評(píng)估,本文只做了淺顯的歸納,旨在拋磚引玉,重在呼吁制藥人員在藥物質(zhì)量標(biāo)準(zhǔn)制定的過(guò)程中,應(yīng)慎重考慮多方面因素。
參考文獻(xiàn)
[1] 叢鑫.藥品質(zhì)量標(biāo)準(zhǔn)中的安全性檢查進(jìn)展分析[J].智慧健康,2019,5(24):28-29.
[2] 廉克普.對(duì)藥品質(zhì)量控制與質(zhì)量標(biāo)準(zhǔn)的分析[J].健康之路,2017,16(10):210.
[3] 蘇凱.QL制藥公司藥品質(zhì)量管理優(yōu)化[D].濟(jì)南:山東師范大學(xué),2020.
[4] 謝炳全.DX公司質(zhì)量管理體系改進(jìn)研究[D].南昌:江西財(cái)經(jīng)大學(xué),2019.
[5] 鄒玉梅.藥品生產(chǎn)企業(yè)質(zhì)量管理體系現(xiàn)狀分析及改進(jìn)思路[J].中國(guó)新技術(shù)新產(chǎn)品,2019(19):107-108.
[6] 董汶橋.過(guò)程管控為核心的制藥工程質(zhì)量控制途徑[J].中國(guó)市場(chǎng),2020(33):90-91.

