普通高中化學課程中“σ鍵與π鍵”的教材分析及教學建議
儲開桂
摘要:“σ鍵與π鍵”是高中化學《物質結構與性質》模塊部分的重要內容,通過對不同版本教材中相關內容的對比分析,提出適當?shù)慕虒W建議。
關鍵詞:共價鍵;σ鍵與π鍵;教材分析;教學建議
文章編號:1008-0546(2020)03-0081-03
中圖分類號:G632.41
文獻標識碼:B
doi: 10.3969/j.issn.1008-0546.2020.03.022
一、課程標準中“σ鍵與π鍵”的教學要求
《普通高中化學課程標準(實驗)》和《普通高中化學課程標準(2017年版)》都對高中學生學習共價鍵有明確的要求:認識原子間通過原子軌道重疊形成共價鍵,知道根據(jù)原子軌道重疊方式,共價鍵可以分為“σ鍵與π鍵”等類型。從共價鍵鍵參數(shù)(鍵能、鍵長、鍵角)描述鍵的強弱和分子的空間結構。學好“σ鍵與π鍵”有助于學生認識和理解共價鍵的特征和本質,也是學生后續(xù)學習《物質結構與性質》和《有機化學基礎》兩個模塊知識的必備學科基礎知識。
二、“σ鍵與π鍵”的教材分析
《物質結構與性質》模塊中大部分學習內容比較抽象,旨在讓學生體會物質構成的奧秘,并用所學物質結構的知識增強一些解決化學問題的能力。現(xiàn)行高中教材江蘇鳳凰教育出版社(以下簡稱蘇教版)和人民教育出版社(以下簡稱人教版)圍繞“σ鍵與π鍵”的編排精選案例、采用豐富生動的圖像呈現(xiàn)“σ鍵與π鍵”的形成過程、選擇不同層次的問題解決內容幫助學生理解和掌握“σ鍵與π鍵”,但兩本教材呈現(xiàn)方式上有明顯差異,中學化學教師在教學過程中應根據(jù)學生已有的認知水平靈活處理教材,“用好”高中化學教材而不是“教好”高中化學教材。
1.蘇教版教材中“σ鍵與π鍵”的編排特點
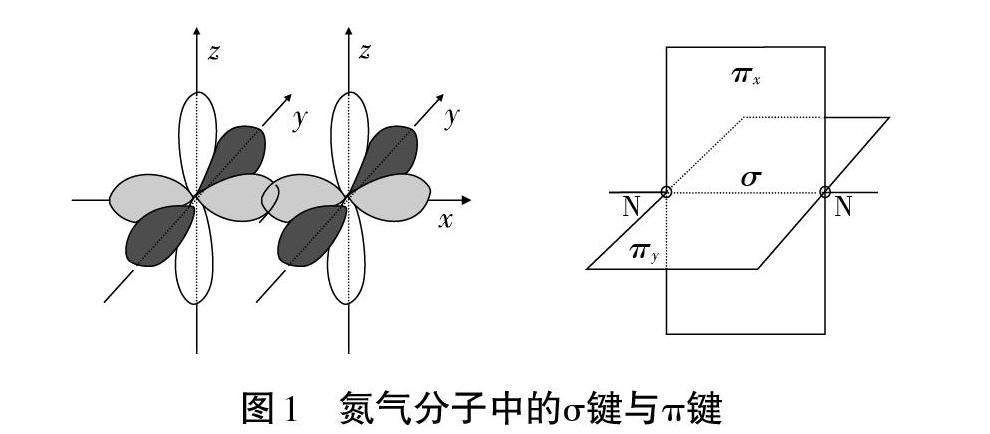
蘇教版教材在介紹“σ鍵與π鍵”概念時選擇的例子是氮氣分子。其優(yōu)點在于氮氣分子是一個典型的既含有σ又含有π鍵的分子,同時基于學生對氮原子的原子軌道及原子核外電子排布已經(jīng)有了充分的認識和理解,在教學過程中借助于氮氣分子的結構模型,引導學生分析和發(fā)現(xiàn)氮原子結合成分子的過程,很容易理解原子軌道重疊方式的不同(“頭碰頭”、“肩并肩”)會形成兩種不同的類型的化學鍵即“σ鍵與π鍵”。
教材在介紹“σ鍵與π鍵”概念及差異的基礎上設置了“問題解決”,引導學生運用“σ鍵與π鍵”的有關知識,從結構的角度深入討論在必修2中所學的乙烷、乙烯和乙炔分子中的化學鍵的成鍵情況,讓學生學會從“σ鍵與π鍵”的穩(wěn)定性差異的角度分析乙烷、乙烯和乙炔三種物質特征反應的差異,與必修2學過的知識相關聯(lián)。
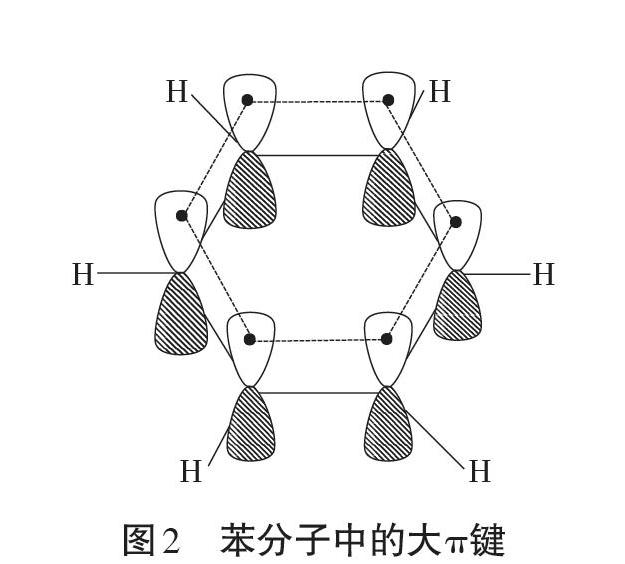
教材最后在“拓展視野”欄目中選擇了苯,分析了苯分子中的σ鍵與大π鍵,一方面是對必修2教材中苯分子結構和性質的呼應,讓學生逐步形成結構決定性質的化學學科思想;另一方面是對π鍵相關知識的延伸(離域π鍵),為后面的學習打好鋪墊。
雖然蘇教版教材在介紹“σ鍵與π鍵”概念時選擇了典型的例子氮氣分子,但也正是這個典型的例子給學生的學習帶來了困惑。困惑在于學生很難理解同樣都存在π鍵,為什么乙烯、乙炔中的π鍵不牢固而氮氣分子中的π鍵反而特別穩(wěn)定,教材上對此差異并未提供很好的解釋和說明,不利于學生的認知發(fā)展。
2.人教版教材中“σ鍵與π鍵”編排特點
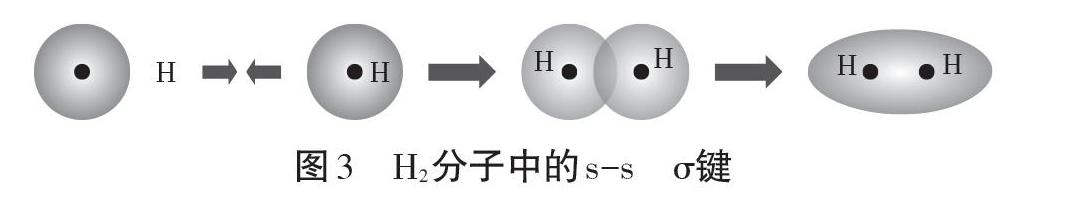
人教版教材在介紹“σ鍵與π鍵”概念時更加著重基礎,循序漸進引導學生學習。先從最簡單的H2分子人手,從1s軌道與1s軌道的重疊過程分析得出σ鍵的特征(軸對稱)。σ鍵可以繞兩原子核連線為軸自由旋轉。
然后再以學生熟悉的HCl分子和Cl2分子為例介紹了s-pσ鍵和p-pσ鍵的形成,這樣有充足的例子讓學生更充分認識σ鍵的形成,加深對通過原子軌道重疊形成化學鍵本質的認識。
在介紹p-pσ鍵形成的基礎上引入了p電子與p電子除了以“頭碰頭”的形式成鍵還可以以“肩并肩”的形式成鍵即π鍵。通過圖像對比了“σ鍵與π鍵”的差別,π鍵不能繞原子核連線自由旋轉,π鍵的特征表現(xiàn)為“鏡像對稱”。
從原子軌道重疊程度不同分析得出π鍵不如σ鍵牢固,比較容易斷裂。教材同樣以乙烷乙烯為例,從化學鍵形成的不同角度說明它們性質的差異。從正文內容的編排角度,人教版的編排更符合學生的認知規(guī)律,學生更容易理解和接受。
與蘇教版教材的設置相比,人教版教材對于氮氣分子中氮氮三鍵的處理更合理一些。首先是教材是在介紹了“σ鍵與π鍵”的概念和特征之后讓學生嘗試去分析氮氣中的成鍵情況,這更符合學生的認知規(guī)律,也有利于學生鞏固對該節(jié)知識的掌握和應用,問題的設置并沒有要求學生去探討氮氣分子中“σ鍵與π鍵”的穩(wěn)定性差異,在普通高中的學習過程中讓學生了解氮氮三鍵的牢固性比了解“σ鍵與π鍵”的穩(wěn)定性差異更有價值和教學意義。值得肯定的是,為了化解學生的困惑,人教版教材在課后習題P36第5題中通過給出N-N、N=N、N=N鍵能之比為1:2.17:4.90,而C-C、C=C、C≡C鍵能之比為1:1.77:2.34,引導學生得出氮氣穩(wěn)定而碳碳雙鍵和碳碳三建不穩(wěn)定的結論。這種基于數(shù)據(jù)證據(jù)的結論獲取正是新課程所提倡的教學目標導向,也能幫助學生消除這個部分學習可能產(chǎn)生的疑慮,巧妙回避了“σ鍵與π鍵”誰更穩(wěn)定的問題。
三、教學建議
基于中學化學的教學要求,需要讓學生弄清“σ鍵與π鍵”的差異源于原子軌道的重疊方式的差異,在這個方面選取氮氣還是氯氣并無本質區(qū)別,但如若要求從化學鍵形成的本質差異去分析“σ鍵與π鍵”的穩(wěn)定性要注意選擇不同的例子會帶來截然不同的教學效果。當然作為教師自身,應該嘗試理清這其中的差異。一線教師需要搞清“σ鍵與π鍵”的穩(wěn)定性是有復雜性的。
σ鍵的成鍵方式為電子云“頭碰頭”重疊,π鍵的成鍵方式為電子云“肩并肩”重疊。從價鍵理論的角度,共價鍵的強度與鍵能及鍵長有關,共價鍵鍵長越短,鍵能越大。例如,碳碳單鍵的鍵能為356kj/mol,碳碳雙鍵的鍵能為615kj/mol,由此可推出碳碳σ鍵鍵能為356kj/mol,碳碳π鍵鍵能為259kj/mol。通常情況,“頭碰頭”相比“肩并肩”電子云具有更好的重疊,因此碳碳σ鍵比碳碳π鍵更穩(wěn)定。這一結論也與碳碳共價鍵鍵能的實驗測定結果相符合。
然而,從“乙烯及乙烷分別通人溴水,乙烯可以使溴水變色”說明碳碳σ鍵比碳碳π鍵更穩(wěn)定是不全面的。反例:光照條件下乙烯與乙烷分別與溴蒸汽混合,乙烷體系中可檢測到一溴甲烷這一碳碳σ鍵斷裂的產(chǎn)物,而乙烯體系中很難檢測到1,2一二溴乙烷這一碳碳π鍵斷裂的產(chǎn)物。通過相同的邏輯得出“碳碳σ鍵不如碳碳π鍵穩(wěn)定”這一結論顯然是矛盾的。其原因在于“共價鍵的強度”為熱力學概念,而化學反應的發(fā)生為熱力學與動力學共同作用的結果。水溶液這一反應條件更有利于乙烯的親電加成反應,光照這一條件更有利于乙烷的自由基反應。因此,化學反應的發(fā)生與否與共價鍵的強度并無直接關系。只有特殊情況下,才能通過化學反應判斷共價鍵的強度,例如由于氫鹵共價鍵強度的遞減,相同濃度HCl、HBr、HI水溶液的酸性遞增(HF水溶液存在分子間氫鍵不在此討論)。
碳碳σ鍵比碳碳π鍵更穩(wěn)定,然而,σ鍵并不始終比π鍵更穩(wěn)定。例如,氮氮單鍵的鍵能為159kj/mol,氮氮雙鍵的鍵能為419kj/mol。由此可得,氮氮σ鍵的鍵能為159kj/mol,氮氮π鍵的鍵能為260kJ/mol。這一現(xiàn)象的解釋需要通過分子軌道理論,兩個氮原子原子軌道線性組合構成氮氣分子的分子軌道。隨后通過對其分子軌道能量進行計算可得氮氣分子能級圖如圖6。每個氮原子的2p軌道上各有3個成單電子,6個2p軌道組合形成3個成鍵軌道和3個反鍵軌道,其中兩個π2p成鍵軌道的能量要比σ2p成鍵軌道的能量低,所以在氮氣分子中的π2p鍵反而比σ2p鍵更穩(wěn)定。用分子軌道理論分析氮分子還可以發(fā)現(xiàn)其2p軌道上的電子全部填充在成鍵軌道上,這也更好地解釋了氮氣的穩(wěn)定性。
通過對教材的對比分析,期望能對廣大同行的教學起到一點幫助,也希望中學教科書的編寫專家能多采納廣大一線教師的建議,為更好地開展中學化學教學而共同努力。
參考文獻
[1] 曹錫章,宋天佑,王杏喬.無機化學(第三版)[M].北京:高等教育出版社,177,2003
[2]人民教育出版社.普通高中課程標準實驗教科書選修3[M].北京:人民教育出版社,2009
[3]王祖浩,普通高中課程標準實驗教科書(物質結構與性質)[M].南京:江蘇鳳凰教育出版社,2006
[4] 中華人民共和國教育部制訂.普通高中化學課程標準(實驗稿),人民教育出版社,2003
[5] 中華人民共和國教育部制訂.普通高中化學課程標準(2017版),人民教育出版社,2018

