淺談控制化學實驗溫度的方法
摘 要:溫度的控制是實驗條件控制的重要內容,是高考化學實驗考查的重點。通過選擇不同的熱源、升溫方式和降溫方式來控制實驗溫度。系統分析受溫度影響的物質熔點、沸點、溶解度、穩定性和具體化學反應的特點,從儀器的選擇、物質的分離、防分解、催化劑的活性、反應速率、反應的選擇性、反應方向和限度等綜合考慮來選擇適宜的溫度,最后根據所需的溫度選擇適合的熱源和加熱或冷卻方式。
關鍵詞:控制;化學實驗;溫度
化學是一門以實驗為基礎的自然學科,有效控制實驗條件是實驗成功的關鍵,也是高考考查的重點。考試大綱中明確要求學生“要能根據化學實驗的目的和要求,能做到掌握控制實驗條件的方法”。溫度的控制是實驗條件控制的重要內容。本文結合高中化學實驗內容及歷年高考題中有關溫度控制的考察內容,例談控制化學實驗溫度的方法。
化學實驗中溫度的控制涉及如何控制溫度和為什么要控制溫度兩個問題。
一、 如何控制溫度
(一)實驗室常見的熱源
1. 酒精燈:直接加熱溫度可達400-600℃,不穩定。
2. 酒精噴燈:直接加熱溫度可達1000℃以上,不穩定。
3. 電熱套:①溫度恒定,可調節;②受熱均勻;③升溫快,操作簡單。
(二)加熱升溫的方式
1. 直接加熱:利用酒精燈、酒精噴燈和電熱套等熱源直接加熱,常見可直接加熱的儀器有:試管、蒸發皿、坩堝、燃燒匙、硬質玻璃管等。
2. 間接受熱:隔石棉網加熱。常見只能間接受熱的儀器有:燒杯、錐形瓶、燒瓶(含蒸餾燒瓶和三頸燒瓶)等。
3. 通過介質間接加熱:如水浴(0-100℃)、油浴(100-260℃)、砂浴(400-600℃)、鉛浴(350-1740℃)等,特點是受熱均勻,便于控制溫度,不同的介質可以獲得不同的上限溫度。實驗中產生易燃易爆氣體或有易燃易揮發有機物參加反應,不宜用明火加熱時,也常通過水浴加熱,以防爆炸或失火。
(三)冷卻降溫方式
1. 空氣冷凝:有豎直的長玻璃導管和空氣冷凝管兩種,用于沸點較高物質的冷凝和回流。如硝基苯、乙酸乙酯、酚醛樹脂制取實驗中的玻璃導管。
2. 通水冷凝管冷凝:冷凝管有直形、球形、蛇形三種,冷卻效果比空氣冷卻好。直形冷凝管常用于蒸餾裝置,球形冷凝管常用于回流裝置,蛇形冷凝管的冷凝效果最好,用于有機制備的回流,適用于沸點較低的液體。
3. 冰(鹽)水冷凝:①將冰(鹽)水放在大燒杯或水槽中。待冷卻的物質放在U形管、錐形瓶、試管或燒瓶中。
②如果需要更低溫度冷卻,可以將冰水(0℃)換成冰鹽水。如22.4%氯化鈉冰鹽水的溫度為
-21.2℃,29.9%氯化鈣冰鹽水的溫度為-55℃。
③要了解常見易液化氣體的熔沸點。常用冷凝的方式分離氣體混合物。如除去SO2中的SO3,NO中的NO2可以采取冰水冷凝的方式。
SO3(熔點:16.8℃,沸點:44.8℃)
Cl2(熔點:-101℃,沸點:-34℃)
NH3(熔點:-77.75℃,沸點:-33.5℃)
NO2(熔點:-11℃,沸點:21℃)
二、 為什么要控制溫度
為什么要控制溫度?要回答這個問題,就要弄清楚哪些化學實驗受溫度影響。在化學實驗中受溫度影響的有:物質熔點、沸點、溶解度和穩定性,化學反應的速率、方向、限度和反應的選擇性、催化劑的活性等。
(一)溫度影響物質熔點、沸點、溶解度和穩定性
1. 物質的熔點、沸點影響物質的存在狀態,物質的存在狀態影響實驗原理、實驗裝置的選擇,還影響物質分離方法的選擇。
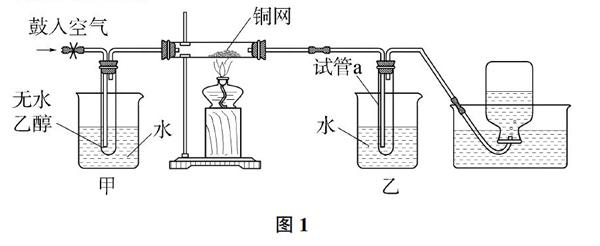
例題1 某實驗小組用下列裝置進行乙醇催化氧化的實驗。
(1)甲和乙兩個水浴裝置的作用不同。
甲的作用是_______;乙的作用是_______。
(2)反應進行一段時間后,干燥試管a中能收集到不同的物質,它們是_______。集氣瓶中收集到的氣體的主要成分是_______。
解析:甲是熱水浴,利用乙醇沸點低(77.5℃),易揮發。所以甲的作用是使乙醇揮發;乙是冷水浴,利用乙醇、乙醛和水的沸點高,容易冷凝,氮氣沸點低,不易冷凝。所以乙的作用是冷凝,a中收集到的物質是乙醇、乙醛和水,集氣瓶中收集到的氣體的主要成分是氮氣。
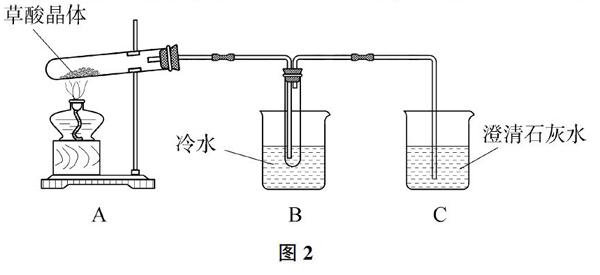
例題2 (2015新課標Ⅰ卷)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的鈉鹽和鉀鹽易溶于水,而其鈣鹽難溶于水。草酸晶體(H2C2O4·2H2O)無色,熔點為101℃,易溶于水,受熱脫水、升華,170℃以上分解。回答下列問題:
甲組同學按照如圖所示的裝置,通過實驗檢驗草酸晶體的分解產物。裝置C中可觀察到的現象是_______,由此可知草酸晶體分解的產物中有_______。裝置B的主要作用是_______。
解析:通常,加熱固體物質的試管口要略微向下傾斜。由于草酸晶體(H2C2O4·2H2O)熔點為101℃,受熱分解溫度170℃以上,分解前已熔化,所以裝置A中試管口向上傾斜,這就是物質的存在狀態影響了裝置的選擇。由于草酸晶體受熱脫水、升華,鈣鹽難溶于水,裝置B的作用是冷凝(水蒸氣、草酸等),避免草酸進入裝置C反應生成沉淀,干擾CO2的檢驗。
2. 溫度影響物質溶解度
氣體物質:溫度越高,溶解度越小。如實驗中所用蒸餾水煮沸后迅速冷卻,目的是去除水中溶解氧。
固體物質:一般,溫度越高,溶解度越大。一般采取:
①加熱攪拌的方式加速固體物質的溶解。
②結晶、重結晶、乘熱過濾等方式分離溶解度不同和溶解度受溫度影響不同的物質。
③不同溫度和結晶方式對形成晶粒大小有影響。
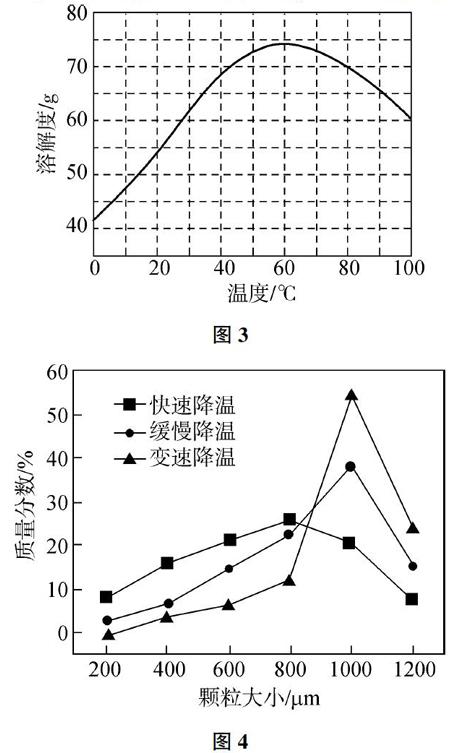
例題3 (2018年浙江節選)ZnSO4的溶解度(物質在100g水中溶解的質量)隨溫度變化曲線如圖3。
請回答:
(1)ZnSO4溶液要得到粗ZnSO4·7H2O晶體,需要用到下列所有操作:a. 蒸發至溶液出現晶膜,停止加熱;b. 在60℃蒸發溶劑;c. 冷卻至室溫;d. 在100℃蒸發溶劑;e. 過濾。請給出上述操作的正確順序_______(操作可重復使用)。
(2)某同學采用不同降溫方式進行冷卻結晶,測得ZnSO4·7H2O晶體顆粒大小分布如圖4所示。根據該實驗結果,為了得到顆粒大小相對均一的較大晶粒,宜選擇_______方式進行冷卻結晶。
A. 快速降溫B. 緩慢降溫C. 變速降溫
解析:根據圖3,先高溫蒸發大量的溶劑,至液面出現晶膜,再低溫結晶,將濾液在100℃蒸發溶劑,蒸發至溶液出現晶膜,在60℃蒸發溶劑,蒸發至溶液出現晶膜,冷卻至室溫,過濾得到粗ZnSO4·7H2O。故(1)答案為:dabace;根據圖4,獲得顆粒相對較大晶粒(1000pm),變速降溫的質量分數最高。故(2)答案為C。
3. 溫度影響物質的穩定性:防分解
常見受熱易分解的物質:
①鹽:碳酸氫鹽:碳酸氫鈣、碳酸氫鈉……,銨鹽:如碳酸氫銨、氯化銨,硝酸鹽:如硝酸鉀,硝酸銅;
②酸:如硝酸、原硅酸、硅酸;
③弱堿:如氫氧化銅、氫氧化鋁、一水合氨;
④氣體:臭氧、碘化氫、硫化氫;
⑤其他:如過氧化氫。
例題4 (2016年全國Ⅱ卷節選)過氧化鈣的制備
步驟③需要在冰浴下進行,原因是______________。
解析:步驟③的反應物氨水、雙氧水和生成物過氧化鈣都是受熱易分解的物質。所以,原因是降低溫度,防止反應物雙氧水和生成物過氧化鈣的分解。
(二)溫度影響化學反應的速率、限度和反應的選擇性
1. 使反應發生;
2. 溫度影響催化劑的活性:使催化劑活性最高;
3. 溫度影響反應的選擇性:防止副反應的發生;
4. 溫度影響化學反應的速率:控制反應進行的進程,加快或減緩反應的速率;
5. 溫度影響反應進行的方向和限度:控制反應的方向,提高產率;
6. 溫度影響某些離子的水解:促進水解或防止水解。
總之,控制實驗溫度的目的是為了實現實驗的目的,所以,首先要系統分析反應體系各物質的熔點、沸點、溶解度、穩定性,然后根據反應特點,從催化劑的活性、反應的速率、反應的選擇性、反應的方向和限度綜合考慮來選擇適宜的溫度,最后根據所需的溫度選擇適合的熱源和加熱或冷卻的方式。
作者簡介:白金榮,云南省玉溪市,云南省玉溪市民族中學。

