化學概念建構模式的探索與實踐
吳慶生


摘要:結合案例闡釋了化學概念的建構模式與實踐過程。首先通過創設問題情境,在對宏觀現象的抽象提煉中生成概念,然后對概念進行微觀探析和符號表征,接著辨析和應用概念,最后將概念納人已有的知識結構。
關鍵詞:化學概念;概念建構模式;抽象;辨析;歸類
文章編號:1005-6629(2021)05-0036-04 中圖分類號:G633.8 文獻標識碼:B
化學概念是在化學科學發展過程中建立起來的,是化學現象和化學事實概括化和抽象化的思維形式,能夠反映同類事物的化學運動規律和本質屬性。化學概念是化學學科知識體系的骨架,在化學教學中處于基礎性和先導性位置。因此,準確地理解化學概念,不僅能夠統攝化學知識、完善知識結構,而且還能夠厘清化學問題的本質,有助于發展學生思維的嚴謹性和邏輯性。
在化學概念教學時,教師要實現“知識立意”向“素養立意”、“教授過程”向“學悟過程”的轉變。首先創設問題情境,在實例中生成概念,然后通過對概念的微觀探析和符號表征,讓概念“立”起來,接著對概念進行辨析和應用,以深度理解概念,最后將概念納入已有的知識結構中。學生在觀察、歸納、分析、研討和應用等活動過程中,水到渠成地生成概念,從而提升化學概念建構的邏輯性和有效性。
1創設典型實例
概念的引入切忌簡單地從概念到概念,而應該結合具體實例,宏觀、具體的實例容易被學生接受,還能夠激發學生的學習興趣。結合案例進行概念教學,有利于“從實例中來,到實例中去”。為了從實例中有效地抽象提煉概念,創設的實例要具備常見性、全面性、一致性和直觀性等特點。
1.1常見性
從學生熟悉的物質、反應或情境來創設問題,學生容易介入與共情,概括抽象概念也相對比較順暢。如果選取陌生的情境,學生認知和理解情境將比較費時費力,那么再抽象提煉概念就會存在一定的難度。
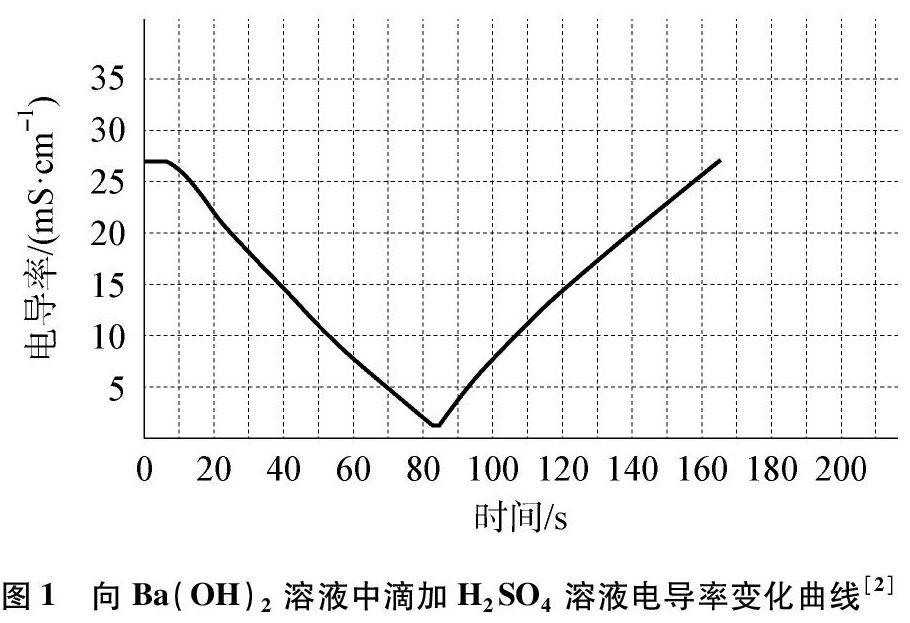
當然,有時為了增強實驗的趣味性和直觀性,也可以引入一些前沿的技術或情境,但考慮到學生的知識基礎和能力水平,要對預期的難點進行必要的鋪墊。比如,用電導率傳感器來測量Ba(OH)2溶液中滴加稀H2SO4時溶液導電性的變化,就要先介紹電導率傳感器定量測定溶液導電能力的功能,就像借助于燈泡發光來定性測量溶液導電能力一樣。
1.2全面性
為了用科學歸納法從實例中概括抽象出概念,選取的實例要盡可能全面,即概念涉及的種類都要列舉一個,這樣歸納、概括的方法才符合邏輯和科學。比如,鹽類水解實驗既要列舉強酸弱堿鹽(如NH4Cl),也要列舉強堿弱酸鹽(如Na2CO3)等。
1.3一致性
選取相近的物質或反應進行比對時,可以忽略次要因素的影響,有助于抓住問題的本質和關鍵。比如學習膠體概念時,可以列舉飽和FeCl3溶液、Fe(OH)3膠體和Fe(OH)3沉淀三組物質,并對其分別進行振蕩和激光筆照射實驗,很容易得出膠體與懸濁液的穩定性差異以及膠體與溶液不同的丁達爾效應。再由飽和FeCl3溶液制備Fe(OH)3膠體,以及將Fe(OH)3膠體繼續加熱發生聚沉得到Fe(OH)3沉淀,可以實現溶液、膠體和沉淀三種獨立的分散系的相互轉化。
1.4直觀性
形象、直觀的實例,更容易抽象提煉出概念。比如,借助于H2SO4和Ba(OH),的反應來抽象提煉離子反應的概念:向0.01mol/L Ba(OH)2溶液滴加3~5滴酚酞試液,然后向Ba(OH)2溶液中勻速逐滴加人0.2mol/L H2SO4溶液。
從曲線可以清晰地看到電導率的變化,直觀地顯示出溶液中離子濃度的變化情況,在氫氧化鋇與硫酸反應過程中,離子濃度不斷降低,電導率下降,之后氫氧化鋇反應完全,繼續滴加硫酸,離子濃度又相對增加,電導率又開始增大。這條電導率變化曲線實現了離子反應的可視化,讓學生“看到了”離子反應的微觀本質。
2概念的生成
2.1抽象提煉概念
對宏觀現象進行概括提煉概念的過程,實質上是直接經驗轉化為間接經驗的過程,也是實現知識內化的關鍵步驟。歸納概括通常采用“異處求同”的思維方法,通過抽象提煉,實現個體性質到類別通性的飛躍。
比如,通過NaCl、KNO3、蔗糖、酒精四種化合物分別在固體、水溶液以及熔融狀態下導電性對比實驗,可以抽象提煉出電解質與非電解質的概念。
2.2定義概念
概念的表述可以分為外延和內涵,概念的外延是指概念所能適用的范圍邊界,而內涵則是指概念所具有的含義,表示某種事物的特定屬性,是概念的本質特征。因此,定義概念需要從外延和內涵兩個方面進行界定。比如電解質的定義模型:
所以,電解質可定義為:在水溶液中或熔融狀態下能夠導電的化合物。
向學生介紹了概念的定義模型后,就可以引導學生直接去定義概念,這樣既有利于學生理解概念的豐富內涵,又有利于概念的內化與應用。
當然,隨著學習內容的深入,概念的內涵也在不斷地深化,比如氧化還原反應:
化合價升降(表觀特征)
電子轉移(本質特征)
3概念的微觀探析與符號表征
3.1概念的微觀探析
在對宏觀現象進行識別后,接著要對產生宏觀現象的原因進行微觀分析,這樣既有利于理解概念的本質,同時又為概念的表征埋下伏筆。
比如,通過比較0.1 mol/L HCl溶液和0.1 mol/LCH3COOH溶液導電性差異,再微觀分析HCl溶液和CH3COOH溶液中粒子的種類,如圖2所示。
由圖中可以直接得出HCl完全電離,為強電解質;而CH3COOH不完全電離,為弱電解質。所以,相同溫度、相同濃度的HCl溶液和CH3COOH溶液相比,HCl溶液中離子濃度大,導電能力強;而CH3COOH溶液中離子濃度小,導電能力弱。
在化學概念教學中,借助于圖像、動畫、模型等感性教學素材,可以將原本看不見摸不著的內容生動形象地展現在學生面前,做到“微觀過程可視化”,增強了概念教學的趣味性和有效性。比如,引導學生利用粒子結構示意圖畫出NaCl、HCl的微觀形成過程,不僅降低了電子得失與電子偏移的理解難度,而且通過分析電子轉移與元素化合價升降的對應關系,還能直接得出氧化還原反應表觀特征(化合價升降)與本質特征(電子轉移)的相互關系。
3.2概念的符號表征
化學符號表征是溝通宏觀識別與微觀探析的中介和橋梁,是化學概念學科化的表現形式,是對宏觀現象和微觀信息的抽象和概括,它以簡練的形式表達了宏觀現象、微觀本質以及物質之間的數量關系。
比如,為了表征強電解質HCl和弱電解質CH3COOH的電離情況,可用電離方程式表示如下:
HCl完全電離,而CH3COOH則存在電離平衡,僅部分電離而已。
4概念的辨析
對化學概念進行多層面變式分析,可以排除概念中無關因素的干擾,有利于學生對概念本質的認識,能夠讓學生不斷地矯正、整合和重組相關知識,達到自我構建概念的目的。在概念的變式訓練中,通常是圍繞著概念的外延和內涵進行設計。比如,采用正誤判斷對電解質進行變式訓練:
①銅絲能導電,所以是電解質;
②NaCl溶液和鹽酸都能導電,所以是電解質;
③BaSO4難溶于水,其水溶液幾乎不導電,所以BaSO4不是電解質;
④NaCl是電解質,所以NaCl固體可以導電;
⑤CO2、NH3的水溶液能導電,所以NH3、CO2均是電解質。
題組①、②是針對電解質的外延;題組③~⑤則針對電解質的內涵。
學生在概念建構的起始階段,利用正向變式有利于學生對剛剛形成的概念進行初步強化;而在概念的后期鞏固階段,采用反向變式可以讓學生對概念的理解更加精確,能夠排除學生認知結構中無關屬性的干擾,實現對概念本質的精準辨析。
5概念的應用
學生建構概念之后,要通過課后練習來鞏固深化課堂上的理解,探索概念的適用邊界,建立學習內容與真實問題之間的聯系。
比如,離子反應的應用表現在離子方程式的書寫、離子共存的判斷,還有離子的推斷等,其中離子的推斷是離子反應、離子共存的綜合應用。例如:
下列結論正確的是
A.肯定含有的離子是①②⑥
B.該實驗無法確定是否含有③
C.可能含有的離子是①③
D.肯定沒有的離子是⑤⑦
6概念的歸類
任何一個化學概念都不是孤立存在的,而是與其他有關概念相互交織、共同作用而形成一個個概念群組。隨著教學內容的不斷深入,這些概念群組進而形成具有一定主題的知識結構和知識體系。
教師在進行概念教學時,不僅要了解新概念在知識結構中的位置,還要理解新概念的發展脈絡,這樣才能夠準確把握概念教學的深度和廣度。只有將新概念納入已有的概念群組中,才能夠建立完善的知識結構。比如,電解質可從兩個維度進行歸類:
比如,NaCl屬于化合物分類中的無機物、鹽、電解質和離子化合物。每一種物質都具有多種類別屬性,分類標準不同,所屬的類別也不同,當然也具備所屬類別的通性。
采用樹狀分類,可以直觀地理順新概念與已有概念的相互關系,形成知識結構和概念體系,同時,也進一步強化、豐富了概念的外延和內涵。

