基于真實情境的項目式復習
薛琴
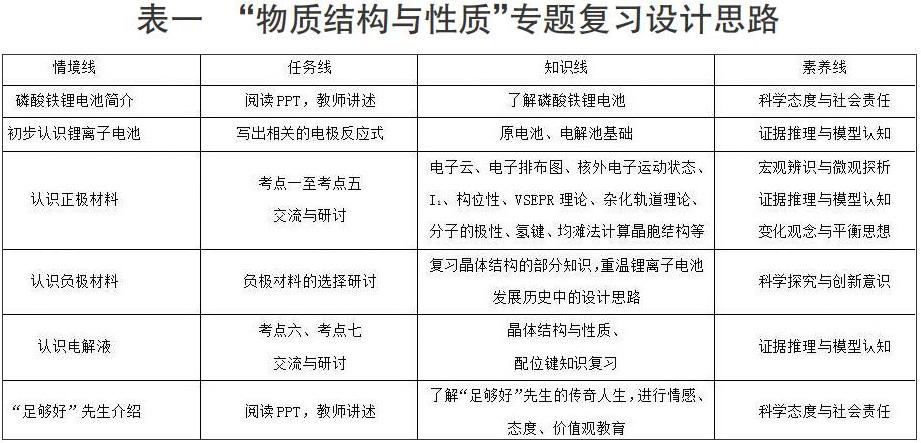
摘 要:本文以多維度探析磷酸鐵鋰結構為例,開展“物質結構與性質”專題復習。展示基于真實情境的項目式學習在中學化學教學中的應用,培養化學學科核心素養。
關鍵詞:項目式學習; 真實情境; 磷酸鐵鋰; 教學案例
中圖分類號:G633.8? ? ? ? 文獻標識碼:A? ? ? ? 文章編號:1006-3315(2021)5-020-002
《普通高中化學課程標準(2017年版)》指出要重視開展“素養為本”的教學。真實、具體的情境是學生化學學科核心素養形成和發展的重要平臺。化學學科核心素養一方面需要在真實問題情境下才能表現出來,另一方面也只有在分析和解決具體的真實情境問題時才能得到培養和發展。
項目式學習是一種以學生為中心,落實學生核心素養的重要教學方式。建構主義學習理論是項目式學習重要的理論基礎。學習者的學習是以他們自己的經驗為背景,基于已有的知識鑒別新知識,最后重新建構個人化知識。傳統的學習從學科概念出發,通過例題和練習鞏固概念,知識往往是碎片化和割裂的;基于真實情境的項目式學習強調從宏觀的視角辨析化學反應,從微觀的尺度進行探析,基于證據進行推理形成認知模型,在問題解決中形成嚴謹求實的科學態度。
一、設計思想
“物質結構與性質”(選修三)考點內容零碎,沒有如原子結構的發現化學史推理的邏輯線索。教師可以根據教學內容自己開發教學情境開展項目式復習,打破教材知識模塊界限,構建零碎知識之間的內在聯系,實現教學內容的有效整合。以磷酸鐵鋰電池為真實情境背景的試題在高考中多次出現。考查的內容涉及化學工業流程、電化學知識、物質結構與性質等,是項目式復習的好素材[1]。
本文以多維度探析磷酸鐵鋰電池結構開展“物質結構與性質”專題復習為例,以磷酸鐵鋰電池真實情境為載體,以任務為驅動、學生為主體,進行項目式復習。讓學生從多維度認識和探究磷酸鐵鋰電池,為學生后續復習提供可遷移的方法形成以點帶面的聯想式復習。教學中注重情境線、任務線(學生活動線)、知識線、核心素養線的有機整合,凸顯了基于真實情境的項目式化學教學特色。
二、教學過程
(一)課堂導入以及真實情境創設
2019年諾貝爾化學獎公布,瑞典斯德哥爾摩皇家科學院將這項榮譽授予了三名科學家,以表彰他們在鋰電池發展上做出的杰出貢獻。其中,97歲的約翰·古迪納夫(John B. Goodenough)更是刷新了獲獎年齡最大的紀錄。古迪納夫是鈷酸鋰、錳酸鋰和磷酸鐵鋰正極材料的發明人,鋰離子電池的奠基人之一。
(二)初步認識鋰離子電池(學生討論并完成學案)
【情境】鋰離子電池內部主要由正極、負極、電解質及隔膜組成。目前正極材料主要是鈷酸鋰(LiCoO2)、錳酸鋰(LiMn2O4)、鎳酸鋰(LiNiO2)。磷酸鐵鋰動力電池是用磷酸鐵鋰(LiFePO4)材料做電池正極的鋰離子電池,是鋰離子家族的新成員。這種電池具有能量密度高、安全性能好、原材料來源廣泛等優點。目前被廣泛應用于新能源汽車上。
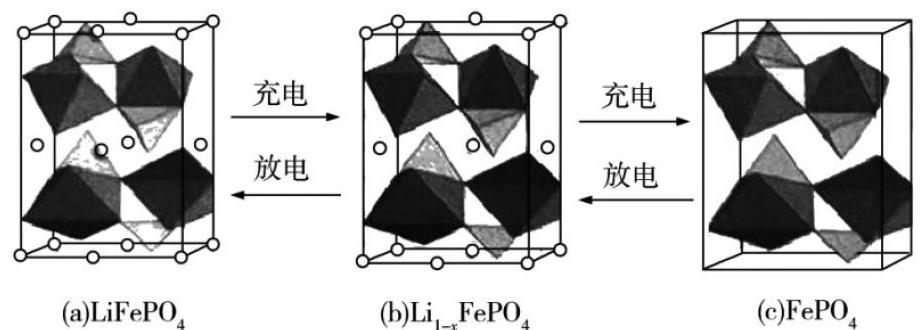
【任務】以鈦酸鋰和磷酸亞鐵鋰做電極組成電池,充電時發生的反應為Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 + Li1-xFePO4(0 【設計意圖】 通過初步認識鋰離子電池引入情境,回顧電化學基礎知識,進行思維熱身。提醒學生不要將知識割裂,要注重高三復習的整體性。 (三)認識正極材料(學生討論并完成學案) 【考點1】核外電子排布 (1)基態Li+的核外電子云輪廓圖的形狀怎樣?畫出基態Li原子的電子排布圖。 (2)基態Fe2+與Fe3+離子中未成對的電子數之比是多少?Fe3+比Fe2+穩定的原因是什么? (3)在周期表中,與Li的化學性質最相似的鄰族元素是什么?該元素基態原子核外M層電子的自旋狀態怎樣? 【考點2】第一電離能 給出Li及其周期表中相鄰元素的第一電離能數據,回答: (1)I1(Li)>I1(Na),原因是什么? (2)I1(Be)>I1(B)>I1(Li),原因是什么? 【考點3】立體構型、等電子體 (1)在正極材料磷酸鐵鋰中,磷酸根離子的空間構型是怎樣的?與磷酸根互為等電子體的分子有哪些?其中P的價層電子對數是多少?雜化軌道類型? (2)價層電子對的立體構型和分子的立體構型是一回事嗎?兩者有什么區別和聯系? 【考點4】鍵的極性、分子極性、氫鍵 PH3是_____鍵(填“極性”或“非極性”)形成的_____分子(填“極性”或“非極性”),其在水中的溶解性比NH3小,原因是什么? 【設計意圖】 以認識正極材料為情境線索將零碎知識點整合。其基本思路是以電子→原子→原子組合為主線,以任務驅動學生交流與研討,根據考點層層推進。復習原子結構相關理論、價層電子對互斥理論、雜化軌道理論、等電子體理論、氫鍵理論。能夠計算中心原子上的孤電子對數,并根據孤電子對數和σ鍵電子對數確定中心原子上的價層電子對數,推導VSEPR模型的空間構型和雜化軌道類型。能夠根據VSEPR理論確定分子的空間構型,理清鍵的極性和分子極性的關系。 【考點5】有關晶胞的計算(學生討論并完成學案) 【任務】(2020年新課標Ⅰ卷)LiFePO4的晶胞結構示意圖如(a)所示。其中O圍繞Fe和P分別形成正八面體和正四面體,它們通過共頂點、共棱形成空間鏈結構。每個晶胞中含有LiFePO4的單元數有____個。電池充電時,LiFeO4脫出部分Li+,形成Li1-xFePO4,結構示意圖如(b)所示,則x=_______,n(Fe2+)∶n(Fe3+)=_______。 【設計意圖】 整合空間想象力、化學信息、推理、分析圖像和計算的能力。特別復習“均攤法”的應用。 (四)認識負極材料(閱讀材料后開展討論) 【情境】鋰電池在充電過程中,Li+還原時形成樹枝狀金屬鋰。其在生長過程中會不斷消耗電解液并導致金屬鋰的不可逆沉積,造成低庫倫效率;同時,鋰枝晶的形成甚至還會刺穿隔膜導致鋰離子電池內部短接,造成電池熱失控繼而引發燃燒爆炸。如何利用鋰元素的優勢又克服鋰枝晶的弊端呢?關鍵在于尋找能夠承載Li+嵌入和脫嵌的正負極材料。 【任務】 投影石墨的層狀結構的球棍模型。給出數據:石墨中層與層的間距335pm、每層中兩個碳原子之間的鍵長142pm、Li+半徑60pm。回答: (1)在石墨層狀晶體結構中,層與層之間如何結合?每層中的相鄰碳原子之間如何結合? (2)從結構的角度解釋石墨具有良好導電性的原因。晶體中碳原子的雜化類型?石墨是否適合做負極材料? 學生經過討論發現:石墨中碳原子都是SP2雜化,雜化的碳原子與未參與雜化的P軌道上的電子形成大π鍵,從而使石墨具有優良的導電能力。另外基于石墨晶體層與層間距和Li+半徑大小的數據,十分適合Li+反復嵌入和脫出,可以考慮使用石墨作為負極材料[2]。 【設計意圖】 從宏觀辨識到微觀探析,復習晶體結構的部分知識。通過理論聯系實際應用,培養學生的科學探究與創新意識,樹立結構決定性質的思想。重溫鋰離子電池發展歷史中的設計思路,提升化學學科核心素養。 (五)認識電解液(學生討論并完成學案) 【考點6】晶體結構與性質 LiPF6在是鋰離子電池電解液的重要組成部分,一般采用PF5、LiF為原料制備。上述原料的熔點PF5和LiF熔點高低比較,比較依據是什么? 【考點7】配位鍵及其形成條件 LiPF6在有機溶劑中具有適中的解離常數,且能與正負極材料匹配,是目前使用最廣泛的鋰鹽。[PF6]-中P原子與F-形成配位鍵,不考慮空間構型,用示意圖表示[PF6]-的結構。[PF6]-中提供孤電子對的原子是什么?判斷依據? 【設計意圖】 證據推理與模型認知,復習晶體結構與性質、配位鍵知識。 (六)了解“足夠好”先生的傳奇人生 【設計意圖】 情感態度價值觀的教育不是空喊口號,而是潛移默化、潤物細無聲的。約翰·古迪納夫(John B. Goodenough),“足夠好”先生30歲才入行,58歲時提出了鈷酸鋰,75歲時提出了磷酸鐵鋰,94歲時研制出全固態電池,97歲獲得諾貝爾化學獎,至今仍然在全固態電池的研究工作一線。有人說他的研究已經足夠好了,但是他卻不這么認為。生命不息,奮斗不止。看完這位老爺子的故事,我只有一個想法:我們年輕人,還有什么理由不努力! 三、教學反思 1.復習課若局限于對已學知識的簡單重復和再現,用碎片化的知識去思考和解決問題,就容易忽略知識體系的完整性,會導致思考不夠深刻。項目式復習,打破了原有知識的孤立性和零散性,有如一條線索,將一顆顆知識的珍珠串起。通過圍繞一個主題講述故事,開展研究,不僅促使學生對所學知識融會貫通,拓展了復習的深度和廣度,而且激發了學生的學習興趣,進一步提高了他們的思維能力。 2.本節課從磷酸鐵鋰電池出發,以化學學科核心素養的培養為宗旨,圍繞相關內容的研究和討論,整合了物質結構與性質多個高考熱門考點,從多個維度進行教學,不僅落實了基礎知識,還把主動權交給學生,讓他們在真實情境的項目式學習中自主完成知識的構建。項目式學習注重核心知識的再建構,創建真實的驅動性問題,用高階學習包裹低階學習,將素養轉化為持續的學習實踐。 參考文獻: [1]單旭峰,宋修明.真實情境的高考化學命題理論與實踐[J]中學化學教學參考,2019(5):1-5 [2]江合佩.走向真實情境的項目化學習[M]濟南:山東科學技術出版社,2020.7:267-269

