慢性腎臟病患者的鐵代謝及治療
鮑美霜 王潔
【關(guān)鍵詞】 慢性腎臟病;鐵代謝;鐵調(diào)節(jié);腎性貧血;治療
中圖分類號(hào):R692 ? 文獻(xiàn)標(biāo)志碼:A ? DOI:10.3969/j.issn.1003-1383.2021.07.013
慢性腎臟病(chronic kidney disease,CKD)已成為威脅人類健康的世界難題,影響全世界超過10%的人口[1],貧血是慢性腎臟病最常見的并發(fā)癥,紅細(xì)胞生成素(EPO)的不足和鐵的缺乏是發(fā)生腎性貧血的兩大基石。重組人紅細(xì)胞生成素(recombinant human erythropoietin,rHuEPO)治療腎性貧血是有效的,然而,高劑量的rHuEPO可能增加患者死亡和心血管事件的風(fēng)險(xiǎn)。鐵對(duì)紅細(xì)胞生成至關(guān)重要,缺鐵性貧血是磷酸性激素成纖維細(xì)胞生長(zhǎng)因子23(FGF23)的有效刺激劑,貧血可刺激人類骨骼中FGF23 mRNA的產(chǎn)生,而FGF23升高與CKD患者死亡的概率增加了6倍以上有關(guān),CKD患者的鐵利用率管理可能會(huì)轉(zhuǎn)化為礦物質(zhì)代謝的可調(diào)節(jié)結(jié)果[2]。流行病學(xué)及臨床試驗(yàn)結(jié)果證實(shí),CKD患者體內(nèi)普遍存在鐵穩(wěn)態(tài)受損[3],了解鐵代謝異常對(duì)治療腎性貧血具有重要意義。
1 鐵的代謝
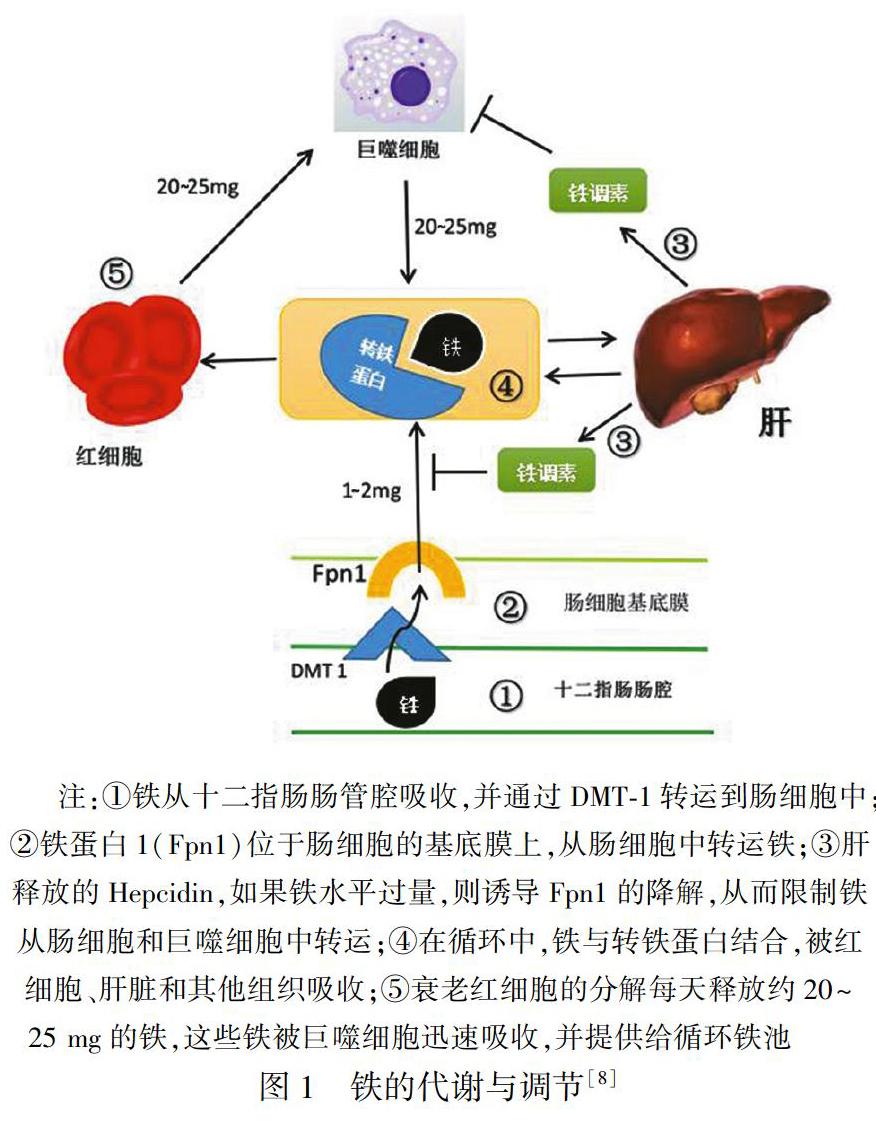
鐵是維持生命的重要微量元素,具有作為電子供體和電子受體的獨(dú)特能力,參與細(xì)胞呼吸、氧的運(yùn)輸和儲(chǔ)存以及能量代謝[4]。食物中的鐵主要以Fe2+的形式被十二指腸系膜細(xì)胞吸收,并受在腸上皮細(xì)胞頂端膜刷狀緣表達(dá)的二價(jià)金屬轉(zhuǎn)運(yùn)子1(divalent metal transporter 1,DMT1)介導(dǎo)[5]。吸收入胞的鐵可直接用于固有的細(xì)胞代謝,大多數(shù)鐵被輸送到骨髓中用于紅細(xì)胞的產(chǎn)生,較少的鐵被輸送到其他組織進(jìn)行基本的細(xì)胞代謝過程,多余的鐵則被輸送到肝臟儲(chǔ)存[6]。儲(chǔ)存在細(xì)胞質(zhì)內(nèi)的Fe2+受機(jī)體調(diào)節(jié)釋放入血,被銅藍(lán)蛋白氧化后與轉(zhuǎn)鐵蛋白結(jié)合,運(yùn)輸?shù)浇M織各個(gè)細(xì)胞中被利用,鐵的吸收與調(diào)節(jié)如圖1。十二指腸上皮細(xì)胞的刷狀緣大量表達(dá)血紅素載體蛋白1(heme carrier protein,HCP1),介導(dǎo)腸細(xì)胞對(duì)血紅素的吸收。CKD患者的鐵代謝與正常人相仿,但由于食欲欠佳、腸吸收功能不良、反復(fù)失血以及因eGFR下降、微炎癥狀態(tài)、鐵調(diào)素(hepcidin,Hepc)、透析材料的不相容性等,CKD患者普遍存在不同程度的鐵缺乏及鐵代謝異常。
2 鐵的調(diào)節(jié)
鐵的調(diào)節(jié)主要通過調(diào)節(jié)吸收來完成,目前認(rèn)為,EPO、慢性炎癥、缺氧誘導(dǎo)因子(HIF)等多種因素參與鐵調(diào)節(jié)過程,但鐵調(diào)素是調(diào)控鐵穩(wěn)態(tài)的主要調(diào)節(jié)因子[7]。
2.1 鐵調(diào)素與鐵代謝
Hepc是2000年發(fā)現(xiàn)的一種由肝臟合成并分泌的富含有半胱氨酸的抗菌多肽,其通過減少小腸對(duì)鐵的吸收,抑制鐵貯存細(xì)胞(如肝細(xì)胞、腸細(xì)胞、巨噬細(xì)胞)的鐵外排,導(dǎo)致鐵與鐵蛋白結(jié)合的積累,負(fù)性調(diào)節(jié)鐵代謝平衡[9],在鐵的代謝中起到關(guān)鍵調(diào)控作用。鐵調(diào)素可抑制腸道鐵吸收,出現(xiàn)循環(huán)鐵降低、單核巨噬細(xì)胞內(nèi)鐵增加,而低水平的鐵調(diào)素可促進(jìn)單核巨噬細(xì)胞釋放鐵。Hepc水平隨CKD的嚴(yán)重程度逐漸增加,透析前CKD患者升高2~4倍,透析患者Hepc增加6~9倍。Hepc的表達(dá)受鐵負(fù)荷和炎癥刺激的影響,貧血、缺氧和EPO可抑制其生成[10~11]。鐵主要是通過激活BMP6-HJV-SMAD信號(hào)通路刺激Hepc表達(dá)。肝細(xì)胞感知到鐵儲(chǔ)存后,肝臟就會(huì)產(chǎn)生骨形態(tài)發(fā)生蛋白(BMP)-6,并通過BMP/小母細(xì)胞對(duì)抗鐵血紅蛋白(SMAD)介導(dǎo)的信號(hào)通路上調(diào)鐵調(diào)素[3]。鐵轉(zhuǎn)運(yùn)蛋白的表達(dá)對(duì)鐵進(jìn)入體循環(huán)至關(guān)重要,鐵調(diào)素與鐵轉(zhuǎn)運(yùn)蛋白結(jié)合,導(dǎo)致復(fù)合物內(nèi)在化和降解,有效減少鐵從巨噬細(xì)胞釋放并防止十二指腸鐵吸收。SUN等人[12]開發(fā)的改良腺嘌呤誘導(dǎo)腎臟疾病模型發(fā)現(xiàn),經(jīng)腺嘌呤處理的大鼠中LDN-193189(以前被證明能降低嚙齒類動(dòng)物的Hepcidin水平)降低了肝臟Hepcidin mRNA的表達(dá),Hepcidin抑制劑可能提供一種新的治療策略,以提高CKD患者紅細(xì)胞生成的鐵的利用率。
2.2 EPO與鐵代謝
EPO作用于骨髓中的紅系造血祖細(xì)胞,可促進(jìn)紅細(xì)胞產(chǎn)生和鐵吸收[13]。動(dòng)物研究[14]發(fā)現(xiàn),rHuEPO治療以劑量依賴性方式誘導(dǎo)紅細(xì)胞生成并增加轉(zhuǎn)鐵蛋白飽和度,且在EPO的刺激下,紅細(xì)胞在生成過程中會(huì)分泌紅鐵酮,紅鐵酮的主要作用是抑制Hepc的生成,從而促進(jìn)腸道鐵的吸收和儲(chǔ)存鐵的釋放[15]。
2.3 炎癥與鐵代謝
隨著CKD的進(jìn)展,白細(xì)胞介素-6(IL-6)、C反應(yīng)蛋白(CRP)等炎性細(xì)胞因子水平增加。炎癥通過多種途徑[16],如IL-1β和IL-6通過JAK/STAT3途徑、內(nèi)質(zhì)網(wǎng)應(yīng)激通過SMAD1/5/8和CREB/CREBH激活鐵調(diào)素啟動(dòng)子活性等,增加鐵蛋白,上調(diào)鐵調(diào)素水平,抑制EPO的功能,從而導(dǎo)致血清低鐵血癥和組織高鐵蛋白血癥,降低了鐵的利用率,這是功能性缺鐵發(fā)生的基礎(chǔ)[3,17]。
2.4 低氧誘導(dǎo)因子與鐵代謝
低氧誘導(dǎo)因子-脯氨酰羥化酶抑制劑(HIF-PHI)是一種轉(zhuǎn)錄因子,由 HIFα和 HIFβ亞基組成,其通過增加蛋白裂解酶-2、EPO、EPO受體、DMT1、十二指腸細(xì)胞色素B(duodenal cytochrome B,DcytB)、轉(zhuǎn)錄基因(transcription factors,TF)、轉(zhuǎn)鐵蛋白受體(trans-ferrin receptor,TFR)的表達(dá)及阻斷BMP-6/SMAD信號(hào)通路等途徑促進(jìn)鐵的吸收、轉(zhuǎn)運(yùn)、釋放及利用[18]。體內(nèi)實(shí)驗(yàn)[19]表明,予HIF治療后,Hepc水平受抑制,TIBC顯著增加,血清鐵水平升高,HIF還可誘導(dǎo)轉(zhuǎn)鐵蛋白表達(dá),從而提高了鐵的利用率。
2.5 其他
成熟成纖維細(xì)胞分泌的生長(zhǎng)分化因子15(GDF-15)參與鐵調(diào)素的代謝,被鑒定為鐵調(diào)素抑制因子,因此可能間接參與鐵的代謝。有報(bào)道稱[20],中性粒細(xì)胞明膠酶相關(guān)脂質(zhì)運(yùn)載蛋白(NGAL)可能通過炎癥反應(yīng)參與鐵的調(diào)節(jié)和代謝。
3 腎性貧血的治療
直到上世紀(jì)80年代末,腎性貧血的糾正取決于輸血,但輸血本身具有傳播病毒和非病毒感染的風(fēng)險(xiǎn)。紅細(xì)胞生成刺激劑(ESAs)聯(lián)合鐵劑的治療是目前普遍采用的治療方法,ESAs如rHuEPO直接補(bǔ)充內(nèi)源性EPO的不足,但其低反應(yīng)性是治療腎性貧血的一重大難題,其中鐵缺乏是最常見的原因。低氧誘導(dǎo)因子作為一種新型治療藥物,將腎性貧血的治療帶入新的時(shí)代。
3.1 ESAs
腎性貧血的主要原因是腎間質(zhì)細(xì)胞產(chǎn)生EPO不足,ESAs以激活EPO受體的方式促進(jìn)骨髓紅系造血,第一代包括兩種短效rHuEPO(EPOα與EPOβ),是我國(guó)目前使用的ESAs治療藥物,第二、第三代尚未在我國(guó)上市。rHuEPO的治療可基本消除嚴(yán)重的貧血,但幾十年的臨床實(shí)際應(yīng)用中,rHuEPO已從小劑量治療嚴(yán)重貧血發(fā)展到大劑量治療輕、中度貧血,盡管增加劑量,仍有相當(dāng)一部分患者未達(dá)到國(guó)際指南建議的Hb指標(biāo),即Hb目標(biāo)值為110~120 g/L,建議≤130 g/L,EPO難治性貧血常見于腹膜透析患者(76.6%)[21],缺鐵是重要原因。有動(dòng)物實(shí)驗(yàn)[22]表明,rHuEPO的低反應(yīng)性與全身及腎臟炎癥狀態(tài)有關(guān),而近年來研究發(fā)現(xiàn)某些CKD患者的血清出現(xiàn)了EPO受體抗體,rHuEPO低反應(yīng)原因復(fù)雜,機(jī)制尚未完全明了,研究[23]表明,ESAs耐藥率較高與死亡率增加相關(guān)。
3.2 HIF
HIF的降解受HIF-脯氨酰羥化酶(HIF-PH)調(diào)節(jié),針對(duì)HIF-PH途徑的研究藥物為治療腎性貧血帶來了全新的選擇[24]。HIF可通過協(xié)同反應(yīng)刺激紅細(xì)胞生成,包括增加EPO產(chǎn)量、改善鐵代謝和鐵利用率,有效提升血紅蛋白[25~26]。羅沙司他(Roxadustat,F(xiàn)G-4592)作為全球首個(gè)HIF-PHI已率先完成Ⅲ期臨床試驗(yàn),并于2018年12月在我國(guó)率先上市治療腎性貧血,其Ⅳ期臨床試驗(yàn)仍在隨訪觀察。羅沙司他在治療CKD非透析貧血患者也有顯著療效[27],薈萃分析顯示[19,28],羅沙司他可有效提高CKD透析患者的Hb、血清轉(zhuǎn)鐵蛋白、腸道鐵的吸收,并降低鐵調(diào)素,療效優(yōu)于EPO,但其理論上的致癌風(fēng)險(xiǎn)和某些心血管安全問題仍需廣泛關(guān)注。
3.3 鐵劑
鐵是合成Hb的基本原料,予以充足的鐵補(bǔ)充,不僅可以明顯改善貧血,還可以減少rHuEPO的使用劑量,甚至有些患者不使用rHuEPO治療也能改善貧血,因此對(duì)CKD患者應(yīng)常規(guī)進(jìn)行鐵狀態(tài)的評(píng)價(jià),并根據(jù)鐵儲(chǔ)備狀況給予相應(yīng)的鐵劑治療。
3.3.1 鐵狀態(tài)的評(píng)價(jià)
目前常用鐵蛋白(SF)和轉(zhuǎn)鐵蛋白飽和度(TSAT)作為評(píng)價(jià)鐵狀態(tài)的指標(biāo),SF反映細(xì)胞內(nèi)的鐵濃度,TSAT為血清鐵與總鐵結(jié)合力的比值,反映鐵可利用水平。CKD患者既有絕對(duì)缺鐵,也有功能性缺鐵。絕對(duì)缺鐵是指鐵儲(chǔ)量嚴(yán)重減少或缺乏,而功能性缺鐵是指鐵儲(chǔ)量充足但可進(jìn)入紅樣前體的鐵儲(chǔ)量不足[4]。目前全世界對(duì)鐵缺乏的定義尚無統(tǒng)一標(biāo)準(zhǔn),國(guó)際專家組建議[29],絕對(duì)性缺鐵定義為SF<100 μg/L且TSAT<20%,功能性缺鐵為SF>100 μg/L且TSAT<20%。血清GDF-15是絕對(duì)性缺鐵性貧血(IDA)的潛在生物標(biāo)志物,而鐵調(diào)素水平可以預(yù)測(cè)CKD患者的功能性鐵缺乏[30]以及補(bǔ)鐵的有效性。過量的鐵可能通過破壞DNA、蛋白質(zhì)和脂質(zhì)膜促進(jìn)活性氧(ROS)的形成并導(dǎo)致氧化應(yīng)激,故了解鐵代謝情況顯得尤為重要。
3.3.2 鐵劑的治療
在CKD患者中,指南推薦,非透析貧血患者TSAT≤20%和(或)SF≤100 μg/L、腹膜透析貧血患者TSAT≤20%和(或)SF≤100 μg/L、血液透析貧血患者TSAT≤20%和(或)SF≤200 μg/L時(shí)需要補(bǔ)鐵。在進(jìn)行補(bǔ)鐵前均應(yīng)積極尋找缺鐵的原因并盡可能糾正,補(bǔ)鐵方式目前有口服和靜脈兩種給藥途徑,近年來又出現(xiàn)經(jīng)透析液補(bǔ)充途徑,但尚未普及。口服鐵劑有起效慢、胃腸道反應(yīng)大及患者依從性差等缺點(diǎn),靜脈補(bǔ)鐵效果優(yōu)于口服補(bǔ)鐵[31],而靜脈補(bǔ)鐵過敏反應(yīng)和低血壓發(fā)生率更高,故靜脈還是口服補(bǔ)鐵目前爭(zhēng)論頗多。以往認(rèn)為,靜脈補(bǔ)鐵可能會(huì)增加CKD患者感染風(fēng)險(xiǎn),氧化應(yīng)激,但越來越多的數(shù)據(jù)表明,CKD患者,特別是ESRD患者,積極合理的靜脈補(bǔ)充鐵劑有明顯療效,且與臨床上有意義的感染風(fēng)險(xiǎn)和心血管事件增加無關(guān)[32~33]。MACDOUGALL等人[34]對(duì)2141名CKD患者進(jìn)行盲點(diǎn)評(píng)估鐵劑治療試驗(yàn)表明,積極使用大劑量靜脈注射鐵劑的治療與低劑量相比,可顯著降低死亡或重大非致命性心血管事件的風(fēng)險(xiǎn),并減少rHuEPO的使用劑量。一般而言,補(bǔ)鐵應(yīng)從口服鐵劑開始,但透析患者優(yōu)先推薦使用靜脈補(bǔ)鐵[35]。
4 小結(jié)
CKD患者普遍存在不同狀態(tài)的鐵缺乏,了解鐵代謝失調(diào)對(duì)于精確評(píng)估、預(yù)測(cè)治療反應(yīng)以及對(duì)慢性腎臟病貧血的有效和安全治療至關(guān)重要。適當(dāng)?shù)蔫F劑治療有益于提高Hb,同時(shí)減少EPO的使用及降低相關(guān)風(fēng)險(xiǎn),目前認(rèn)為靜脈補(bǔ)鐵比口服鐵劑療效更確切,但具體方式還需結(jié)合患者實(shí)際情況。目前臨床評(píng)價(jià)鐵狀態(tài)的生物標(biāo)志物有很多,然而,在慢性腎臟病中,這些指標(biāo)很多受腎衰竭和伴隨的炎癥影響,不能準(zhǔn)確反映鐵的真實(shí)狀態(tài),鐵狀態(tài)的評(píng)估仍是挑戰(zhàn)。目前臨床rHuEPO治療腎性貧血的地位仍不可動(dòng)搖,HIF的發(fā)現(xiàn)為腎性貧血的治療提供了全新的選擇,而針對(duì)改善鐵代謝如Hepcidin抑制劑等仍需進(jìn)一步探索。
參 考 文 獻(xiàn)
[1] ?SATO K,KUMAGAI N,SUZUKI N.Alteration of the DNA methylation signature of renal erythropoietin-producing cells governs the sensitivity to drugs targeting the hypoxia-response pathway in kidney disease progression[J].Front Genet,2019,10:1134.
[2] ?NOONAN M L,CLINKENBEARD E L,NI P,et al.Erythropoietin and a hypoxia-inducible factor prolyl hydroxylase inhibitor (HIF-PHDi) lowers FGF23 in a model of chronic kidney disease (CKD)[J].Physiol Rep,2020,8(11):e14434.
[3] ?UEDA N,TAKASAWA K.Impact of inflammation on ferritin,hepcidin and the management of iron deficiency Anemia in chronic kidney disease[J].Nutrients,2018,10(9):E1173.
[4] ?GAFTER-GVILI A,SCHECHTER A,ROZEN-ZVI B.Iron deficiency Anemia in chronic kidney disease[J].Acta Haematol,2019,142(1):44-50.
[5] ?劉洋,賴學(xué)莉,郭志勇.慢性腎臟病鐵穩(wěn)態(tài)的研究及治療進(jìn)展[J].中華腎病研究電子雜志,2017,6(2):83-87.
[6] ?DEV S,BABITT J L.Overview of iron metabolism in health and disease[J].Hemodial Int,2017,21(Suppl 1):S6-S20.
[7] ?REICHERT C O,DA CUNHA J,LEVY D,et al.Hepcidin:homeostasis and diseases related to iron metabolism[J].Acta Haematol,2017,137(4):220-236.
[8] ?PUNJ S,GHAFOURIAN K,ARDEHALI H.Iron deficiency and supplementation in heart failure and chronic kidney disease[J].Mol Aspects Med,2020,75:100873.
[9] ?王彥華, 侯麗虹. 鐵調(diào)素表達(dá)與調(diào)節(jié)機(jī)制的研究進(jìn)展[J]. 國(guó)際輸血及血液學(xué)雜志, 2019,42(4):358-361.
[10] ?SANTOS-SILVA A,RIBEIRO S,REIS F,et al.Hepcidin in chronic kidney disease Anemia[J].Vitam Horm,2019,110:243-264.
[11] ?RISHI G,SUBRAMANIAM V N.The relationship between systemic iron homeostasis and erythropoiesis[J].Biosci Rep,2017,37(6):BSR20170195.
[12] ?SUN C C,VAJA V,CHEN S Z,et al.A hepcidin lowering agent mobilizes iron for incorporation into red blood cells in an adenine-induced kidney disease model of Anemia in rats[J].Nephrol Dial Transplant,2013,28(7):1733-1743.
[13] ?鄒賢順,劉利生,湯錦美,等.重組人促紅素聯(lián)合蔗糖鐵治療維持性血液透析貧血患者的效果觀察[J].實(shí)用臨床醫(yī)藥雜志,2020,24(18):77-80.
[14] ?RIBEIRO S,GARRIDO P,F(xiàn)ERNANDES J,et al.Recombinant human erythropoietin-induced erythropoiesis regulates hepcidin expression over iron status in the rat[J].Blood Cells Mol Dis,2016,59:63-70.
[15] ?HONDA H,HOSAKA N,GANZ T,et al.Iron metabolism in chronic kidney disease patients[J].Contrib Nephrol,2019,198:103-111.
[16] ?趙璐,劉虹.慢性腎臟病患者的炎癥狀態(tài)及其對(duì)腎性貧血治療的影響[J].中國(guó)血液凈化,2020,19(3):149-152.
[17] ?BEGUM S,LATUNDE-DADA G O.Anemia of inflammation with an emphasis on chronic kidney disease[J].Nutrients,2019,11(10):2424.
[18] ?陳吉林,林洪麗.慢性腎臟病患者鐵缺乏及鐵代謝[J].中國(guó)血液凈化,2020,19(6):368-371.
[19] ?OGAWA C,TSUCHIYA K,TOMOSUGI N,et al.A hypoxia-inducible factor stabilizer improves hematopoiesis and iron metabolism early after administration to treat anemia in hemodialysis patients[J].Int J Mol Sci,2020,21(19):7153.
[20] ?吳心虹,張蕓.NGAL對(duì)腎性貧血鐵代謝及紅細(xì)胞成熟影響的研究[J].臨床腎臟病雜志,2019,19(11):847-852.
[21] ?ZAHER M A, MOHAMMED S, AHMAD T. Renal anemia refractory to erythropoietin[J]. Journal of Current Medical Research and Practice, 2020,5(2):146-151.
[22] ?RIBEIRO S,GARRIDO P,F(xiàn)ERNANDES J,et al.Pathological and molecular mechanisms underlying resistance to recombinant human erythropoietin therapy in the remnant kidney rat model of chronic kidney disease associated anemia[J].Biochimie,2016,125:150-162.
[23] ?HAYASHI T,JOKI N,TANAKA Y,et al.Resistance to erythropoiesis-stimulating agents in pre-dialysis and post-dialysis mortality in Japanese incident hemodialysis patients[J].Blood Purif,2019,47(Suppl 2):31-37.
[24] ?SOUZA E,CHO K H,HARRIS S T,et al.Hypoxia-inducible factor prolyl hydroxylase inhibitors:a paradigm shift for treatment of anemia in chronic kidney disease?[J].Expert Opin Investig Drugs,2020,29(8):831-844.
[25] ?DEL BALZO U,SIGNORE P E,WALKINSHAW G,et al.Nonclinical characterization of the hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat,a novel treatment of anemia of chronic kidney disease[J].J Pharmacol Exp Ther,2020,374(2):342-353.
[26] ?剌嫣瑾,于為民,任小軍.低氧誘導(dǎo)因子治療腎性貧血的Meta分析[J].中國(guó)中西醫(yī)結(jié)合腎病雜志,2020,21(1):40-44.
[27] ?HU Z H,TAO H,SHI A M,et al.The efficacy and economic evaluation of roxadustat treatment for anemia in patients with kidney disease not receiving dialysis[J].Expert Rev Pharmacoecon Outcomes Res,2020,20(4):411-418.
[28] ?方玲,常曉燕,汪燕燕,等.羅沙司他治療腎臟透析患者貧血有效性和安全性的Meta分析[J].中國(guó)醫(yī)院藥學(xué)雜志,2020,40(23):2435-2439.
[29] ?CAPPELLINI M D,COMIN-COLET J,DE FRANCISCO A,et al.Iron deficiency across chronic inflammatory conditions:international expert opinion on definition,diagnosis,and management[J].Am J Hematol,2017,92(10):1068-1078.
[30] ?NALADO A M,OLORUNFEMI G,DIX-PEEK T,et al.Hepcidin and GDF-15 are potential biomarkers of iron deficiency anaemia in chronic kidney disease patients in South Africa[J].BMC Nephrol,2020,21(1):415.
[31] ?ADLER M,HERRERA-GMEZ F,MARTN-GARCA D,et al.The impact of iron supplementation for treating anemia in patients with chronic kidney disease:results from pairwise and network meta-analyses of randomized controlled trials[J].Pharmaceuticals (Basel),2020,13(5):E85.
[32] ?GANZ T,ARONOFF G R,GAILLARD C A J M,et al.Iron administration,infection,and anemia management in CKD:untangling the effects of intravenous iron therapy on immunity and infection risk[J].Kidney Med,2020,2(3):341-353.
[33] ?WALTHER C P,TRIOZZI J L,DESWAL A.Iron deficiency and iron therapy in heart failure and chronic kidney disease[J].Curr Opin Nephrol Hypertens,2020,29(5):508-514.
[34] ?MACDOUGALL I C, WHITE C, ANKER S D, et al. Intravenous iron in patients undergoing maintenance hemodialysis[J]. The New England journal of medicine, 2019,380(5):447-458.
[35] ?宋陸茜,常春康.鐵代謝、鐵評(píng)估指標(biāo)和補(bǔ)鐵治療策略[J].中國(guó)血液凈化,2020,19(3):157-160.
(收稿日期:2020-12-07 修回日期:2021-01-01)
(編輯:潘明志)
- 右江醫(yī)學(xué)的其它文章
- 參苓白術(shù)散加減聯(lián)合多索茶堿對(duì)COPD穩(wěn)定期患者肺功能及GQOL-74評(píng)分的影響
- 關(guān)節(jié)腔注射血小板裂解液聯(lián)合硫酸軟骨素對(duì)膝關(guān)節(jié)炎患者膝關(guān)節(jié)功能的影響
- 臍血中性粒細(xì)胞毒性改變聯(lián)合降鈣素原及超敏C反應(yīng)蛋白在新生兒宮內(nèi)細(xì)菌感染診斷中的價(jià)值研究
- 吉西他濱不同給藥間隔時(shí)間對(duì)晚期乳腺癌的療效及其預(yù)后的影響
- 148例老年2型糖尿病患者血糖控制效果及影響因素研究
- 不同院前急救方式對(duì)急性腦卒中患者臨床效果分析

