基于“變化觀”培養的教學設計
李晶晶 徐玲
摘要:以傅興春編寫,福建教育出版社出版的《化學學科思想》作為“變化觀”的理論依據,梳理了“變化觀”的內涵并探討了其教育價值,整理了 2019 年人教版高中化學教材中涉及“變化觀”的核心概念,以“氧化還原反應”概念教學為例,設計促進“變化觀”培養的教學活動,將“變化觀”與化學學科核心素養貫穿于整個課堂教學。
關鍵詞:氧化還原反應;變化觀;化學學科核心素養;教學設計
文章編號:1008-0546(2023)07-0050-05 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2023.07.009
化學學科思想會影響學生分析和解決實際問題的價值取向和行為方式。[1]“變化觀”作為化學學科思想的重要組成部分,對知識的理解及化學學科核心素養發展起著舉足輕重的作用。
一、 “變化觀”的內涵及價值
1. “變化觀”的內涵
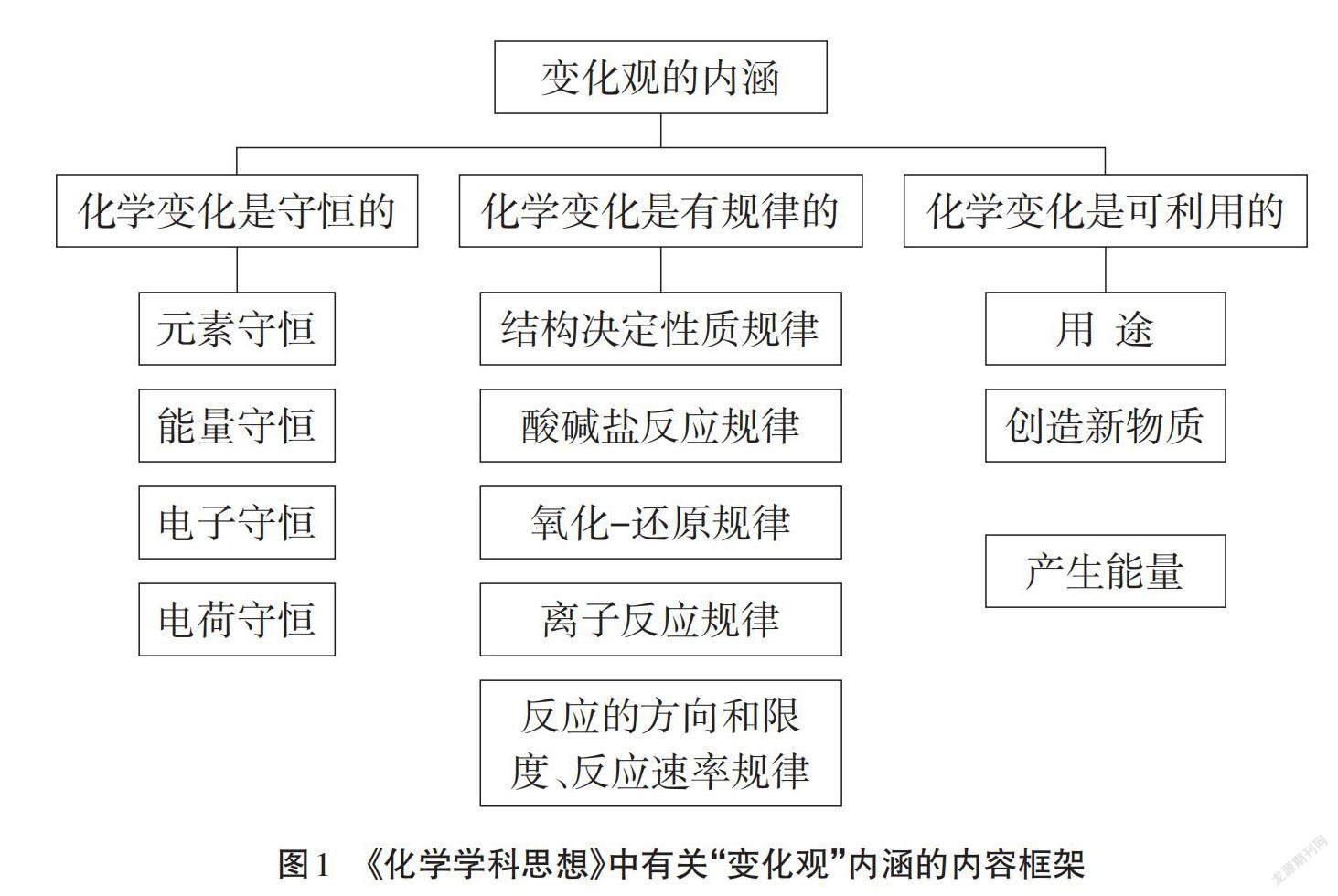
“變化觀”包含三個層次內容:化學變化是守恒的、有規律的、可利用的,[1] 具體內容結構如圖1所示。
2. “變化觀”的教育價值
知識是基礎,化學思想是靈魂。[2] 化學學科思想是促進學生學會分析和解決化學問題應具備的思維能力。 “變化觀”作為化學觀念體系中的重要組成部分,可以讓學生實質性地理解化學變化,運用變化觀念理解、分析、解決問題。促進“變化觀”培養的化學教學有利于學生“變化觀念與平衡思想”素養的發展。教師在教學中通過以知識為載體進行化學學科思想的培養,促進學生具備能適應終身發展和社會發展需要的必備品格。
二、教材中有關“變化觀”涉及的核心概念
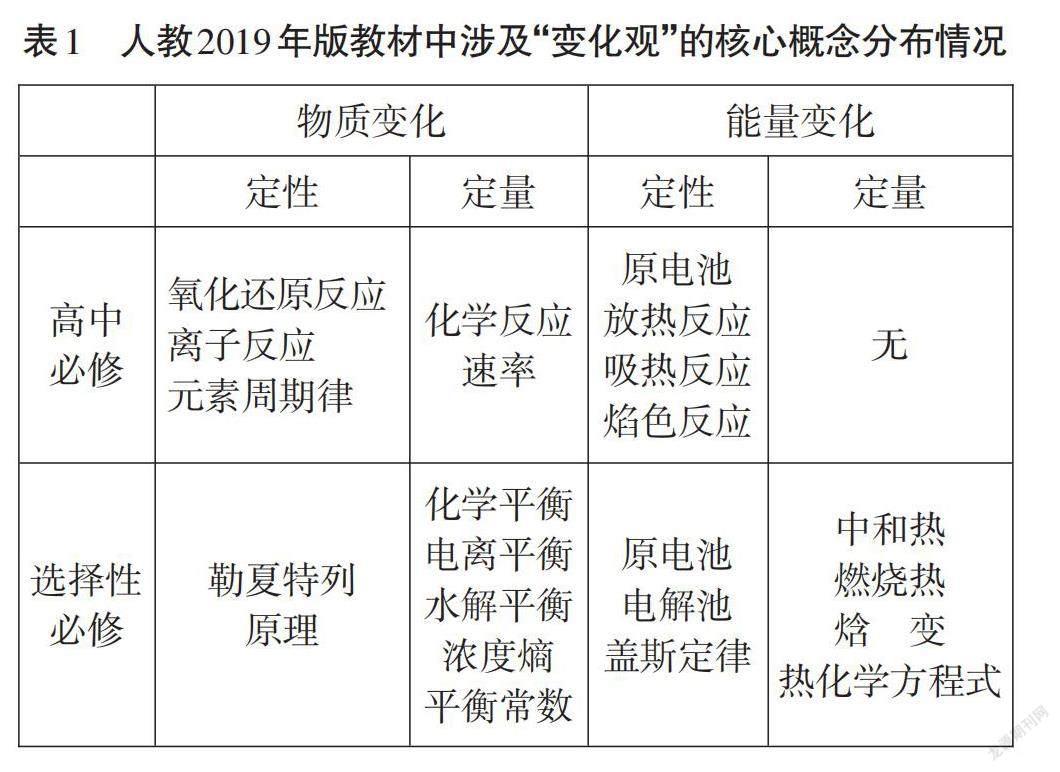
“變化觀”涉及的內容貫穿整個高中階段。以2019 年人教版教材為例,將“變化觀”有關的核心概念進行整理,具體內容如表1所示。
教材中“變化觀”主要從物質變化和能量變化兩個一級維度來安排,其中每個一級維度又從定性和定量兩個角度安排,具體內容的編排具有進階性。[3] 高中化學必修階段,是在初中認識化學反應基礎上,對化學反應的認識編排從宏觀現象階段進入到微觀認識階段。例如:氧化還原反應的實質是電子轉移、離子反應實質是有離子的參與等。此外,解釋了化學反應不僅有物質變化還有能量變化,從而引入吸熱反應、放熱反應和原電池等概念。高中選擇性必修階段,從熱力學和動力學兩個角度具體從化學反應速率、限度的角度定性認識化學變化,引入化學平衡、電離平衡、化學平衡常數、焓變等核心概念并運用勒夏特列原理解釋化學平衡移動。這樣呈進階式的編排,有利于學生逐步形成高中階段的化學“變化觀”。
三、 “氧化還原反應”概念教學中蘊含的“變化觀”
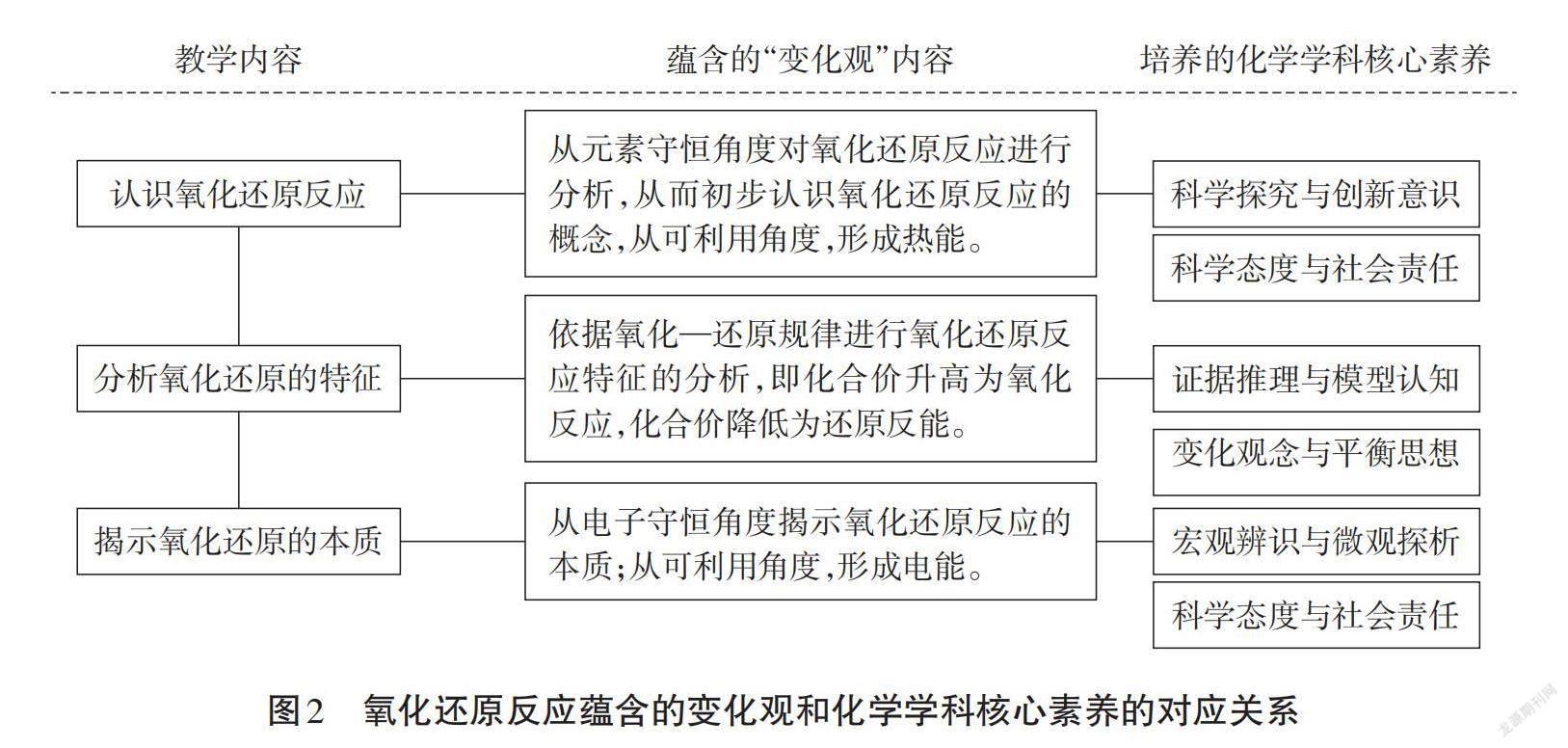
“氧化還原反應”是中學化學的核心概念,在教學中不僅要幫助學生順利理解核心概念,還要挖掘出該概念教學中蘊含的“變化觀”, “氧化還原反應”中蘊含的變化觀內容及其對應培養的化學學科核心素養如圖2所示。
該節課蘊含著“元素守恒”和“電子守恒”兩個守恒觀念,從中可以挖掘出氧化-還原的規律,從應用層面挖掘能量的可利用性,這些核心知識的教學中可以逐步培養學生的“變化觀”。
四、基于“變化觀”培養的“氧化還原反應”教學設計
化學科學思維是伴隨著化學科學實踐活動和問題解決而產生和發展的,[4] 教學中以知識和活動為載體,讓學生通過學習活動理解概念的同時形成“變化觀”,讓“變化觀”建構貫穿于整個教學過程。
1. 教學整體思路設計
本節課依據化學反應具有可利用性,將氧化還原反應產生的熱能、電能作為出發點,選擇“自發熱鞋墊” “電動車電池”兩個真實情境,設置若干個問題鏈,引導學生進行活動探究,探究后進行匯報、展示思維過程,再從學生匯報內容中選擇恰當的反應作為探究案例,繼續追問,層層遞進,學生在一次次的問題解決中逐步培養變化觀念,具體教學思路如圖3所示。
2. 教學目標與評價目標定位
(1)教學目標
①通過對氧化還原反應現象的認識,了解氧化還原反應的概念,初步形成基于元素守恒的“變化觀”。
②通過對元素化合價分析以及其與核外電子的關系,理解氧化還原的特征、實質,鞏固形成基于電子守恒的“變化觀”,促進學生“變化觀念與平衡思想”“證據推理與模型認知” “宏觀辨識和微觀探析”素養發展。
③通過對生活實例進行實驗探究,提高學生分析能力、探究能力,促進“科學探究與創新意識” “科學態度與社會責任”素養發展。
(2)評價目標
①通過對氧化還原反應的特征的辨識與實質的分析,診斷并發展學生“變化觀”以及“變化觀念與平衡思想” “證據推理與模型認知” “宏觀辨識和微觀探析”素養。
②通過“自發熱鞋墊” “電動車電池”案例的探究,診斷并發展學生“科學探究與創新意識” “科學態度與社會責任”素養。
(3)教學活動設計
板塊1:從得失氧角度了解氧化還原反應概念。
該環節讓學生認識氧化還原反應概念并從質量守恒和元素守恒兩個角度分析氧化還原反應,形成基于守恒的“變化觀”。診斷并發展學生的實驗探究能力,能從元素守恒角度分析化學變化。
教學流程:
【教師】冬天來了,我們經常會用到“暖寶寶” “自發熱鞋墊”, “自發熱鞋墊”中的熱量是如何產生的?又發生的是什么反應?
具體的原理是怎樣的?根據“自發熱鞋墊”中成分說明,該反應中產生的熱量來自于“碳粉”的反應還是“鐵粉”反應?
【學生】進行猜想:猜想1:碳粉發生反應了氧化反應。猜想2:鐵粉發生反應了氧化反應。
【教師】如何證明你的猜想?請根據大家手中現有的資源進行小組探究。
【學生】實驗預測匯報:
預測1:將反應后的粉末進行稱量,質量若增加,則證明反應的是鐵粉,如果質量減少證明反應的是碳粉。
預測2:將粉末放入稀鹽酸中后,如果粉末不溶解,不產生氣泡,過濾后濾液為黃色,說明反應的是鐵粉。涉及反應為:Fe 2 O 3 +6HCl = 2FeCl 3 +3H 2 O。
預測3:將粉末放入稀鹽酸中后,如果粉末出現溶解現象,并產生氣泡,過濾后溶液為淺綠色,說明反應的是鐵粉。涉及反應為:Fe+2HCl = FeCl 2 +H 2 ↑
【學生】分組實驗:實驗用品及藥品: “自發熱鞋墊”、稀鹽酸、燒杯、玻璃棒、漏斗、托盤天平、燒杯等。
【學生】實驗匯報并解釋:匯報1組:當鞋墊不再發熱時,拆開包裝,進行稱量,質量有所增加,說明猜想2正確,是鐵粉參加反應。匯報2組:當鞋墊不再發熱時,拆開包裝,發現粉末中出現有紅棕色,初步判斷為氧化鐵,為了證明進行實驗驗證,根據預測進行實驗驗證猜想2正確,是鐵粉發生了氧化反應釋放了熱量。
【教師】追問1:生成的Fe 2 O 3 如何還原呢?這個反應又是什么反應?
【學生】小組討論:根據初中學過的赤鐵礦煉鐵,來分析反應中的得氧失氧情況,并進行小組匯報。
【教師】追問2:Fe 2 O 3 +3CO = 2Fe+3CO 2這個反應中僅僅有還原反應嗎?
【學生】回答如圖4。
【教師】追問3:如何定義氧化還原反應?
【學生】氧化還原反應是氧化和還原同時發生的反應。即既有得氧又有失氧的反應。
設計意圖:通過“自發熱鞋墊”創設真實的情境,符合建構主義理論。通過問題解決的方式,巧妙設計問題,調動學生初中已有的知識,學生從原有認知出發,根據初中學習過質量守恒、元素守恒對實際產生的問題進行初步猜想、預測、驗證,診斷并發展了學生的實驗探究能力。通過繼續追問的方式讓學生獨立思考,聯想初中赤鐵礦煉鐵的知識,從學生原有知識出發,更能調動學生主動學習的熱情。通過讓學生進行小組討論,感受氧化還原反應的存在和認識氧化還原反應的概念。從化學反應可利用角度,感知氧化還原反應的應用之一是提供熱量,通過真實情境創設、問題解決方式,學生在解決問題中形成“變化觀”。與此同時,通過學生匯報形式的教學,讓學生展示思維過程,該過程既可以鍛煉學生口語表達能力又可以在學生頭腦中形成解決問題的模型,同時,發展學生“科學探究與創新意識”素養。
板塊2:從化合價角度識別氧化還原反應。
該環節讓學生理解化合價變化是氧化還原反應的特征,并會依據化合價進行氧化還原反應的判斷,從元素化合價變化角度形成氧化-還原規律。診斷并發展學生對氧化還原反應特征的認識水平以及對化學變化規律的掌握程度。
教學流程:
【教師】追問: “Fe 2 O 3 +6HCl = 2FeCl 3 +3H 2 O”是否為氧化還原反應?
【學生】Fe 2 O 3 +6HCl = 2FeCl 3 +3H 2 O無化合價變化,所以不是氧化還原反應。
【教師】反應“Fe+2HCl = FeCl 2 +H 2 ↑ 是否為氧化還原反應?你的依據是什么?
【學生】自主分析教材P 35 思考與交流的三個反應中元素的化合價,觀察它們化合價在反應前后有無變化,如何變化。歸納化合價變化與氧化、還原反應的對應關系。
【學生】小組匯報:Fe+2HCl = FeCl 2 +H 2 ↑該反應為氧化還原反應。因為有化合價的變化。
【教師】追問1:Fe發生了什么反應?HCl發生了什么反應?
【學生】Fe發生了氧化反應,HCl 發生了還原反應。因為Fe化合價升高,HCl中Cl化合價降低。得出結論:氧化反應為元素化合價升高的反應;還原反應為元素化合價降低的反應。
設計意圖:選擇學生上一環節實驗探究中涉及的反應Fe+2HCl = FeCl 2 +H 2 ↑,巧妙設置問題,環環緊扣,學生依據元素守恒規律,從化合價變化角度進行分析,學生通過對課本內容的分析、討論,揭示氧化還原反應的特征并能以化合價作為判據判斷化學反應是否為氧化還原反應,形成化合價升降與氧化-還原對應關系的規律,得出氧化—還原規律,促進“變化觀”的形成。與此同時,通過讓學生匯報,展示分析過程,鍛煉學生根據已有條件進行分析并將知識進行遷移的能力,發展學生“證據推理與模型認知” “變化觀念與平衡思想”素養。
板塊3:從電子得失角度分析氧化還原反應。
該環節讓學生以 NaCl、HCl的形成過程為例,從電子守恒角度分析氧化還原反應的實質,形成基于守恒規律的“變化觀”。診斷并發展學生能從電子守恒角度分析化學變化。
教學流程:
【教師】家里用的電動車,電池工作時會產生電流,我們知道電流的產生是因為電子的定向移動,電動車電池中發生的反應為:
根據“電動車電池”反應原理,判斷電子的轉移和化合價變化的關系是怎樣的?該電池涉及的反應是否為氧化還原反應呢?
【學生】小組合作尋找模型:以教材中NaCl、HCl的形成過程分析化合價變化的原因。得出結論:失去電子,化合價升高。得到電子,化合價降低。小組匯報:電池放電過程中發生了氧化還原反應,因為化合價發生了變化。
【教師】追問1:你從“自發熱鞋墊”和“電動車電池”兩個反應中可以得出氧化還原反應具體應用是什么?
【學生】舉例說明:氧化還原反應過程中可以產生熱能也可以產生電能。
【教師】發生氧化還原反應過程中可以產生熱能同時也可以產生電能,我們可以利用氧化還原反應的這個性質來綜合利用氧化還原反應。
設計意圖:以電子守恒為依據,以具體元素原子結構特點展開分析,以具體物質生成過程幫助理解,搭建臺階引導學生對氧化還原的認識從宏觀過渡到微觀,理清電子的得失與化合價升降的對應關系,促進學生從宏微結合角度認識化學變化,自然而然形成“變化觀”。與此同時,從電子轉移會產生電流的角度出發,讓學生認識化學變化的另一個應用是產生電能。在整個探究過程中發展學生“宏觀辨識與微觀探析” “科學態度與社會責任”素養。
五、教學反思
本節課從元素守恒、電子守恒、能量守恒三個角度出發,分別設置了不同梯度的問題,通過問題引導學生進行實驗探究、積極思考、在小組討論中從本質上了解概念的本質。本節課的創新點是不僅向學生介紹了概念,還從應用層面出發,讓學生感受到氧化還原反應的應用,這符合新課標發展學生學科核心素養的要求。通過創設真實的問題情境,讓學生通過解答具有挑戰性的學習任務,解決真實的問題,在解決問題中培養學生的質疑精神、解決問題的能力。
著名物理學家勞厄曾說過,教育所給予人們的無非是當一切已學過的東西都忘記后所剩下來的東西。化學教學要引導學生學習化學的基本原理和方法,形成化學學科的核心觀念。[5]“變化觀”作為化學核心觀念,可以讓學生深入理解化學核心概念、洞悉化學變化的本質,基于“變化觀”養成的化學教學設計,可以讓學生學會用“變化觀”來理解化學變化,從而更好地創造物質。
參考文獻
[1] 傅興春. 化學學科思想[M]. 福州:福建教育出版社,2017.
[2] 王希儉. 基于化學學科觀念培養的“鋁”的教學[J]. 中學化學教學參考,2015(8):86-88.
[3] 吳晗清,王連璉. 化學觀念體系及其教學研究—以變化觀為例[J]. 化學教學,2022(1):3-7,26.
[4] 胡欣陽,畢華林. 化學科學思維的內涵及其發展路徑—讓學生像化學家一樣思考[J]. 化學教育(中英文),2022,43(5):1-7.
[5] 中華人民共和國教育部. 普通高中化學課程標準(2017年版2020年修訂)[S]. 北京:人民教育出版社,2020.

