牛病毒性腹瀉流行病學及防控要點
王鎮 袁文煥 王芳蕊
摘要:牛病毒性腹瀉是牛病毒性腹瀉病毒入體感染導致的,其以全身黏膜發炎為主要癥狀的一種傳染性疾病。所有年齡的牛均對牛病毒性腹瀉病毒易感,該病呈全球性分布。牛病毒性腹瀉病毒感染臨床表現多樣,不同種類牛均可發生腸道和呼吸道疾病,易感繁育母牛發生生殖系統與胎兒相關疾病。臨床表現和嚴重程度因不同毒株而異,可能是亞臨床性的,也可發展為嚴重的致死性疾病。筆者從牛病毒性腹瀉病原和致病機制、主要癥狀與診斷技術、預防、治療及案例分析介紹了該病的防控要點。
關鍵詞:牛病毒性腹瀉;病原體;發病機制預防;治療
1 病原體和致病機制
牛病毒性腹瀉是由牛病毒性腹瀉病毒(Bovine viral diarrhoea viruses,BVDV)感染導致的,以全身黏膜發炎為主要癥狀的一種傳染性疾病。BVDV是黃病毒科瘟病毒屬的一種單股正鏈RNA病毒,該屬包含許多個種,包括牛病毒性腹瀉病毒(BVDV)的2種基因型(1型和2型)以及與其密切相關的古典豬瘟和羊邊界病病毒,傳播性很強。所有年齡的牛均對牛病毒性腹瀉病毒易感。盡管一些國家已根除了此病毒,但該病仍呈全球性分布。牛病毒性腹瀉病毒感染臨床表現多樣,不同種類牛均可發生腸道和呼吸道疾病,易感繁育母牛發生生殖系統與胎兒相關疾病。臨床表現和嚴重程度因不同毒株而異,可能是亞臨床性的,也可發展為嚴重的致死性疾病。BVDV也造成免疫抑制,使感染動物對其他病毒和細菌更易感(如巴氏桿菌、昏睡嗜血桿菌、霉形體等)。臨床影響在集約化管理的家畜中更明顯,感染牛可能表現為臨床健康、虛弱和發育不良。病毒主要通過持續感染動物與其他牛的親密接觸而傳播。BVDV也可在環境中存活較短時間,或通過被污染的繁殖材料而傳播。
垂直傳染在該病的流行病學和致病機制中起著重要作用。繁育母畜感染可導致妊娠失敗,胚胎或胎兒感染,從而導致流產、死胎、胎兒畸形或產出持續感染犢牛。子宮內感染如果發生在妊娠最初25d,往往導致胚胎死亡;如感染發生在妊娠最初的3個月,存活下來的動物幾乎均呈持續性感染且血清陰性。出生的持續性病毒血癥者可能是體弱、發育不良的犢牛,或表現為正常健康的犢牛,很長一段時間未能被識別。它們是群體內病毒的主要貯藏宿主,在尿液、糞便、分泌物、乳汁和精液中排出大量病毒。然而,持續感染動物的預期壽命會顯著縮短,在未達到成年前死亡比例很高,偶有發展成黏膜病,伴有厭食、胃腸道糜爛或大量腹瀉,最終死亡。因此,識別持續感染牛是控制傳染的關鍵。
BVDV急性感染常見于青年牛,有時牛只突然死亡而無明顯的臨床癥狀,也許會出現一過性白細胞減少,急性感染康復后通常不會發生潛伏性感染,但在急性感染期的病毒血癥期和之后的短時間內,從鼻腔、眼睛分泌物和公牛采集的精液中可能含有病毒。一些恢復的公牛可能偶有持續性睪丸感染,并長期從精液排出病毒。急性感染動物繼發其他病毒和細菌感染概率很高。
一般認為,只要沒有妊娠,血清陽性、無病毒血癥的牛是“安全”的,但因少部分持續性病毒血癥的動物如果暴露于持續感染病毒有抗原性差異的其他BVDV株,可能會產生針對部分病毒蛋白的抗體,故抗體陽性不完全等同于“安全”。持續感染動物檢測必須特異性地直接檢測病毒或其組分(RNA或抗原)。
雖然BVDV毒株主要是牛的致病病原,但與綿羊、山羊和豬密切接觸后也可發生跨種間傳播。妊娠小型反芻動物或感染BVDV可導致繁殖能力損傷、產出患持續感染的動物。有研究表明,世界范圍內均有駝類感染BVDV的報告。此外,感染邊界病病毒(BDV)的牛,其臨診表現與BVDV感染難以區分。
2 臨床癥狀與診斷
牛病毒性腹瀉急性型癥狀與慢性型不盡相同,急性型發病突然,高熱達40.5~42℃,口腔各部位均出現散在的糜爛或潰瘍,糞便呈水樣、惡臭,含有大量的黏液,如不及時治療1周內死亡;慢性型病毒性腹瀉病牛呈間歇性腹瀉,進行性消瘦,蹄部逐漸變形,口腔和皮膚出現慢性潰瘍,貧血、白細胞減少,多數病牛在2~6個月內死亡。
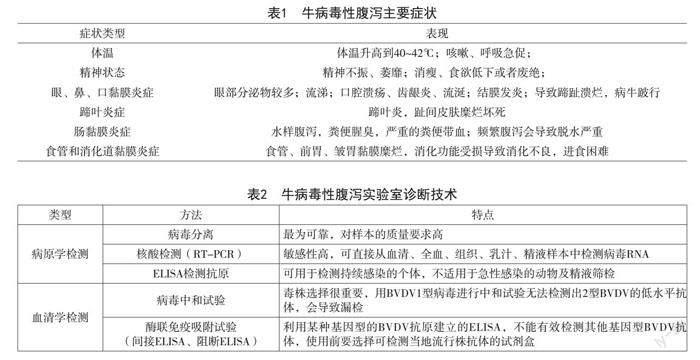
牛病毒性腹瀉可根據當地流行情況、癥狀及病理變化進行初步診斷,少數臨床癥狀和病變的病牛不足一半,大多數牛只呈現亞臨床感染或輕微感染,診斷具有一定困難,最終的確診均需對病毒進行分離鑒定和血清學檢查。表1所示的癥狀類型及表現,可作為該病初步診斷參考。
實驗室診斷技術的方法及特點見表2。
3 預防
3.1 鑒定并淘汰持續感染的病牛
因為持續性病毒血癥動物是其他牛感染BVDV的來源,也是最主要的病毒宿主。如果牛場沒有嚴格的BVDV控制方案,牛群中至少有1%的牛只為持續感染病原。所以,用于貿易或者育種的動物,必須進行篩檢,找出持續性感染動物并淘汰,若不淘汰會擴大感染面積。
3.2 飼養環境全面嚴格消毒
定期清掃牛場,清除雜草堆物,滅蠅滅鼠,每月進行1次藥物消毒,生石灰最常用于圈舍、道路等地面環境消毒;對人員和車輛進出口嚴格進行消毒,且消毒池內的消毒溶液也須定期清洗、更換,燒堿、二氯異氰尿酸鈉粉、戊二醛癸甲溴銨溶液可交替使用;每周對棚舍地面、牛床、食槽和水槽消毒1次,每周用消毒液刷洗1次飼養用具,推薦用新潔爾滅。
3.3 堅持自繁自養原則
確需購牛時優先選擇無疫場,避免購入未經檢疫的牛只,可降低引入該病毒的危險。對新引進牛只要隔離觀察40 d以上。按照標準化養殖要求,隔離牛舍距離養殖主牛舍應大于50 m。很多養殖戶建造牛舍時沒有達到防控有效隔離距離,往往采用新引進牛與原飼養群混合或者同舍分開飼養,但病毒容易通過食槽、水槽傳播。
3.4 選擇優良疫苗進行免疫接種
BVDV疫苗的主要用途是控制疫病、對集約化養牛場可改善生產性能。牛病毒性腹瀉疫苗分2類:減毒活疫苗和滅活疫苗。這2種疫苗的基本要求是,具有高水平的防止胎盤感染能力。確保疫苗毒株不會引起胎兒感染是非常重要的,所以許多活疫苗是基于不能穿過胎盤的致細胞病變型毒株研制的。一般來說,應在配種前做好種畜的免疫接種,避免胎兒感染。活疫苗有可能導致免疫抑制或誘發其他感染,而正確制備的滅活疫苗使用起來非常安全,但為了獲得滿意的免疫效果,需加強免疫。目前國內有以下3種BVD滅活疫苗:(1)牛病毒性腹瀉/黏膜病滅活疫苗(1型,NM01株);(2)牛病毒性腹瀉/黏膜病、牛傳染性鼻氣管炎二聯滅活疫苗(1型,NM01株+LN01/08株);(3)牛病毒性腹瀉/黏膜病、傳染性鼻氣管炎二聯滅活疫苗(NMG株+LY株)。2月齡以上牛只可用滅活疫苗,按說明書要求進行充分免疫,初始免疫需要2次,中間至少間隔21 d,以確保產生足夠的免疫力,免疫保護期一般為4個月。
4 治療
牛病毒性腹瀉治療關鍵是抗病毒和消炎、補充水分及電解質,保護胃腸黏膜。內服0.1%高錳酸鉀溶液即可收到較好的效果,每次2000~3000 mL,每天1~2次,或者內服磺胺脒(每次10~20 g,每天2~3次)等藥物。下痢不止時,應內服次硝酸鉍(5~10 g)或活性物(10~20 g),以保護腸黏膜,減少毒素吸收。同時可進行靜脈內補液、強心等對癥治療,以縮短恢復期,減少養殖戶經濟損失。
5 典型病例
正值冬季,是牛病毒性腹瀉的高發期。近期,單位技術人員在下鄉開展技術服務過程中,了解到附近一家肉牛養殖場發生了一起牛腹瀉死亡的病例。該場位于天津市西部郊區,根據飼養者敘述,死亡病牛約128日齡,為突然發病,隔離飼養后先是精神萎靡不振,活躍度明顯下降,體溫略有升高而后正常,尾根部位較臟,排黃色或黃綠色液狀稀糞,有時帶有黏液,灌服了止瀉藥,但2d后病牛又出現厭食,鼻漏,流涎,呼氣惡臭,繼而嚴重腹瀉,呈噴射狀排出水樣糞便,并帶有黏液和血,嘔吐不止,第4天倒地死亡。技術人員懷疑是病毒性腹瀉急性感染發病,經養殖場負責人同意后,技術人員到養殖場內部進行查看。
觀察同群牛,部分牛發熱癥狀,雖不明顯,但體溫稍微高于正常體溫,也無腹瀉癥狀,最明顯的癥狀是鼻黏膜發炎,眼有分泌物,技術人員采集了同群牛只血液,鼻腔、結膜和糞便拭子,帶回實驗室進行檢測診斷。使用牛病毒性腹瀉(BVD)抗原檢測試劑盒對樣品進行抗原檢測,結果只有1份血液樣品呈弱陽性,其余均呈抗原陰性。技術人員建議該養殖場將抗原弱陽性的牛只與其他牛分開飼養,間隔21d再次進行檢測。同時,對全群超過2月齡的健康牛只(病畜、瘦弱、受孕后期母畜及斷奶前幼畜除外)肌內注射牛病毒性腹瀉/黏膜病、傳染性鼻氣管炎二聯滅活疫苗(NMG株+LY株)2 mL,首免后21d加強免疫1次,以后每隔4個月免疫1次,均肌內注射2 mL。
后期隨訪了解到,單獨隔離飼養的牛只抗原檢測已轉陰,也進行了疫苗免疫,該場飼養員給牛更換了柔軟易消化的飼料,飲用水更換成溫水,并在飼料和飲水中添加了調節胃腸功能的保健藥物,增加了牛的采食量,目前牛群整體情況良好。
參考文獻
[1] 胡慧.豬瘟病毒E2基因的表達及其間接ELISA診斷方法的研究[D].楊陵:西北農林科技大學,2004.
[2] 王天梓,王艷,唐宇,等.牛病毒性腹瀉的危害及防治建議[J].中國乳業,2019(7):51-53.
[3] 王玲.肉牛場疫病的主要防控措施[J].現代農業科技,2018(17):21-26.
[4] 秦義嫻,陳曉春,劉丹,等.2株牛病毒性腹瀉病毒的分離鑒定[J].動物醫學進展,2023(1):43-47.
基金項目:天津市武清區科技計劃項目 奶牛養殖場犢牛腹瀉防控技術應用示范(WQKJ202101)
作者簡介:王鎮(1984—),男,本科,獸醫師,長期從事動物疫病防控、臨床診斷、動物疫病凈化及獸醫新技術推廣工作。

