基于核心素養取向的板塊-任務式課堂教學設計
范麗紅
摘 ? 要:“素養為本”的有效課堂教學倡導化學知識的結構化設計和真實問題情境的創設,及開展多種形式的實驗探究活動。文章以“抗酸藥——NaHCO3片”創設真實問題情境,通過板塊-任務式設計,使學生通過實驗探究,進一步提升對NaHCO3和Na2CO3性質的認知,建立起知識間跨模塊聯系。
關鍵詞:核心素養;結構化;板塊;任務
板塊教學作為一種課堂教學形式,將教學內容及教學過程分成幾個逐層深化且緊密聯系的板塊[ 1 ]。板塊教學注重精心選點,利用“板塊”對選點進行集中突破,從而達到高效教學。
實施“素養為本”的化學課堂教學設計,要求在進行教學設計時,不僅要考慮到板塊的功能,還要考慮到板塊的連接方式,化學課堂教學板塊連接方式的設計既要符合學科邏輯,又要符合學生的認知邏輯。
板塊系統中的“內容”要素,在核心素養取向的化學教學中是以學習任務的形式呈現的。“化學學習任務”對于板塊素養功能的發揮具有決定性作用。學習任務是連接核心知識與具體知識點的橋梁和紐帶,是實現知識結構化的重要環節。在化學教學過程中,要從化學學科整體上考慮建構知識結構體系;在選擇和組織教學內容時,不僅要關注模塊內的聯系,也要重視跨模塊、跨學科間的聯系[ 2 ]。
基于任務的板塊結構設計,在布置任務前,應首先讓學生了解任務產生的背景,實際上就是創設情境。真實具體的問題情境可以為學生提供豐富的學習信息,促使學生主動探究,發散思考,靈活運用所學知識解決實際問題,是學生化學學科素養形成和發展的重要平臺。
《普通高中化學課程標準(2017版)》對“金屬及其化合物”的要求:結合真實情境中的應用實例或通過實驗探究,了解鈉及其重要化合物的主要性質,了解這些物質在生產、生活中的應用[ 3 ]。本文以“Na2CO3和NaHCO3的性質”為課例,開展了核心素養取向的板塊-任務式化學課堂教學設計研究。
1 ?教學設計
1.1 ?素養定位
“鈉及其化合物”是人教版高中《化學》(必修)第一冊第二章中的重點內容。以已有知識為起點,使學生通過實驗,在真實情境中探究Na2CO3和NaHCO3的性質,培養學生的證據推理和科學探究素養;通過學習侯氏制堿法的工藝流程,使學生掌握經典物質制備方案中物質轉化的原理,培養學生的科學態度和社會責任素養。
1.2 ?教學目標和教學流程
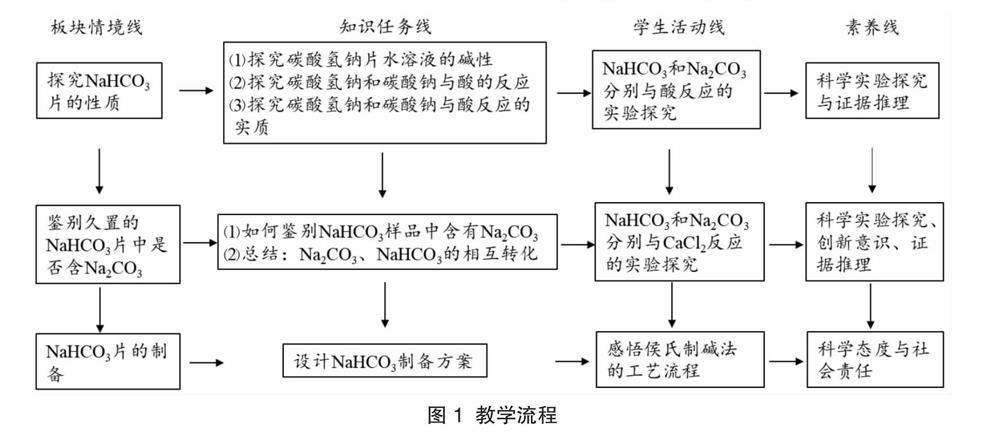
教學目標:(1)基于實驗探究Na2CO3、NaHCO3的性質,理解并掌握Na2CO3、NaHCO3相互轉化的途徑。建立鈉及其化合物的認知結構,感悟核心元素各物質間轉化的內在聯系。(2)探究侯氏制堿法的原理,充分認識運用物質轉化的基本規律進行物質制備工藝流程的設計。
教學流程如圖1所示。
2 ?學情分析
本節課對學生的實驗操作能力、分析推理能力和歸納概括能力要求較高,高一學生對實驗有濃厚的興趣,參與實驗探究的積極性較高。但學生的實驗操作技能和解決實際問題的能力較低。
學生通常利用機械記憶的方法進行元素化合物部分內容的學習,這使得學生對知識的理解不夠深刻。本節課中教師擬引導學生通過實驗對鈉及其化合物的性質作出推斷和預測。通過問題引領學生進行深層次思考,提升學生對NaHCO3和Na2CO3性質的認知。
3 ?教學過程
3.1 ?情境創設
[師] (展示一瓶碳酸氫鈉片)碳酸氫鈉片作為一種抗酸藥,口服后可在胃內直接中和胃酸,增大胃內的pH,用于緩解胃酸過多引起的胃痛、胃灼熱(燒心)、反酸等。碳酸氫鈉片為什么可以做抗酸藥呢?
[生] NaHCO3的水溶液具有堿性。
3.2 ?板塊1的實施
[ 活動1] ?探究碳酸氫鈉片的性質。
任務1:探究碳酸氫鈉片水溶液的堿性。
[(演示)實驗1] ?將1片(0.5 g)碳酸氫鈉片研碎后置于一支試管中,加5 mL水溶解,振蕩試管,靜置,加入幾滴酚酞溶液;同時取相同濃度的碳酸鈉溶液置于一支試管中,加入幾滴酚酞溶液。
[現象] 滴入酚酞后,碳酸氫鈉溶液紅色很淺,而碳酸鈉溶液的紅色較深。
[結論] 碳酸氫鈉的堿性較弱。
[思考1] 我們知道相同濃度碳酸鈉溶液的堿性比碳酸氫鈉強,為什么治療胃酸過多選用碳酸氫鈉而不選用碳酸鈉?
[生] 碳酸氫鈉堿性弱,對人體傷害小。
設計意圖:以“碳酸氫鈉片作為一種抗酸藥”為情境,激發學生的學習興趣,培養學生根據實驗現象進行分析推理的能力。
[思考2] 碳酸鈉和碳酸氫鈉溶液都顯堿性,它們在與稀鹽酸反應時,是OH - 在和H+ 反應嗎?
[生] 碳酸鈉溶液中有大量的CO32-,碳酸氫鈉溶液中存在大量的HCO3-,一定還存在CO32-、HCO3- 與H+ 的反應。
任務2:探究碳酸氫鈉、碳酸鈉與酸的反應。
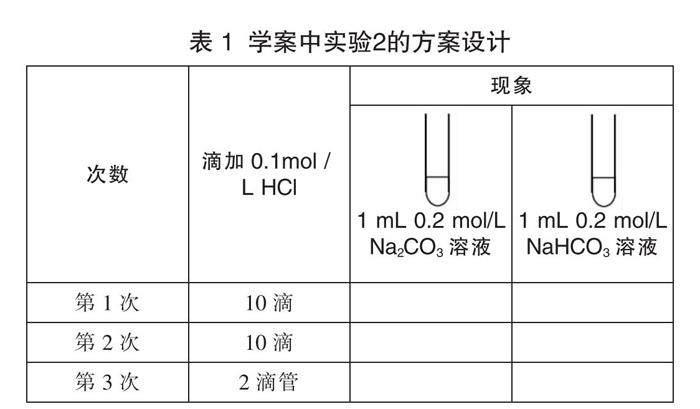
[(學生分組)實驗2] 分別向濃度為0.2 mol/L的Na2CO3溶液和0.2 mol/L的NaHCO3溶液中滴加0.1 mol/L的稀鹽酸,觀察并記錄實驗現象填寫在表1中。
[現象] 向碳酸鈉溶液中滴加稀鹽酸,剛開始沒現象,繼續滴加有氣泡產生。向NaHCO3溶液中滴加稀鹽酸,一開始就有氣泡產生。
[結論] 碳酸鈉和稀鹽酸的反應分二步進行:Na2CO3+HCl=NaCl+NaHCO3 ,NaHCO3+HCl=NaCl+H2O+CO2↑。
設計意圖:學生通過分組實驗,自主探究碳酸鈉、碳酸氫鈉與酸的反應,交流、分享實驗收獲,形成正確的科學觀點和態度。
任務3:探究碳酸氫鈉、碳酸鈉與酸反應的實質。
[思考3] NaHCO3與稀HCl反應先產生氣體,能不能說明NaHCO3與稀HCl反應比Na2CO3更快呢?
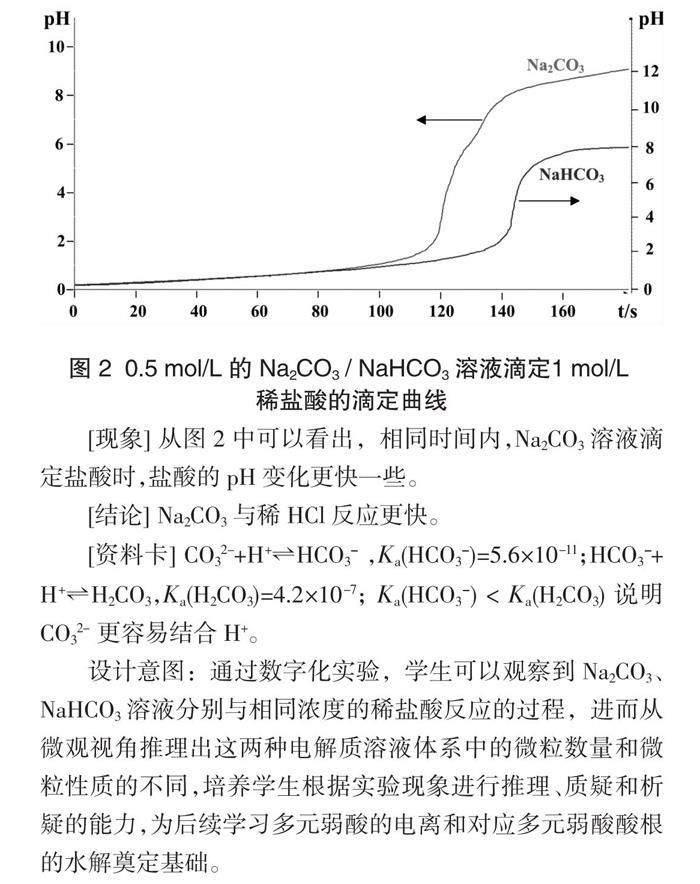
[(演示)實驗3] 用0.5 mol/L的Na2CO3溶液(NaHCO3溶液)來滴定1 mol/L的稀鹽酸,傳感器測得混合溶液的pH變化曲線如圖2所示。
圖 2 ?0.5 mol/L 的 Na2CO3 / NaHCO3 溶液滴定1 mol/L
稀鹽酸的滴定曲線
[現象] 從圖2中可以看出,相同時間內,Na2CO3溶液滴定鹽酸時,鹽酸的pH變化更快一些。
[結論] Na2CO3與稀HCl反應更快。
[資料卡] CO32-+H+?葑HCO3- ,Ka(HCO3-)=5.6×10-11;HCO3-+H+?葑H2CO3,Ka(H2CO3)=4.2×10-7; Ka(HCO3-) < Ka(H2CO3) 說明CO32- 更容易結合H+。
設計意圖:通過數字化實驗,學生可以觀察到Na2CO3、NaHCO3溶液分別與相同濃度的稀鹽酸反應的過程,進而從微觀視角推理出這兩種電解質溶液體系中的微粒數量和微粒性質的不同,培養學生根據實驗現象進行推理、質疑和析疑的能力,為后續學習多元弱酸的電離和對應多元弱酸酸根的水解奠定基礎。
3.3 ?情境創設
NaHCO3在潮濕的空氣中會緩慢分解,那么在空氣中久置的碳酸氫鈉片中是否含有Na2CO3呢?
3.4 ?板塊2的實施
[活動2] 鑒別NaHCO3和Na2CO3。
任務1:如何鑒別NaHCO3樣品中含有Na2CO3?
[生] 用CaCl2溶液。
[思考4] 用CaCl2能否鑒別Na2CO3和NaHCO3?
[(學生分組)實驗4] 分別向等濃度的Na2CO3和NaHCO3溶液中滴加5滴CaCl2溶液,觀察并記錄實驗現象填寫在表2中。
表 2 ?學案中實驗4的方案設計
資料卡:20 ℃ 時,CaCO3的溶解度為0.0065 g;Ca(HCO3)2的溶解度為16.6 g;Ca(OH)2的溶解度為0.16 g。
[現象] 滴入CaCl2溶液后,1mol/L的NaHCO3溶液中有白色沉淀生成;0.01 mol/L的NaHCO3溶液中沒有現象。
[思考5] 為什么1 mol/L的NaHCO3溶液與CaCl2反應會成白色沉淀,生成的白色沉淀是什么?
[生] CaCO3。
[師] 由于NaHCO3濃度小時,電離產生的CO32- 較少,生成的CaCO3較少,不會沉淀出來;而當NaHCO3濃度較大時,電離產生的CO32- 較多,生成的CaCO3較多,超過了CaCO3的溶解度,就會沉淀出來。
[師]資料卡:Ksp(CaCO3)=2.9×10-9,Ksp[Ca(HCO3)2]=1.35×10-6;Ksp[Ca(OH)2]=5.5×10-6,根據沉淀溶解平衡中Ksp和Q的相關數據,能算出Ca2+ 和CO32- 結合生成CaCO3的Q要遠大于CaCO3的Ksp,且比生成Ca(HCO3)2、Ca(OH)2相應的Q與Ksp的差距要大很多,所以生成CaCO3的趨勢更大[ 1 ]。
設計意圖:通過分組實驗,學生可以觀察到CaCl2溶液分別與不同濃度的NaHCO3和Na2CO3溶液反應的現象。進而引導學生從微觀視角認識電解質溶液體系中的微粒種類和微粒數量間的關系,建構起基于Q和K改變物質轉化程度的一般思路。
[師] 如果要使滴加有CaCl2的0.01 mol/L的NaHCO3溶液中也產生白色沉淀,可以怎么做呢?
[生] 使0.01 mol/L的NaHCO3溶液中CO32- 多一些。
[(學生分組)實驗5] 向第2組沒有現象的試管中繼續滴加3滴NaOH溶液。
[現象] 生成白色沉淀。
[師] 加入NaOH后為什么會生成白色沉淀呢?
[生] 加入NaOH溶液后,OH- +HCO3- = CO32-+H2O,溶液中CO32- 增多,生成的CaCO3較多,超過了CaCO3的溶解度,就會以白色沉淀的形式析出。
任務2:總結Na2CO3、NaHCO3的相互轉化。
設計意圖:層層遞進的實驗設計不僅使學生體驗了碳酸鈉和碳酸氫鈉的相互轉化過程,還提高了學生的實驗技能,進而啟發學生從得失H+ 的角度來認識它們之間的轉化。
3.5 ?情境創設
碳酸氫鈉片的主要成分是NaHCO3,要制備碳酸氫鈉片,要先制得NaHCO3,工業上如何制備碳酸氫鈉呢?
3.6 ?板塊3的實施
[活動3] 碳酸氫鈉片的制備
任務1:設計NaHCO3制備方案。
[師] 現在我們要制備NaHCO3,請同學們從物質轉換角度設計NaHCO3的制備方案?
[生] ① NaOH和CO2(過量);② Na2CO3和CO2(過量);③ Ca(HCO3)2+Na2CO3。
[師] 在實際工業生產中制備產品,一般會考慮到原料的來源和生產成本問題,我們知道NaCl在自然界中廣泛存在,能不能用NaCl來制備NaHCO3呢?
[師]早在1810年,法國物理學家福瑞斯奈爾就利用NaHCO3溶解度小的特性,通過復分解反應:NaCl+NH4HCO3=NH4Cl+NaHCO3↓制出了NaHCO3。之后的一百多年,人們對這一工藝不斷進行改良和完善。1943年,我國化學家候德榜發明了聯合制堿法(又稱侯氏制堿法),使NaCl的利用率提高到96%以上。他綜合利用了氨廠的CO2和NH3,反應原理:NH3+H2O+CO2=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3,其生產流程如圖3所示。
圖 3 ?侯氏制堿法的生產流程圖
(1)分別寫出沉淀池中發生的化學方程式。
[生] NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
(2)寫出上述流程中X物質的分子式。
[生] CO2。
(3)向母液中通氨氣,加入細小食鹽顆粒,冷卻析出副產品。通氨氣除了增大NH4+ 的濃度,使NH4Cl更多地析出外,還有什么作用?循環Ⅰ的作用是什么?
[生] 使NaHCO3轉化為Na2CO3,提高析出的NH4Cl純度。循環Ⅰ的作用是提高原料氯化鈉的利用率。
(4)如何檢驗產品碳酸鈉中是否含有碳酸氫鈉?
[生] 加熱,若產生能使澄清石灰水變渾濁的氣體,說明碳酸鈉中含有碳酸氫鈉,否則,不含有碳酸氫鈉。
設計意圖:從物質所含核心元素的角度尋找制備碳酸氫鈉的諸多反應。通過侯氏制堿法,分析NaHCO3制備的原料和原理;使學生從物質轉化的視角,認識物質工業制備的原理,感悟侯氏制堿法的精妙,落實科學態度和社會責任的化學學科素養。
4 ?教學反思
(1)本文以“一瓶抗酸藥引起的探究”作為情境,以NaHCO3的性質為重點,通過板塊-任務式課堂設計,使授課內容的結構清晰,邏輯合理。創設問題情境引導學生進行猜想、實驗探究及運用所學知識解決問題,培養學生根據實驗現象進行推理、質疑、析疑的能力。
(2)依據“科學探究與創新意識”素養發展水平,精心設計了Na2CO3和NaHCO3分別與稀鹽酸(或CaCl2溶液)反應的拓展實驗,既突出了常規實驗的設計,又很好地結合數字化實驗,從定量實驗角度使學生真切地體驗了碳酸鈉與酸的分步反應及NaHCO3的電離過程。更主要的是培養學生的實驗操作技能和分析推理的能力,提高了學生學習化學的興趣。
(3)本文結合HCO3- 的電離和CaCO3沉淀生成的化學反應原理,從微觀角度對實驗現象進行了解釋,引導學生建構基于Q和K改變物質轉化程度的一般思路。
(4)通過學習侯氏制堿法,分析NaHCO3制備的原料和原理,使學生充分認識運用化學變化的基本規律進行物質制備的工業原理。
參考文獻:
[1] 鄭長龍.核心素養導向的化學教學設計[M].北京:人民教育出版社,2021:77,252.
[2] 陳向明.從三個層面提升知識結構化水平[J].中學化學教學參考,2022(4):1-5.
[3] 中華人民共和國教育部.普通高中化學課程標準(2017版)[S].北京:人民教育出版社,2018:15.

