例析化學平衡問題的圖示解法
武贊壽


摘 要:將抽象復雜的化學平衡問題轉化為簡潔易懂的圖示,實現難易轉化,為解題提供捷徑。
關鍵詞:化學平衡;轉化;圖示法
化學平衡問題是中學化學的難點,也是高考的重點。筆者嘗試用圖示法分析,化抽象為具體,使問題簡潔明了,學生易于理解和掌握,效果良好。
一、判斷平衡移動方向
例1.某溫度下,在一容積可變的容器中,反應2A(g)+2B(g)2C(g)達到平衡時,A、B和C的物質的量分別為4 mol、2 mol和4 mol,保持溫度和壓強不變,對平衡混合物中三者的物質的量做如下調整,可使平衡右移的是( )
A.均減半 B.均加倍 C.均增加1 mol D.均減少1 mol
解析:保持溫度和壓強不變,判定平衡是否移動即判定各組分的濃度與平衡濃度比較是否改變,而判定移動方向即判定在原平衡濃度的基礎上誰的濃度增大。
答案: C
二、判斷反應的氣體體積大小關系
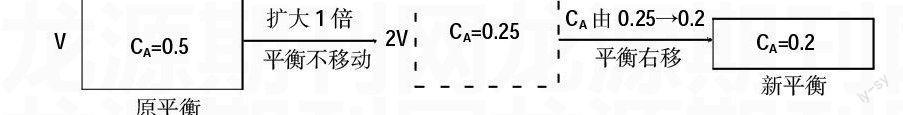
例2.一定量混合氣體在密閉容器中發生如下反應:xA(g)+yB(g)zC(g)達到平衡后,測得A的濃度為0.5 mol/L,恒溫下將容積擴大1倍后重新達到平衡,測得A的濃度為0.2 mol/L,比較該反應的系數大小關系。
解析:欲比較系數大小須先確定平衡移動方向。假定在容積擴大1倍的瞬間平衡未發生移動,虛擬如下過程:
平衡向右移動,根據勒夏特列原理:減小壓強,平衡向氣體體積增大的方向移動,故x+y 三、計算物質的量濃度 例3.在一定溫度下一定體積的密閉容器中,有如下平衡:H2(g)+I2(g)2HI(g),已知:H2和I2起始濃度為0.10 mol/L。達到平衡時,HI的濃度為0.16 mol/L。若H2和I2起始濃度均為0.20 mol/L,則平衡時H2的濃度是多少? 解析:根據等效平衡原理容易得新平衡中IH的濃度。在定溫定容條件下: 則平衡時,根據氫元素守恒:平=始-CHI=0.2-×0.32=0.04(mol/L) 四、比較轉化率 例4.有兩只密閉容器A和B,A保持恒壓,B保持恒容,起始時向兩容器中分別沖入等量且為2∶1的SO2和O2的混合氣體,并使A和B容積相等,在保持400℃條件下使之發生反應2SO2(g)+O2(g)=SO3(g),達到平衡后兩容器中SO2的轉換率分別為a%、b%,比較a%和b%大小。 解析:因為兩容器起始狀態完全相同,在不同條件(定溫定容和定溫定壓)下建立,所以可將定溫定壓下的平衡視為定溫定容下的平衡定溫加壓得到: 由平衡Ⅱ加壓得平衡Ⅰ,平衡正向移動,SO2轉化率增大,因此a% 五、比較體積分數 例5.一真空容器密閉容器中盛有1 mol PCl5加熱到200℃時發生反應PCl5(g)PCl3(g)+Cl2(g)達到平衡時,PCl5所占體積分數為m%,若在同溫度和同容器中最初投入2 mol PCl5,達到平衡時PCl5所占體積分數為n%,則m與n的正確的關系是( ) A.m>n B.m 解析:分別取容積為V和2V的兩個容器在相同溫度下建立等效平衡Ⅰ和Ⅱ,將平衡Ⅱ定溫加壓使容積由2V變為V就可得到平衡Ⅲ。設計如下途徑: 由平衡Ⅱ加壓得平衡Ⅲ,平衡逆向移動,因此m% 答案:B 綜上所述,只有認真研究題型,理清轉化過程,準確運用基本依據,靈活設計圖示,便可輕松解決平衡類問題。 參考文獻: 張軍貴.化學計算巧解探索[J].中學化學教學參考,2010(12). 編輯 謝尾合

