基于學科觀念培育的復習課教學設計
嚴春建

摘要:實錄了“再識復分解反應”復習課的教學過程,從活動設計要凸顯學科觀念、課堂教學要凸顯生本理念、學情反饋要凸顯多元理念等方面對復習課的教學進行了自我反思。
關鍵詞:學科觀念;教學設計;復分解反應
文章編號:1008-0546(2020)06-0026-04 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2020.06.007
一、課標要求與學情分析
“復分解反應”是初中化學教學中的一個核心概念,是四種基本反應類型之一。《義務教育化學課程標準(2011年版)》對“復分解反應”的教學要求是:“初步認識常見的化合反應、分解反應、置換反應和復分解反應,能用于解釋日常生活中的一些化學現象”。
通過新授課階段的學習,學生已明晰了復分解反應的概念,知曉了復分解反應的規律,知道了復分解反應在日常生活中的一些應用。但學生對復分解反應僅是淺層次的認識,主要表現為:
一是僅關注具體反應,未形成知識體系。對復分解反應的認識,大多數學生僅停留在具體物質這一層面,尚未能運用“分類觀”認識復分解反應,不清楚復分解反應通常發生在哪些類別的化合物之間。
二是僅關注宏觀現象,未認識微觀本質。學生往往是從“宏觀物質”角度來認識復分解反應,只知道借助反應規律判斷反應能否發生,但對物質的微觀構成及復分解反應的微觀本質認識不足,對反應為何能發生仍心存疑惑。
三是僅關注絕對沉淀,未理解相對沉淀。學生普遍認為復分解反應中的“沉淀”就是“不溶物”,尚未能關注到溶液狀態(即飽和、不飽和)對溶質溶解情況的影響,比如對“侯氏制堿法”的原理極為困惑:“NH4HCO3為什么能與NaCl反應生成NaHCO3和NH4Cl呢?生成物中沒有沉淀啊?”另外,學生一般也難以關注到溶劑種類對溶質溶解情況的影響。
二、教學目標
通過“物質類別的判斷”“尋找復分解反應案例”“建構酸堿鹽的網絡”“建構復分解反應網絡”等活動,運用“分類觀”再識復分解反應的概念。
通過“建構復分解反應離子網絡圖”“運用復分解反應離子網絡圖解決問題”“尋找實驗背后的微觀原因”等活動,能運用“微粒觀”揭示復分解反應的實質。
通過“分析液氨中的復分解反應”“分析實驗室模擬侯氏制堿法生產的原理”等活動,能運用“變化觀”認識復分解反應的規律。
三、課堂實錄
1.課堂引入
[師]同學們,我們首先來看兩段文字(課件展示):“學生能否牢固地、準確地、哪怕只是定性地建立起基本的化學觀念,應當是中學化學教學的第一目標。背誦或記憶某些化學知識,當然是有價值的,但是更重要的價值在于它們是化學觀念及某些基本觀念的載體。”這是著名化學教育家、清華大學宋心琦教授的一段論述。“沒有基本觀念統領的知識教學是把‘種子磨成‘面粉的教學。”這是著名特級教師的程同森的觀點。
兩段文字都是面向教師闡述如何進行教學的。如果換個角度來看的話,這其實也是對同學們的學習進行了提醒:學科知識固然重要,但它終究只是“面粉”,要重視學科觀念的建立,因為“種子”才具有強大的生命力。
今天我們就從化學觀念的視角,重新來認識我們所熟悉的復分解反應。首先,從分類觀的視角,研究復分解反應通常發生在哪些類別的化合物之間。
2.學習活動
活動一、用“分類觀”再識復分解反應的概念
1.現有CuO、CO2、HCl、Ca(OH)2、Na2CO3、CaCl2等六種物質。
(1)請判斷它們的物質類別,并將化學式填寫在表1相應位置。
CuO CO2HCl Ca(OH)2Na3CO3CaCl2
[生]獨立完成子活動1,并匯報學習成果。
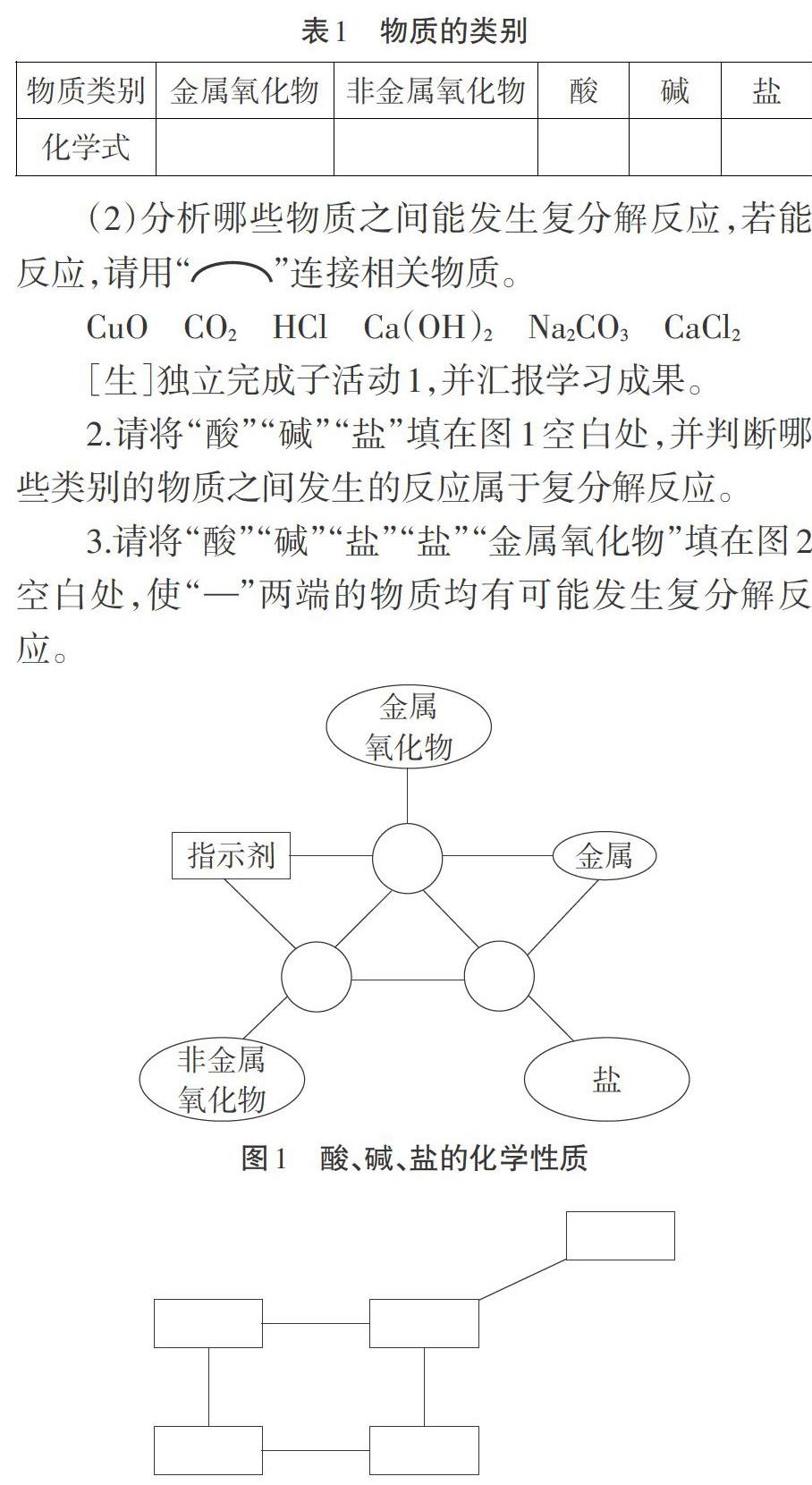
2.請將“酸”“堿”“鹽”填在圖1空白處,并判斷哪些類別的物質之間發生的反應屬于復分解反應。
3.請將“酸”“堿”“鹽”“鹽”“金屬氧化物”填在圖2空白處,使“一”兩端的物質均有可能發生復分解反府。
說明:圖1、圖2中,“—”兩端的物質之間均能發生化學反應。
[生]子活動2、3的學習流程為:自主學習→合作探究→成果展示→自我完善(以下難度較大的問題,學生學習的流程與此處基本相同;為節省篇幅,不再重復表述)。
[師]通過“常見的復分解反應”這張圖,我們可以看出來,初中階段常見的復分解反應主要發生在這樣五組物質之間:酸和金屬氧化物、酸和堿、酸和鹽、堿和鹽、鹽和鹽。
[師]借助于這個網絡圖,我們可以快速判斷物質之間是否有可能發生復分解反應。請判斷下列幾組物質能否發生復分解反應:①氧化銅與氫氧化鈉、②氧化銅與氯化鈉、③二氧化硫與氫氧化鈉。
[生1]②③
[師]提醒學生結合網絡圖及復分解反應的概念對③重新分析。
[師]剛才我們是從宏觀角度進行研究的,如果從微觀角度來看的話,物質發生復分解反應時,會互相交換離子,生成氣體、水或沉淀,那么哪些離子之間能結合成氣體、水或沉淀呢?
活動二、用“微粒觀”揭示復分解反應的本質
[生]完善圖3(有困難的學生可結合“部分酸、堿和鹽的溶解性表”),并匯報學習成果。
2.請結合復分解反應離子網絡圖分析下列問題。
(1)農業上,為什么不能將NH4Cl、NH4NO3等銨態氮肥與堿性物質混放或混用?
(2)從海水得到的粗鹽中含有MgCl2、CaCl2等可溶性雜質,可通過加入哪些試劑除去這兩種雜質?
[生]結合圖3,思考子活動2的兩個問題,匯報學習成果。
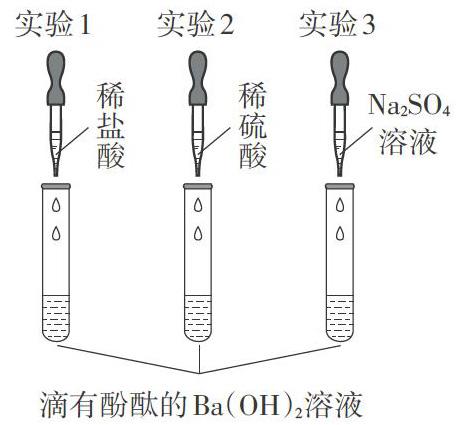
[師]接下來我們準備做三個小實驗(如圖4),請大家首先預測實驗現象,可以結合網絡圖,也可以結合化學方程式進行預測。
3.根據圖4所示實驗回答下列問題。
[生]預測并闡述實驗現象,三名學生分別演示三個實驗。
[師]三個實驗不但宏觀可見的現象存在差異,通過儀器測定,實驗過程中的溶液的導電性、pH等指標變化情況也是不同的,請同學們從微觀的角度分析產生這些差異的原因。
(1)圖5、圖6分別為實驗1、實驗2所發生反應的微觀模擬圖,請結合圖形分析實驗1、實驗2現象異同的原因(現象見表2)。
(2)請預測進行實驗3時所能觀察到的現象,并從微觀角度進行解釋。
(3)實驗2、實驗3中,溶液導電性的變化情況如圖7所示,圖中曲線A表示的是哪個實驗中溶液導電性的變化?為什么?
[生]結合圖4-7,思考子活動3的相關問題,匯報學習成果。
[師]對學生答題情況進行分析。
[師]剛才我們從微觀角度研究了復分解反應,知道了反應的微觀實質是:離子之間互相結合成氣體、水或沉淀,使得溶液中的某些離子濃度減小。接下來我們重新回到宏觀世界,一起來研究復分解反應的規律。
活動三、用“變化觀”認識復分解反應的規律
1.已知t℃時四種化合物在水中及液氨中的溶解度如表3:
請判斷Ba(NO3)2和AgCl在以液氨為溶劑的溶液中能否發生復分解反應?為什么?
2.實驗室模擬侯氏制堿法生產原理的主要過程為:①20℃時,向濃氨水中通人足量的二氧化碳得到NH4HCO3飽和溶液;②向NH4HCO3飽和溶液中加入食鹽細粒,并不斷攪拌,直到NaHCO3結晶析出完畢;③將析出的晶體過濾,得到晶體和濾液,洗滌晶體,然后將晶體放在試管中充分加熱,得到Na2CO3。
[生]思考子活動1、2的相關問題,匯報學習成果。
[師]對學生答題情況進行點評。
[師]通過活動三我們可以體會到,溶劑種類會影響復分解反應中沉淀的形成,另外沉淀不一定是不溶物,也可以是可溶物達到飽和后析出的晶體。可以說,反應條件是化學變化的靈魂所在,控制變化的條件,可以使化學變化向著人們希望的方向進行。
3.盤點收獲
學生從分類觀、微粒觀、變化觀的角度,簡單分析學習收獲。
4.課堂反饋
學生完成下列三道試題,對學習效果進行評估。
1.下列物質中能與Na2CO3在溶液中大量共存的是()
A.HCl B.BaCl2C.KOH D.KNO3
2.請選擇合適的試劑,完成下列實驗。
3.為理解稀鹽酸和氫氧化鈉兩者之間發生反應的微觀實質,某同學繪制了下圖,請完善此圖。
四、教學反思
1.復習課活動設計要凸顯學科觀念
要以學科思想為指導設計復習課的學習活動,重視化學學科觀念的培育以及學科思維能力的提升。本節課的設計以學科觀念為主線,將學生已經具備的知識作為啟發思維、形成觀念的“種子”,學生在分析和解決問題過程中,經歷了知識的激活、深化、綜合、運用,加深了對分類觀、微粒觀、變化觀等基本觀念的認識,發展了“宏觀辨識和微觀探析”“證據推理和模型認知”等學科核心素養。
2.復習課課堂教學要凸顯生本理念
復習課的課堂,要盡一切可能讓每個學生參與活動全過程,想方設法讓不同層次學生的學習能力和學業水平在原有基礎上實現突破。本節課實施過程中,大部分問題的解決都經歷了“自主學習→合作探究→成果展示→自我完善”的學習過程。課堂上,學生時刻處在積極主動的學習狀態之中,在多樣態的互動中實現了深度學習,進一步完善了知能結構、豐富了認知角度、提升了認識高度。
3.復習課學情反饋要凸顯多元理念
對復習課的學習效果進行評估時,可以采取口頭作答、實驗操作、紙筆測試等相結合的多元反饋。在“課堂反饋”環節可通過終結性的紙筆測試了解一節課的學習效果,試題應分層設計,以兼顧不同層次學生的需求,如本節課用于課堂反饋的三道試題中,第1、2兩題面向全體學生,第3題則是面向學習基礎較好的學生設計的。

