從氫氧化鋁的溶解談中學化學素養養成
劉水秀
摘 要:本文分析了Al(OH)3沉淀形成條件、Al(OH)3在酸堿溶液中的溶解條件,從理論計算角度研究工業沉鋁生產條件的選擇,探討優秀化學思維品質和良好化學思維習慣的培養思路,以及中學生化學學科素養的養成途徑。
關鍵詞:沉淀 溶解 酸性 酸度 學科素養 思維品質 思維習慣
中圖分類號:G633.8 文獻標識碼:C 文章編號:1672-1578(2016)09-0154-01
中學化學教學實踐中,大部分教師都會給學生“灌輸”這樣一個結論:“氫氧化鋁沉淀能溶于強酸或強堿溶液中,難溶于弱酸或弱堿溶液中”,并由此衍生出一系列的習題和解析,以高強度的重復刺激進行有效強化。在應試教育背景下,這樣的強化貫穿于整個中學化學教學過程,類似的“規律”成了中學化學課堂的重點分析對象和學生解題的金鑰匙,毋庸置疑,這種指向性高度集中的強化教學效果相當突出,師生們在各種階段性測試和綜合性測試中屢試不爽,樂此不疲,但終究我們會發現,生搬硬套可以換來輝煌的成績,卻換不來學生受益終身的能力。我們傳播科學,同時也在不斷制造科學性錯誤;我們強調化學是實驗科學,卻常常拋開實驗事實在傳遞無知。培養學生良好的化學素養,應該是培養學生正確的化學思維方式,引導學生理解正確的化學分析方法,積極完善化學理論分析、化學實踐應用的能力與習慣。
事實上,酸的酸性與溶液的酸性根本就是兩個問題,弱酸溶液的酸性在一定條件下完全有可能比強酸稀溶液更強,決定Al(OH)3沉淀能否溶解的,是溶液的酸度而不只是酸的強度。當強酸的濃度較小時,其酸度可能并不足以溶解Al(OH)3,而當弱酸的濃度較大時,其酸度亦有可能達到溶解Al(OH)3的條件。堿溶液中的情況類似。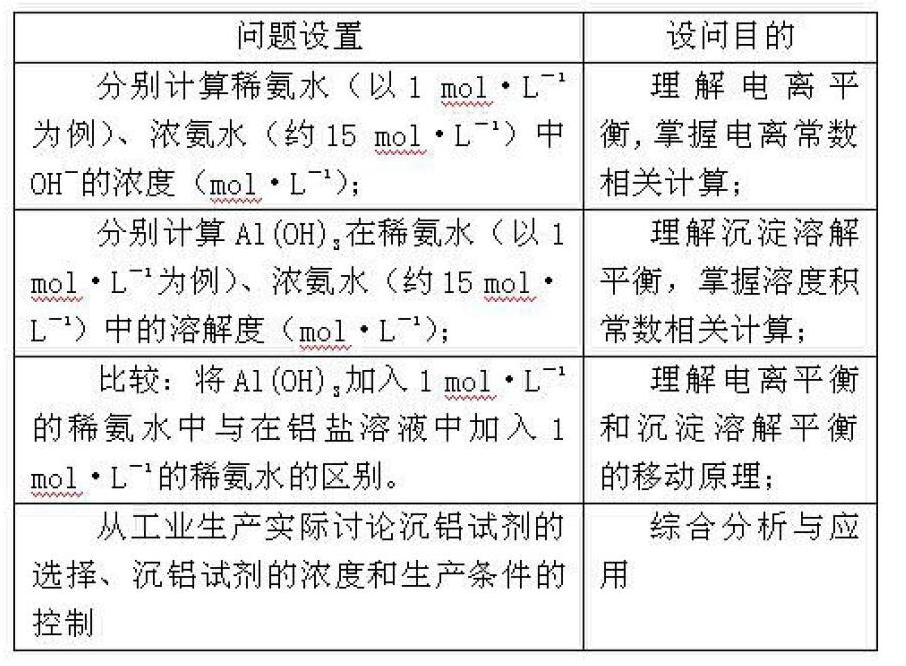
理論計算說明,當弱酸水溶液中c(H+)達到一定條件時,就能部分溶解甚至完全溶解Al(OH)3;而當強酸被稀釋到一定程度時(pH>4.7),則不能溶解Al(OH)3。利用相同的方法可以計算堿性條件下Al(OH)3開始溶解和完全溶解所需的理論pH范圍、部分弱堿溶液濃度與pH值的關系,同樣可以說明,Al(OH)3能部分溶解于一定濃度的濃氨水中。上述結論均可以通過實驗證實。
可見,就Al(OH)3的溶解條件而言,撇下環境與條件的任何結論或“規律”都可能存在明顯的科學性錯誤,也毫無實際應用的價值和意義,科學的化學思維方式應當是明確沉淀的形成條件與溶解條件,結合弱電解質電離平衡和沉淀溶解平衡原理進行理論分析,根據科學計算結果判斷Al(OH)3的沉淀情況和溶解情況,最后通過相關化學實驗事實進行結論確證。
就學習而言,一個問題的解決往往伴隨著一個新問題的產生,學生正是在“解決問題——發現新問題——研究新問題——解決新問題”的分析過程中,不斷完善自身知識結構并逐漸提高學科能力水平,這是一個波浪式前進、螺旋式上升的過程。因此,當學生深刻理解了Al(OH)3的形成條件和溶解條件之后,必然會思考實際生產流程中沉鋁試劑的選擇,必然會對鋁鹽用氨水沉鋁的合理性持懷疑態度,這種情況下,以科學的探究獲得一個合理的解釋成為消除疑惑的唯一選擇。具體操作上,考慮到學生知識儲備和綜合能力的局限性,可以嘗試將一個綜合問題合理地分解為若干局部問題,化整為零,引導學生主動應用化學原理逐個擊破。問題設置及目的如下表:
分析結果表明,Al(OH)3在濃氨水中的溶解度原本就不大(微溶),實際生產過程中可以綜合各方面因素選擇合適的氨水濃度,再加上沉鋁過程中氨水反應后產生大量的NH4+抑制了NH3·H2O的電離,因而沉鋁過程中Al(OH)3的溶解程度其實相當小,完全可以忽略。
在這一系列問題的分析過程中,化學原理和化學方法僅僅是工具,決定解決什么問題、選擇什么工具、怎么使用工具的,是學習者的自主原發動機,解決問題的過程是學習者的獨立行為,學習者獲得的能力,不再是簡單的重復和機械的再現,而是融合了學科經驗、人生積累的高級加工與綜合應用能力,是影響學習者終身學習能力與個人發展成就的重要因素。由此可見,化學學科基本素養的培養是在循序漸進、環環相扣的問題研究過程中,重點培養學生研究問題和解決問題的方法和能力,培養學生利用化學原理和化學實驗研究化學問題的能力與習慣。優秀的化學思維品質和良好的思維習慣才是化學學科素養的核心。

