糖痛方對糖尿病神經病變大鼠坐骨神經自噬相關蛋白Beclin-1和LC3Ⅱ表達的影響
王明欣 田宇 朱曉云 王洪武 白文山 李鳴鏑


摘要:目的??觀察糖痛方對糖尿病周圍神經病變(DPN)大鼠坐骨神經自噬相關蛋白Beclin-1和LC3Ⅱ表達的影響,初步探討其作用機制。方法??雄性SD大鼠75只,隨機選取15只為正常組,其余60只采用2%鏈脲佐菌素誘導制作糖尿病大鼠模型,造模成功4周后,結合缺血再灌注制備DPN模型,成模大鼠隨機分為模型組和糖痛方低、中、高劑量組,每組15只,糖痛方低、中、高劑量組分別按成人6.25、12.5、25倍劑量給藥,正常組和模型組給予等量蒸餾水灌胃,每日1次,灌胃8周,Western blot和實時熒光定量PCR分別檢測大鼠Beclin-1、LC3Ⅱ蛋白和mRNA的表達,透射電鏡觀察坐骨神經超微結構。結果??與正常組比較,模型組大鼠Beclin-1、LC3Ⅱ蛋白和mRNA表達均升高,髓鞘腫脹、變性,板層分離;與模型組比較,糖痛方各劑量組大鼠Beclin-1和LC3Ⅱ蛋白和mRNA表達呈下降趨勢,以糖痛方中、高劑量組降低明顯,髓鞘變性程度減輕。結論??糖痛方可能通過抑制模型大鼠過度自噬,發揮對DPN大鼠的治療作用。
關鍵詞:糖痛方;自噬;糖尿病周圍神經病變;大鼠
中圖分類號:R285.5 ???文獻標識碼:A ???文章編號:1005-5304(2019)09-0065-04
Effects of Tangtong?Prescription on Expressions of Beclin-1 and LC3Ⅱ?in Diabetic Neuropathy Rats
WANG Mingxin1, TIAN Yu2, ZHU Xiaoyun1, WANG Hongwu2, BAi Wenshan1, LI Mingdi1
1. Guanganmen Hospital, China?Academy of Chinese Medical Sciences, Beijing 100053, China; 2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
Abstract: Objective To observe the effects of Tangtong?Prescription on beclin-1 and LC3Ⅱ?of autophagy related proteins in sciatic nerve of diabetic peripheral neuropathy rats; To preliminarily investigate its mechanism of action. Methods Seventy-five male SD rats were randomly selected, 15 for normal group, and other 60 rats were treated with intraperitoneal injection of STZ to build type 2 diabetic nice model. 4 weeks after modeling, diabetic peripheral neuropathy (DPN) model was prepared by combining with ischemia-reperfusion preparation of, the model of DPN rats were randomly divided into model group, and Tangtong?Prescription low-, medium- and high-dosage groups, with 15 cases in each group. Tangtong?Prescription low-, medium- and high-dosage groups were given medicine as 6.25, 12.5, 25 times of adult doses. The normal group and the model group were given the same amount of distilled water for gavage, once a day. After gavage for 8 weeks, Western blot and real-time fluorescent quantitative PCR were used to detect the expressions of Beclin-1 and LC3Ⅱ?proteins and mRNA, and the ultrastructure of sciatic nerve was observed by transmission electron microscope. Results?Compared with the normal group, expressions of Beclin-1 and LC3Ⅱ?protein and mRNA in the model group increased, with myelin sheath swelling and degeneration, and lamellar separation. Compared with the model group, expressions of beclin-1 and LC3Ⅱ?protein and mRNA showed a downward trend, and myelin degeneration was significantly reduced in Tangtong?Prescription medium- and high-dosage groups.?Conclusion Tangtong?Prescription may play a therapeutic role in DPN rats by inhibiting excessive autophagy in model rats.
Keywords: Tangtong Prescription; autophagy; diabetic peripheral neuropathy;?rats
![]()
糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是糖尿病最常見的慢性并發癥之一,該病發病機制復雜,迄今對DPN患者尚缺乏有效的治療方法[1]。糖痛方是中國中醫科學院廣安門醫院林蘭教授治療DPN的經驗方,多年臨床實踐表明其臨床療效較好[2-3]。課題組前期研究表明,糖痛方可明顯減少細胞間黏附分子-1、腫瘤壞死因子-α、過氧化物酶的高表達,并通過降低雪旺細胞凋亡率和Caspase-3、Caspase-9蛋白和mRNA的表達,提高Bcl-2蛋白及mRNA的表達,顯示出其具有抑制細胞凋亡、減弱神經組織的炎癥反應,提高DPN大鼠模型坐骨神經傳導速度的作用[4-8]。為進一步探討糖痛方治療DPN的可能機制,本實驗觀察糖痛方對DPN大鼠坐骨神經自噬相關蛋白Beclin-1和LC3Ⅱ表達的影響,為臨床應用提供一定的實驗依據。
1 ?實驗材料
1.1 ?動物
SPF級雄性SD大鼠75只,體質量160~180 g,北京維通利華實驗動物技術有限公司提供,動物許可號SCXK(京)2016-0011;飼養于中國中醫科學院廣安門醫院SPF級動物房,溫度18~25 ℃,相對濕度50%~80%,明暗周期12 h,自由攝食飲水。
1.2 ?藥物
糖痛方(黃芪30 g,桂枝10 g,白芍10 g,細辛3 g,土鱉蟲10 g,姜黃15 g,川芎10 g),飲片購自中國中醫科學院廣安門醫院中藥房,經水煎取汁濃縮,制成濃度為2.64 g/mL藥液。精蛋白鋅胰島素注射液,江蘇萬邦生化醫藥公司,規格400 IU/10 mL,批號030814。
1.3 ?主要試劑與儀器
鏈脲佐菌素(美國Sigma公司),水合氯醛(國藥集團化學試劑有限公司),磷酸鹽緩沖液(北京賽默飛世爾公司),注射用青霉素鈉(華北制藥股份有限公司),4%多聚甲醛溶液(北京索萊寶科技有限公司),HRP標記羊抗兔IgG(H+L,美國Jackson公司),HRP標記羊抗鼠IgG(H+L,美國Jackson公司BCA蛋白檢測試劑盒(北京康為世紀生物科技有限公司,批號02912E),HiFiScript cDNA第一鏈合成試劑盒(北京康為世紀生物科技有限公司,批號CW2569),QPCR試劑盒(美國Biosystems公司KK4601)。羅氏卓越型血糖儀(美國羅氏診斷公司),高速冷凍離心機(德國Hettich公司),DM-300生物顯微鏡(德國Leica公司),JEM-1400透射電子顯微鏡(日本電子株式會社),JY300C電泳儀(北京君意東方電泳設備有限公司),ChampGel 5000凝膠成像儀(北京賽智創業科技有限公司)。
2 ?實驗方法
2.1 ?糖尿病模型制作
75只SD大鼠適應性飼養1周,隨機選擇15只作為正常組,其余60只大鼠禁食不禁水12 h,次日使用pH 4.2檸檬酸鹽緩沖液配制濃度為2%鏈脲佐菌素溶液,按60 mg/kg體質量腹腔注射,72 h后血糖儀測量大鼠尾尖血糖,以持續隨機血糖>16.7 mmol/L作為糖尿病大鼠成模標準。正常組大鼠注射等量檸檬酸鹽緩沖液。造模期間,每2周測量1次尾尖血糖;對隨機血糖<16.7 mmol/L大鼠予以剔除;對隨機血糖>27 mmol/L大鼠,根據其血糖水平,予精蛋白鋅胰島素注射液1~4 U皮下注射,每日1次,維持血糖在19.4~25.0 mmol/L。
2.2 ?糖尿病周圍神經病變模型制作
糖尿病大鼠飼養4周后,將10 g水合氯醛用無菌水配制成100 mL溶液,錫箔紙包裹避光保存。參照文獻[5]方法造模,按4 mL/kg體質量腹腔注射麻醉大鼠,仰臥位固定鼠板上,消毒備皮后,沿右側腹股溝韌帶剪開長約2 cm切口,鈍性剝離股動脈,使用動脈夾于腹股溝水平處夾閉股動脈,再沿腹壁正中線切開長3 cm切口,鈍性剝離腹主動脈和右側髂總動脈,使用動脈夾先后于髂動脈分叉處下1 cm處夾閉右側髂總動脈,于髂腰動脈水平下0.5 cm處夾閉腹主動脈。鹽水紗布保護切口,使用紅外線燈使右后肢體溫保持35 ℃。3 h后恢復供血,逐層縫合肌肉、皮膚。術后大鼠腹腔注射8萬U/只青霉素鈉,連續3 d。正常組大鼠不予處理。
2.3 ?分組和給藥
術后7 d待大鼠傷口愈合后分組、給藥。60只DPN模型大鼠隨機分為模型組和糖痛方低、中、高劑量組,每組15只。糖痛方低、中、高劑量組分別按每日成人劑量6.25倍(9.17 g/kg)、12.5倍(18.33 g/kg)、25倍(36.67 g/kg)灌胃給藥,正常組和模型組給予等量蒸餾水灌胃。給藥體積均為1 mL/100 g,每日1次,連續8周。
2.4 ?檢測指標
2.4.1 ?Western blot檢測Beclin-1和LC3Ⅱ蛋白表達
大鼠腹腔注射10%水合氯醛麻醉,截取右側坐骨神經,RIPA蛋白裂解液勻漿,冰上孵育20 min,4 ℃、13 000 r/min離心20 min,取上清液。按照BCA蛋白定量試劑盒使用說明書進行操作,測定蛋白濃度。配制15%分離膠,濃縮膠濃度為5%,上樣,濃縮壓恒壓90 V,分離膠恒壓120 V,300 mA恒流轉膜60 min,將膜浸入5%BSA-TBST中,室溫放置1 h。用5%BSA- TBST稀釋一抗,4 ℃水平搖床孵育過夜。次日洗膜,TBST沖洗3次×10 min。用封閉液稀釋HPR標記的二抗,室溫孵育40 min,TBST沖洗3次×10 min,ECL曝光。
2.4.2 ?qRT-PCR檢測Beclin-1和LC3Ⅱ基因表達
按Trizol試劑盒說明提取總RNA,1.2%瓊脂糖凝膠電泳,反轉錄按HiFiScript cDNA第一鏈合成試劑盒說明書進行操作。反應體系:SYBR FAST QPCR Kit Master Mix(2×)5 μL,上游引物F(10 μmol/L)0.2 μL,下游引物R(10 μmol/L)0.2 μL,cDNA模版1 μL。PCR擴增條件:95 ℃、3 min;95 ℃、3 s;60 ℃、20 s,40個循環。引物設計見表1。
2.4.3 ?透射電鏡觀察坐骨神經超微結構
大鼠腹腔注射10%水合氯醛麻醉,截取右側坐骨神經。取1 mm3左右2.5%戊二醛固定,1%鋨酸后固定,乙醇丙酮梯度脫水,Epon812包埋,超薄切片,厚度為50~70 nm,乙酸雙氧鈾和枸櫞酸鉛雙染色,透射電鏡觀察有髓鞘神經纖維脫髓鞘及細胞質的病理改變并攝片,觀察有無損傷的細胞器(如線粒體的腫脹變性、自噬體等)。
3 ?統計學方法
采用SPSS 22.0統計軟件進行分析。計量資料以x(—)±s表示,組間比較釆用方差分析,組間兩兩比較用LSD法。P<0.05表示差異有統計學意義。
4 ?結果
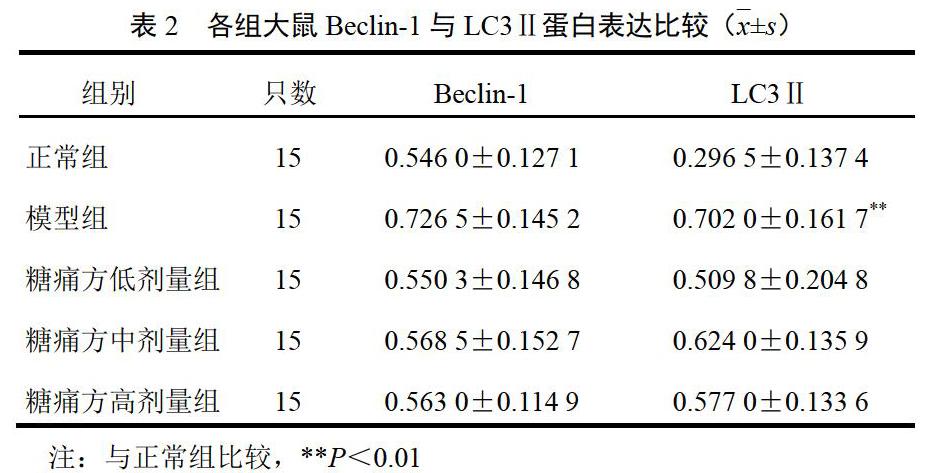
4.1 ?糖痛方對模型大鼠坐骨神經Beclin-1和LC3Ⅱ蛋白表達的影響
與正常組比較,模型組大鼠Beclin-1蛋白表達水平升高,差異無統計學意義(P>0.05),LC3Ⅱ蛋白表達水平顯著上升,差異有統計學意義(P<0.01);與模型組比較,糖痛方各劑量組大鼠Beclin-1和LC3Ⅱ蛋白表達均有下降趨勢,差異無統計學意義(P>0.05)。結果見圖1、表2。
4.2 ?糖痛方對模型大鼠坐骨神經Beclin-1和LC3Ⅱ基因表達的影響
與正常組比較,模型組大鼠Beclin-1和LC3Ⅱ?mRNA表達明顯升高,差異有統計學意義(P<0.05,P<0.01);與模型組比較,糖痛方各劑量組大鼠Beclin-1和LC3Ⅱ mRNA表達降低,其中糖痛方中、高劑量組Beclin-1明顯降低,差異有統計學意義(P<0.01)。結果見表3。
4.3 ?超微結構觀察結果
正常組大鼠坐骨神經髓鞘完整,髓鞘板層呈同心圓層狀排列,無變形、萎縮、分離;雪旺細胞及細胞核呈卵圓形,核仁明顯,染色質均勻;模型組大鼠坐骨神經髓鞘腫脹、變性,可見到板層分離,雪旺細胞細胞核為卵圓形,胞漿中可見空泡變性;糖痛方各劑量組大鼠坐骨神經髓鞘變性不同程度減輕,糖痛方低劑量組可見坐骨神經髓鞘變性和胞漿中空泡變性,但髓鞘板層排列整齊;糖痛方中劑量組坐骨神經髓鞘變性、輕微崩解,板層結構較完整,細胞核為卵圓形,胞質清晰、均勻;糖痛方高劑量組坐骨神經髓鞘腫脹,有部分崩解,但未見板層分離。結果見圖2。
5 ?討論
DPN以四肢遠端對稱性感覺和運動障礙,運動、感覺神經傳導速度減慢及髓鞘和軸突變性為特點。其病理顯示節段性脫髓鞘改變與雪旺細胞損害,同時伴有明顯的神經內膜微血管病。自噬是真核細胞通過降解自身細胞器和細胞質實現“自我消化”的過程[9-10],被稱為Ⅱ型程序性細胞死亡。凋亡與自噬在生化代謝途徑及形態學方面都有顯著區別。有研究顯示,自噬可保護細胞免于發生凋亡[11]。
Beclin-1是酵母自噬相關基因Atg6/Vps30的哺乳動物同源基因,參與自噬體形成的啟動過程,在自噬泡形成過程中起重要作用,其表達與自噬的發生正相關。LC3是自噬的標志性蛋白,真核細胞中有2種LC3:位于胞漿內LC3-Ⅰ在自噬相關酶的催化下發生反應,與自噬體膜表面的磷脂酰乙醇胺結合,轉化為LC3-Ⅱ,LC3-Ⅱ位于自噬體膜上,其表達與自噬體的數量呈正相關。
本研究采用課題組前期建立的DPN模型[5]。研究表明,當腦組織發生缺血再灌注損傷時,自噬水平上調[12-13]。本實驗結果顯示,與正常組比較,模型組大鼠坐骨神經Beclin-1和LC3Ⅱ的mRNA表達明顯升高,糖痛方干預后,Beclin-1和LC3Ⅱ?mRNA表達呈下降趨勢。Beclin-1和LC3Ⅱ mRNA表達升高提示自噬活動旺盛,其水平回降提示自噬活動趨于平穩。自噬是把雙刃劍,既可在生理情況下對細胞內殘損的細胞器、錯誤折疊的蛋白質進行降解重吸收,保證細胞內環境穩定,提高能量利用率,減少細胞的凋亡;又可在病理性亢進下過分激活,導致整個細胞被溶解死亡[14-16]。本實驗結果顯示,與自噬呈正相關性的Beclin-1及LC3Ⅱ,在高血糖環境下大鼠坐骨神經中含量顯著升高,糖痛方干預后,可降至接近正常水平,表明糖痛方能調節細胞自噬活動。
綜上所述,糖痛方可通過調節細胞自噬,提高細胞內“垃圾”代謝的效率,抑制細胞凋亡,從而起到治療DPN及其并發癥的作用。
參考文獻:
[1] 饒瀟瀟,姚廣濤,文小平.中藥干預糖尿病周圍神經病變作用機制研究進展[J].中國中醫藥信息雜志,2017,24(4):130-133.
[2] 李鳴鏑,林蘭,孫書臣,等.中藥糖痛方外洗治療糖尿病周圍神經病變的臨床觀察[J].中國康復理論與實踐,2009,15(6):553-555.
[3] 玉山江,林蘭.糖痛方內服外洗合彌可保治療糖尿病周圍血管神經病變臨床研究[J].中國中醫藥信息雜志,2003,10(3):13-15.
[4] 黃達.糖痛方治療糖尿病血管神經病變的臨床與實驗研究[D].北京:中國中醫科學院,2014.
[5] 黃達,李鳴鏑,鄭亞琳,等.糖痛方對糖尿病大鼠肢體缺血再灌注后肝腎ICAM-1和MPO表達的影響[J].醫學研究雜志,2014,43(8):37-40.
[6] 鄭亞琳,李鳴鏑,林蘭.糖痛方對施萬細胞凋亡及Bcl-2、caspase-3、caspase-9表達的影響[J].醫學研究雜志,2014,43(11):39-42.
[7] 林蘭,鄭亞琳,李鳴鏑,等.糖痛方及其有效成分對高糖培養的施萬細胞增殖的影響[J].醫學研究雜志,2013,42(9):44-47.
[8] 劉曉星,朱曉云,韋茂英,等.糖痛方對高糖誘導RSC96細胞凋亡與增殖的影響[J].中國中醫藥信息雜志,2017,24(10):49-52.
[9]?CHATURVEDI A, PIERCE S K. Autophagy in immune cell regulation and dysregulation[J]. Current Allergy and Asthma Reports,2009, 9(5):341-346.
[10] 任安立,李靖凱,周冬冬.程序化細胞死亡因子5對缺氧/復氧誘導的心肌細胞凋亡和自噬的影響及機制[J].中國病理生理雜志,2017,33(2):251-256.
[11]?KOVACS A L, HONG Z. Role of autophagy in Caenorhabditis elegans[J]. Febs Letters,2010,584:1335-1341.
[12] 朱麗娟,羅建云,張安平,等.當歸揮發油通過抑制自噬減輕擬缺血再灌注神經細胞損傷[J].中藥藥理與臨床,2017,33(4):56-59.
[13] ZHAO Y N,GUO X F,LI J M,et al. mTOR/autophagy pathway in the hippocampus of rats suffering intermittent hypoxia preconditioning and global cerebral ischemia-reperfusion[J]. Oncotarget,2017,8(14):23353-23359.
[14] 孫曉偉,高營,王新宇,等.針刺對腦缺血再灌注損傷神經細胞自噬影響的研究概況[J].中醫藥信息,2019,36(2):122-126.
[15] CHEN Y, KLIONSKY D. The regulation of autophagy-unanswered questions[J]. Joural of Cell Science,2011,124(2):161-170.
[16] 項冰倩,高慧,CHEN J H,等.RXR介導的自噬通路在大鼠肺缺血/再灌注損傷中的調控作用[J].中國病理生理雜志,2018,34(11):2054-2061.

