以學生為主的探究式教學的實踐和思考
錢琳璐


摘要:初三復習課中,大多教師以習題鞏固知識點,學生常深陷“題海”無法自拔,缺少對化學在生活應用的關注和親身實踐。“碳酸鈉和碳酸氫鈉”在生活中應用廣泛,課堂中引導學生設計實驗,幫助學生理解碳酸鈉和碳酸氫鈉的化學性質及生活應用,提高學生的綜合能力。
關鍵詞:碳酸鈉;碳酸氫鈉;化學性質:探究式教學
文章編號:1008-0546( 2022 )11x-0063-03
中圖分類號:G632.41
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2022.11x.016
一、教學現狀分析
初三化學復習課堂上大多數教師采用的復習方式是:以章節為單位,羅列知識點,強調重難點,剖析重點題型,歸納解題方法,鞏固習題應用。這樣的復習容易造成教師的“一言堂”,課堂中學生主要是“聽”“記”“做”,讓學生感覺枯燥無味,不利于學生對知識點的掌握,更不利于學生能力的發展。
“鹽”的知識與學生的生活聯系密切,同時在初中化學中占有重要的地位,是初中階段化學教學中的重點和難點。在初步學習過程中,學生做的實驗大部分是驗證性實驗,獲得的往往是零散的事實性知識,沒有形成知識網絡,無法從整體上掌握知識,學生遇到復雜多變的問題會無從下手。“鹽的復習”一課從學生熟悉的情境引入,激發學生探究興趣,設置問題引導學生用所學的知識去多角度認識物質。
二、教學流程
在酸、堿、鹽的復習時,大多數教師將其所在的單元揉合在一起,包含了物質性質、物質用途、物質之間的轉化、實驗探究、化學反應原理等,涵蓋知識多,能力要求強。[1]本節課只以“鹽”為主題進行復習,結合實驗,從定性到定量,從量變到質變,將實驗現象深度剖析,夯實基礎、提升思維,培養學生的創新意識。碳酸鈉與碳酸氫鈉在日常生活中應用非常廣泛,但人教版教科書中對其性質沒有詳細介紹,本節課從生活實例引入,激發學生探究興趣,學生自主設計實驗、歸納性質,總結蘇打、小蘇打在生活中的用途,最后復習侯氏制堿法,培育學生文化自信。教學流程見圖1。
三、教學實錄
環節I:洗“蔬菜、水果”
[導入新課]生活中我們食用的蔬菜、水果表面有農藥殘留,比如:抗菌劑401、乙烯利水劑、有機磷酸酯等。[2]那我們怎樣清洗呢?
現場用同濃度的食用堿(主要成分碳酸鈉)、食用小蘇打(主要成分碳酸氫鈉)溶液清洗桃子。
[生]用食用堿溶液清洗的桃子表面會變色,而小蘇打溶液中的桃子沒有明顯現象。
設計意圖:通過生活實例引入,貼近學生的生活,真實的情境能引發學生思考,更能激發學生的探究興趣。
環節Ⅱ:識“碳酸鈉、碳酸氫鈉”
[展示信息]
1.抗菌劑401、乙烯利水劑、有機磷酸酯等農藥的溶液顯酸性。[2]
2.桃子富含花青素,花青素的顏色隨溶液酸堿性變化而變化。
[生]蔬菜、水果表面的酸性農藥可以用堿性溶液去除,而碳酸鈉、碳酸氫鈉的溶液呈堿性。
[師]那為何現象不同呢?
[生]兩者溶液的堿性強弱不同。
[學生活動1]用pH試紙和pH計比較相同濃度碳酸鈉與碳酸氫鈉溶液的堿性。
[生]相同濃度時,碳酸鈉溶液的堿性更強。因為碳酸鈉堿性強,所以使花青素變色。
設計意圖:結合生活實例,激發學生好奇心,通過實驗調動學生學習的積極性,培養學生的實驗操作能力,讓學生獨立自主發現真相得出結論。
[過渡]碳酸鈉、碳酸氫鈉從外觀上無法區分,那有什么途徑可以分辨它們?
[材料閱讀]碳酸鈉是一種無機鹽。其水溶液呈堿性,可使酚酞變紅。能與酸發生復分解反應,也能與一些鈣鹽、鋇鹽發生復分解反應。以鹽酸為例,當鹽酸足量時,生成氯化鈉、二氧化碳和水。
碳酸氫鈉是一種無機鹽,水溶液為堿性。常溫下性質穩定,受熱易分解,加熱至270℃完全分解,產生碳酸鈉、二氧化碳等。遇酸則強烈反應產生二氧化碳。除此之外,還能與某些鹽反應,如,與鈣鹽反應,濃度較小的碳酸氫鈉反應生成能溶于水的碳酸氫鈣,但當碳酸氫根離子達到一定濃度時,溶解在水中的碳酸氫鈣就會分解,Ca(HCO3)2==CaCO3↓+CO2↑+H2O。
設計意圖:通過材料閱讀的方式,給學生創建自主整理信息、思考分析的平臺,提高學生閱讀理解的能力,培養學生從理論到實踐的意識。
[學生活動2]比較碳酸鈉、碳酸氫鈉與酸的反應。
[師]請同學們寫出碳酸鈉、碳酸氫鈉與稀鹽酸反應的化學方程式。
[引導]定性無法區分,那么定量呢?
[生]通過計算,比較相同質量碳酸鈉、碳酸氫鈉與足量鹽酸反應,碳酸氫鈉生成CO2的質量更多。
[學生實驗]稱量1g的碳酸鈉、碳酸氫鈉加入氣球中,氣球套在有足量稀鹽酸的錐形瓶上,然后,同時將固體倒入稀鹽酸。
[生]根據氣球鼓起的大小比較生成氣體的多少。
[生]裝有碳酸氫鈉的氣球好像更大,但不是非常明顯。
[師]那除了比較生成二氧化碳的質量,還可以比較什么呢?
[生]根據資料和剛才的實驗現象還可以比較兩者生成二氧化碳的速率。
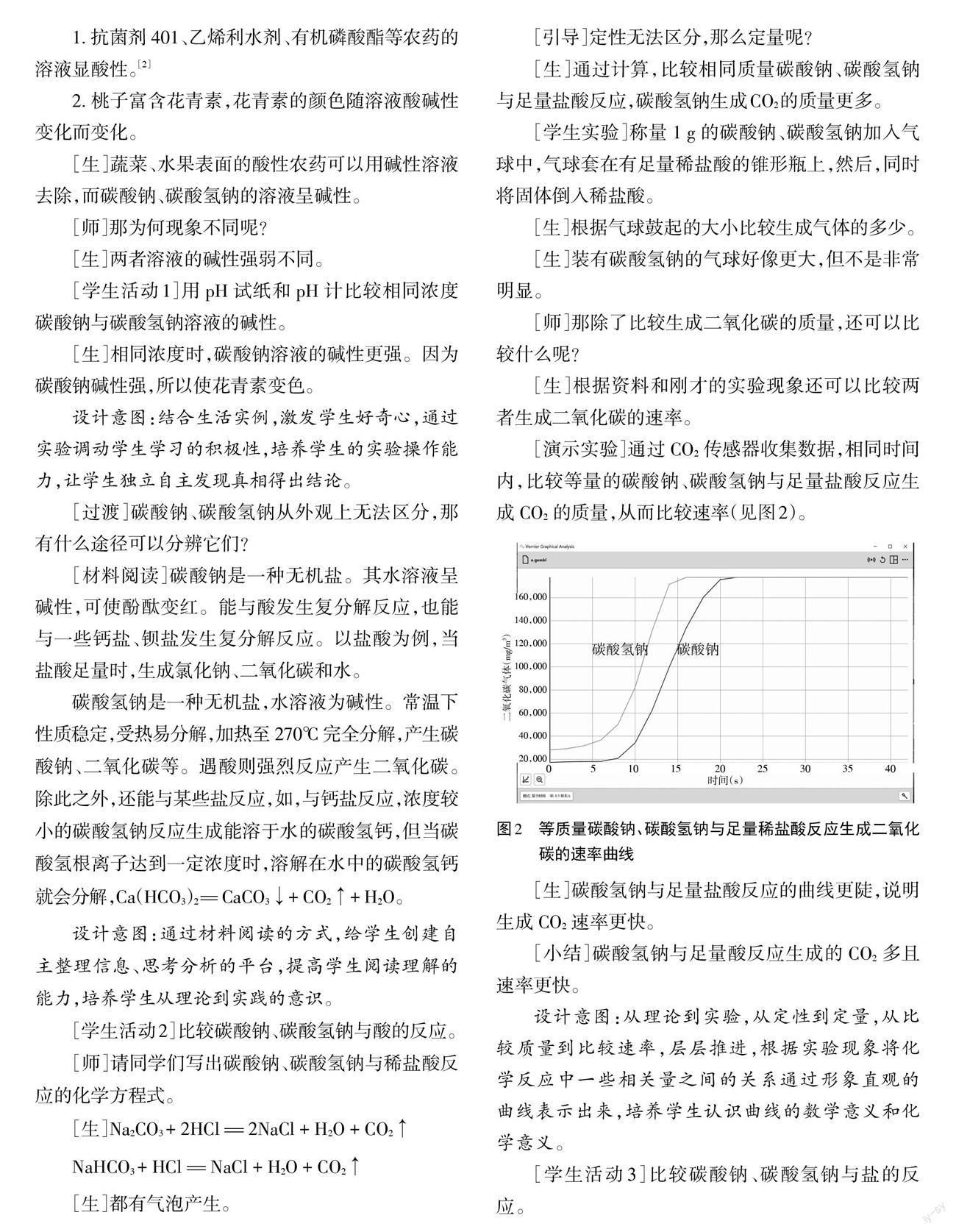
[演示實驗]通過CO2傳感器收集數據,相同時間內,比較等量的碳酸鈉、碳酸氫鈉與足量鹽酸反應生成CO2的質量,從而比較速率(見圖2)。
[生]碳酸氫鈉與足量鹽酸反應的曲線更陡,說明生成CO2速率更快。
[小結]碳酸氫鈉與足量酸反應生成的CO2多且速率更快。
設計意圖:從理論到實驗,從定性到定量,從比較質量到比較速率,層層推進,根據實驗現象將化學反應中一些相關量之間的關系通過形象直觀的曲線表示出來,培養學生認識曲線的數學意義和化學意義。
[學生活動3]比較碳酸鈉、碳酸氫鈉與鹽的反應。
[引導]同學們要注意實驗細節,控制變量。
[學生實驗]選擇不同濃度(0.1%、1%、5%)的等量的碳酸鈉、碳酸氫鈉分別與氯化鈣反應,觀察實驗現象。
[生]0.1%、1%、5%的等量的碳酸鈉與氯化鈣反應,都有白色固體產生。
[生]因為生成的CO2少,且CO2能溶于水、與水反應,所以氣泡不明顯。
[小結]不同濃度的等量的碳酸氫鈉與氯化鈣反應有不同的現象產生,量變會導致質變。
設計意圖:引導學生從實驗細節著手,建立量與質的關系,打破學生固定思維,提高學生邏輯分析能力;幫助學生從多角度設計實驗,提高學生思考能力和實驗探究能力,讓學生感受實驗的魅力。
[學生活動4]比較碳酸鈉、碳酸氫鈉的穩定性。
[學生實驗]分別加熱等質量的碳酸鈉、碳酸氫鈉固體。
[生]加熱碳酸氫鈉固體,小試管中內壁有小水珠,產生氣體能使澄清石灰水變渾濁,而加熱大試管中碳酸鈉固體沒有明顯現象。
2NaHCO=△=Na2CO3+CO2↑+H2O
[小結]碳酸氫鈉受熱可分解,而碳酸鈉受熱不分解,穩定性更強。
環節Ⅲ:賞“蘇打、小蘇打”
[師]碳酸鈉、碳酸氫鈉的俗稱是什么?
[生]碳酸鈉俗稱純堿、蘇打,碳酸氫鈉俗稱小蘇打。
[小組討論]生活中蘇打與小蘇打的用途。
[生]蘇打可用于玻璃、肥皂等生產,小蘇打可去油污用作清潔劑,還可用于治療胃酸過多。
[生]蘇打、小蘇打還是廚房中常見的食品添加劑。
[小結]碳酸鈉是重要的化工原料之一,在建材、化學工業、食品工業、冶金、紡織、醫藥等領域有廣泛用途。碳酸氫鈉可作為制藥工業的原料,用于治療胃酸過多;在食品加工中,是一種常見的膨松劑,用于生產餅干、面包等。
設計意圖:從性質過渡到生活用途,再到生產。將冷冰冰的化學藥品回歸學生生活,從陌生再到熟悉,再次調動學生學習積極性,感受化學與生活的密切聯系。
環節Ⅳ:制“純堿”
[過渡]碳酸鈉、碳酸氫鈉在生產生活中用途如此廣泛,我們又該如何獲取呢?
[生]“夏天曬鹽,冬天撈堿。”從鹽堿湖中撈取純堿。
[師]原理是什么?
[生]碳酸鈉的溶解度隨溫度的升高而增大,在冬天溫度降低,大量固體析出沉淀。
[師]隨著人們生活水平的逐漸提高,自然的饋贈不能完全滿足我們的需求。
[視頻展示]侯氏制堿法。
[小組討論]根據流程圖,分析侯氏制堿法的過程及原理。
[師生交流]1.整個流程中涉及了哪些反應?試著寫出反應方程式。
2.飽和食鹽水中為什么先通氨氣,后通二氧化碳?(從氣體溶解性角度出發)
3.碳酸氫鈉為何是沉淀?(觀察常溫下固體溶解度)
設計意圖:人教版第十一單元課題1“生活中常見的鹽”中“資料卡片”部分有“我國制堿工業的先驅——侯德榜”內容,讓學生了解我國化工史,培育學生文化自信。
四、教學反思
本節課摒棄傳統復習課的教學模式,充分發揮實驗在教學中的作用,做到了學生自主學習、自主探究、自主交流,調動了學生的積極性。學生從理論到實踐.多角度思考問題,從定性到定量,從量變到質變,將化學知識與生活實際、化工生產等有效結合。在復習課中能夠實現夯實基礎、提升能力、發展核心素養的多重效果。
以學生為主的探究式教學模式重在使學生體驗化學學習的樂趣,培養學生的化學學習能力,進而在生活中發現化學,在化學中感受生活。教師嘗試用不同的教學模式將學生從“題海”中解救出來,擺脫復習課的“無奈”感、“枯燥”感、“疲憊”感。將課堂交給學生,以學生為主的探究式教學可以提高化學復習課的效率,也可以更好地提高學生綜合素養。
參考文獻
[1]艾進達,基于化學核心素養的“酸堿鹽”復習案例[J].中學化學教學參考,2018(9):61-63.
[2]馬德清,王念平,員玲等.農藥合理混用技術[J].新疆農業科技,2007(1):36-37.

