基于WWHW化學教學模式的教學設計
黎耀中 唐靜 張小麗


【摘 要】本文以高中化學重要的理論性知識—— 電解池為例,基于WWHW教學模式,以化學知識的本質來源為依據,從學生認知理論出發進行教學設計,提出根本上轉變教學形式、構建模型認知、促進學生化學核心素養的培養等策略。
【關鍵詞】WWHW教學模式 教學設計 電解池
【中圖分類號】G ?【文獻標識碼】A
【文章編號】0450-9889(2021)02-0094-04
2016年9月教育部正式公布《中國學生發展核心素養》,《普通高中化學新課程標準(2017年版)》隨之提出5個維度的化學學科核心素養,特別指出教師可以通過改變學生的學習方式來落實化學學科核心素養。學生化學學科核心素養的養成是一個自我建設和不斷提高的過程,教師要引導學生積極開展建構性學習、問題解決性學習等,促進學生學習方法的轉變。
一、WWHW教學模式的含義
WWHW是一種基于知識認識論的教學模式,注重對教材知識的認知和拓展,迎合學生的認知規律。W(Why)指“為什么要研究該知識?目前遇到哪些問題需要本節課的知識來解決?”W(What)指“本節知識點的本質是什么?包含哪些內容?”H(How)指“如何研究本節內容?從哪些角度進行研究?”W(What)指“本節知識能夠解決日常生活、生產工藝等哪些方面的問題?有什么樣的價值?”
然而,學生的認知水平主要是基于教師的認知理念,取決于教師教學方法的變換,傳統的教學認知主要關注“知識是什么”“有什么作用”。本文基于WWHW教學模式,從教師的認知理論出發,提出要從根本上改變教師的教學形式、改變學生的學習方式,以促進學生化學核心素養的培養。
二、基于WWHW教學模式的案例設計
(一)為什么要研究電解池
【觀看科學小當家(視頻)】
某些上門推銷凈水器的人員,用自來水和該公司經過凈水器凈化的“純凈水”做實驗(自來水可看作礦物質水)(見圖1),他們使用一根鐵棒作為陽極,一根鋁棒作為陰極,插入自來水并連接電源,幾分鐘后發現自來水中形成了令人觸目驚心的黃棕色沉淀,消費者看到日常飲用的自來水中居然含有如此令人惡心的物質,便產生了解和購買凈水器的興趣。
【創設情境】“凈水器”推銷騙局,并提出問題
問題1:推銷員做的實驗其原理是原電池原理嗎?你還記得原電池的知識嗎?
問題2:自來水怎么就不能喝了呢?
設計意圖:創造一個與水密切相關的情境,讓學生感受身邊的化學;水的電解是初中就已有的知識,學生對新知識的學習充滿期待,想要揭露凈水器的騙局;樹立嚴謹的科學態度,自覺抵制偽科學。
(二)電解池是什么
復習原電池的原理與反應條件,結合英國化學家Humphry Davy對電解原理的貢獻事跡解釋電解的原理。
【回憶】原電池是一種利用自發氧化還原反應將化學能轉化為電能的裝置。形成原電池的前提是要有自發的氧化還原反應。在此基礎上,滿足以下要求:(1)兩個具有不同活性的導電電極;(2)電解質溶液;(3)構成閉合回路。
【分析】電解池是一種將電能轉換成化學能的裝置。1800年,英國科學家尼科爾遜和卡里斯爾利用該原理將水電解成功。之后,英國化學家戴維在此基礎上研究,發現,電解法將碳酸鉀轉化為水溶液,在電極兩側分別得到氧和氫。認真分析后,他改用熔融的苛性鉀,實驗中與電源正極相連處有氣泡產生,與電源負極相連處產生有金屬光澤的小球,燃燒后有紫色火焰產生,這是鉀的首次發現。隨后他采用同樣的方法電解蘇打,得到了金屬鈉。戴維實驗的成功,揭示了電解的原理,電解的本質是利用外部電源所帶來的電位差,使自發氧化還原反應發生。當直流電通過電解液或熔融電解液時,離子定向移動,在兩個電極上分別發生氧化反應和還原反應,將電能轉化為化學能儲存在反應物中。
設計意圖:原電池和電解槽有一些相似之處,也有一些不同之處。復習原電池有助于學生通過比較原電池來理解記憶電解槽。在化學教學中引入化學史,使學生對化學的知識來源本身有深刻的認識,激發學生的學習興趣,提高學生的學科素養,培養學生的科研意識。
(三)如何探究電解池
【實驗探究1】電解氯化銅溶液(見圖2、圖3)
運用自制的微型實驗裝置進行電解氯化銅溶液的實驗,并引導學生思考以下問題。
思考1:
(1)通電前溶液中存在哪些離子?離子如何運動?
(2)通電后,離子如何運動?
思考2:
(1)嘗試從能量轉化的形式,歸納出電解池的定義。
(類比原電池)
(2)在實驗探究的基礎上,歸納出電解池的構成條件。
(類比原電池)
思考3:
對比原電池,從以下三個方面分析電解池的陰、陽極如何確定。
(1)與電源連接的角度。
(2)電子流向角度。
(3)反應類型角度。
設計意圖:借助生活中常用的物質和材料微電解實驗設備,成本低、少污染,增強實驗的趣味性;通過實驗將微觀粒子的反應直觀化,從宏觀到微觀,體現對電解池的先進認識。引導學生從現象中分析事物的本質,用類比的方法學習電解池的概念,降低新知識的難度,提煉電解池的一般認識思路。讓學生了解環境保護的重要性和資源的合理利用,培育可持續發展的意識和綠色化學的概念。
【動畫模擬】
設計意圖:從宏觀和微觀的角度理解電解池中電子的移動、陰陽離子的移動、陰陽兩極上的反應及其變化、電流形成的過程和原理使微觀、抽象的反應更直觀和具體,進一步體會電解的實質。
【圖形展示】
設計意圖:了解離子的放電順序,建立對電解過程的系統分析認識的思維模型,選擇不同的思維模型解決不同的問題;了解電解規律,能判斷電解產物,能寫出電解電極反應公式和總反應公式,能夠解釋證據與結論之間的關系。
【實驗探究2】電解碳酸鉀溶液
【實驗探究3】電解硫酸鈉溶液
思考:結合兩個探究實驗中離子放電的先后,試分析離子的放電順序由什么決定。
陽極:
陰極:
電解過程中溶液的酸堿度是否發生變化?
思考:
(1)陰極區域pH試紙為什么呈藍色?陽極區域pH試紙為什么呈紅色?
(2)為什么電解這兩種溶液就是電解水?
設計意圖:通過實驗發現新的問題,通過推理解決問題,進一步將離子的放電順序理解為還原性和氧化性的順序,從而提高對電解原理的理解。建立惰性電極時電極產物判斷的解題思路。
【小結】
(1)電解的原理。
(2)歸納總結出電解池的電解規律。
(3)分析電解反應(惰性電極)的一般思路。
①明確溶液中存在哪些離子。
②陰陽兩極附近有哪些離子。
③根據陽極氧化、陰極還原,氧化性、還原性的強度依次判斷反應的離子,最終得到產物。
(4)分析判斷產物的四象限法。
設計意圖:培養學生的概括能力和升華知識的能力,不只停留在表面;培養學生分析判斷電極產物的一般思路;從宏觀現象出發,建立電解原理的思維模型,能夠從不同的視角出發,總結出物質及其變化的模型異同,確保學生模型認知核心素養的落實。
(四)研究電解池的價值
1.氯堿工業
【分析】傳統的電解池
常規電解槽電解飽和鹽水,陽極:2Cl--2e-=Cl2↑,陰極:2H2O+2e-=H2↑+2OH-,總反應:2H2O+2NaCl ? ?Cl2↑+H2↑+2NaOH。該裝置電解飽和食鹽水得到的產物不純,陽極產生的氯氣與溶液中的氫氧化鈉發生反應,另外該裝置還存在安全隱患,兩電極產生的Cl2和H2混合遇火或遇強光會爆炸。
【思考】如何解決產品不純以及H2、Cl2混合爆炸的問題?
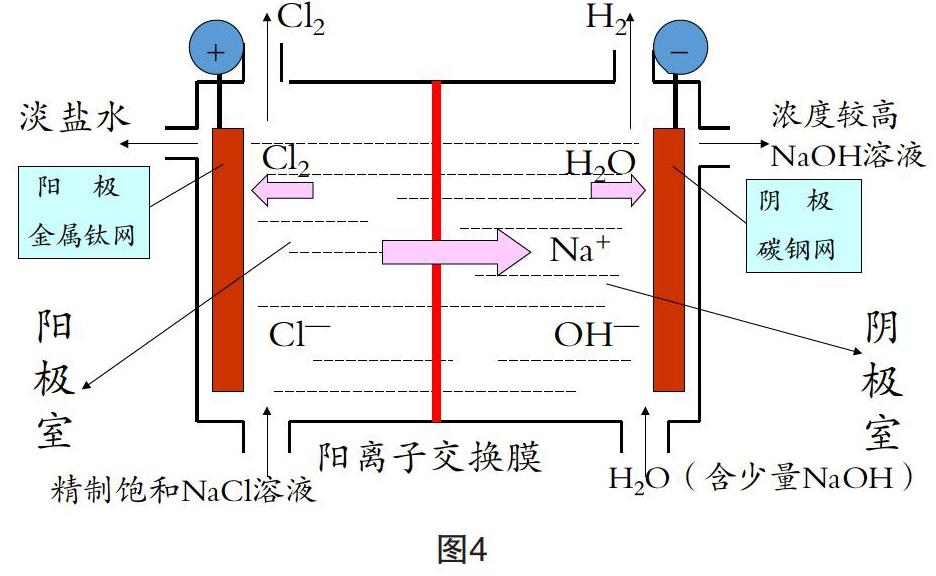
【解釋】避免這些問題的出現,就要避免OH-與Cl2的接觸,避免H2與Cl2的接觸,因此可采用陽離子交換膜將這些物質分開(見圖4)。
【分析】氯堿工業的流程
氯堿工業用陽離子交換膜將電解槽分為陽極室和陰極室。陽極由鈦制成。陽極室與精制飽和NaCl溶液連接,氯離子放電產生Cl2。陰極以碳鋼為電極材料,為了提高溶液的導電性,將含有少量NaOH的水引入陰極室,電極反應為:2H2O+2e-=H2↑+2OH-。由于裝置中使用的陽離子交換膜,只允許陽離子通過,陰離子和氣體都不能通過,Cl2就不會和NaOH反應,H2和Cl2也不會混合,就可避免上述問題的出現。
設計意圖:從實際問題出發,將課堂知識應用到工業生產中,發揮理論對工業生產的指導作用,培養學生理論聯系實際的觀念,針對化學工藝上存在的不足,提出解決問題的方案。
2.電鍍
【思考】電鍍過程中陰陽極材料和電鍍液如何選擇?
【解釋】電解池中陽極失電子,所以待鍍金屬不能放陽極,應作為陰極材料使用。沉積金屬在陽極失去電子以獲得金屬離子,為了在陰極電鍍部分形成沉積金屬,電解液必須是含有沉積金屬離子的鹽溶液。
【分析】電鍍原理
根據電解槽的工作原理,以電鍍金屬為陽極材料,以要鍍金的產品為陰極材料。如果要在鐵件上鍍銅,以銅為陽極,鐵鍵為陰極,CuSO4溶液為電鍍液,陽極:Cu-2e-=Cu2+,陰極:Cu2++2e-=Cu,電解前后電鍍液的組成和酸堿性均不變(見圖5)。
設計意圖:能夠根據實際條件運用所學知識,解決生活、生產中存在的問題,培養學生應用化學知識的能力,同時也增強學生的學習積極性。
3.銅的電解精煉
【思考】銅的電解精煉過程中兩極材料及電解液如何選擇?
【分析】銅的電解精煉原理
粗銅中含有鋅、鐵、銀、金等雜質,從而降低了銅中雜質的含量,為了提高銅的性能,回收粗銅中的貴金屬,對粗銅進行電解精制。根據電解池的原理,陽極失去電子。因此,應采用粗銅作為陽極材料。在電解過程中,陽極材料的金屬失去電子,使金屬正離子進入溶液中。陰極得電子,銅離子在陰極得電子附著在陰極材料上,因此以純銅作為陰極材料,以含有相應金屬離子的鹽溶液CuSO4作為電解液。根據金屬的活潑性知金屬失電子能力大小順序為:Zn>Fe>Ni>Cu>Ag>Au,所以電解過程中,陽極依次發生:Zn-2e-=Zn2+、Fe-2e-=Fe2+、Ni-2e-=Ni2+、Cu-2e-=Cu2+,銀和金以陽極泥的形式沉積在電解池的底部。此時溶液中的陽離子得電子能力大小順序為:Cu2+>Ni2+、Fe2+、Zn2+,所以陰極電極方程式為:Cu2++2e-=Cu,Ni2+、Fe2+、Zn2+等留在溶液中(見圖6)。
設計意圖:用課堂知識去分析工業生產,化學將與生活、生產緊密相連,提高學生的學習積極性,同時進一步鞏固電解過程中放電順序的知識,從已有的認知模型出發,認識模型的局限性,能夠從不同的模型出發,解釋復雜的化學問題。
4.電解冶金
【思考】金屬的冶煉有哪些方法?
根據活動性順序表,排在最后的Pt、Au,在自然界中穩定存在,可用物理方法得到;汞和銀主要以氧化物的形式存在,可通過熱分解得到;Zn、Fe、Sn、Pb、Cu在自然界中以化合物的形式存在,可以通過熱還原得到。
【思考】活潑金屬K、Ca、Na、Mg、Al如何冶煉?
【解釋】鉀、鈣、鈉、鎂和鋁都是活性金屬,它們都以化合物的形式存在于自然界中。冶煉的本質是使礦石中的金屬離子通過電解獲得電子,并從化合物中還原。
【思考】能否通過電解活潑金屬對應的鹽的水溶液制備金屬單質?
【解釋】如果電解水溶液,如NaCl溶液,其水溶液中的陰極放電為水中的H+,則無法得到鈉元素物質,也無法通過電解鹽水溶液制備活性金屬元素物質。
【分析】電解冶金原理
制備電解熔融狀態的鹽溶液,如電解熔融NaCl:陽極2Cl--2e-=Cl2↑,陰極:Na+ +e-=Na,總反應:2NaClNa+Cl2↑,即可制備得到Na單質。主要針對金屬氧化物熔點高的特點,在工業生產中采用電解氯化鉀、鈣、鈉、鎂等金屬氧化物的方法,在熔融狀態下制備鉀、鈣、鈉、鎂等金屬氧化物。
【思考】鋁元素是如何制備的?AlCl3的電解法能制備Al嗎?
【解釋】AlCl3是一種共價化合物。在熔融狀態下,AlCl3沒有自由移動的離子,也不導電。因此,Al不能在熔融狀態下電解AlCl3制備。工業上,金屬鋁是由熔融狀態的氧化鋁電解而成的。由于Al2O3的熔點較高,電解過程中需要加入冰晶石來降低電解的熔點。陽極:2O2--4e-=O2↑,陰極:Al3++3e-=Al,總反應:2Al2O3(熔融) 4Al + 3O2↑。
設計意圖:步步引導得出活潑金屬單質的制備方法,增強學生對問題的分析能力,同時運用課堂知識解決工業生產問題,提高學生的學習興趣。
【思維拓展】如果你是凈水器公司的職員,公司老總想讓你設計一款可以出酸性水或堿性水的凈水器,你該怎么設計?(見圖7)并寫出凈水器的工作原理。(見圖8)
思考:我們能得到弱堿性水或弱酸性水嗎?
【課后拓展】家庭自制消毒液。
原理:Cl2+2NaOH=NaCl+NaClO+H2O(消毒液有效成分:NaClO)
利用家里的電池、導線、廢飲料瓶、食鹽等,組裝一套電解氯化鈉溶液的裝置。
設計意圖:本課程的第一部分和最后一部分將幫助學生用所學知識解決實際問題,實現“化學源于生活,服務于生活”的價值。培養核心化學社會責任素養,深刻理解化學、技術、社會與環境的關系。將課堂知識運用到日常生活中,提高學習積極性,為后續學習做好準備。
WWHW教學模式用于指導電解池的學習,符合學生的認知規律,能幫助學生厘清自己的學習思路,有利于學生對知識的深入理解;幫助學生從知識認識論的角度出發,擴展思維方式,從更深層面去分析知識,理解知識的本質,改變學習方式。從化學史與化學發展科學趨勢設置多樣化的化學課程,應重視教學內容結構化的整合,從多維度評價學生核心素養在不同階段的實施情況,實現“教、學、評”一體化;從解決生活、生產的問題出發,將“問—學—用”緊密聯系在一起,真正實現將化學知識付諸生活及生產實踐,體現化學課程目標的價值追求。
【參考文獻】
[1]羅敏.將學生發展核心素養目標切實貫徹到學校教育中的思考[J].中國教育技術裝備,2017(7).
[2]屈春蕓.基于生本體驗,構建學科觀念——“電解池的工作原理及應用”教學設計與思考[J].化學教與學,2016(9).
[3]文澤.高中化學如何有效進行綠色化學教學[J].讀與寫(上旬刊),2019(31).
[4]湯蕾.學習遷移理論在高中化學教學中的實踐研究[D].武漢:華中師范大學2016.
【作者簡介】黎耀中(1981— ),男,廣西玉林人,大學本科學歷,高級教師,研究方向為化學教育;唐 靜(1992— ),女,廣西桂林人,碩士研究生學歷,二級教師,研究方向為化學教育;張小麗(1995— ),女,廣西桂林人,大學本科學歷,二級教師,研究方向為化學教育。
(責編 李小林)

